CT灌注成像及血清学指标在肝纤维化诊断中的研究
聂聪科, 刘江彬, 王 皓, 谭 凡, 王云玲
(1新疆医科大学第二附属医院影像中心, 2新疆兵团第七师医院, 乌鲁木齐 830063)
研究表明,肝纤维化经积极有效的治疗,可发生逆转[1],因此对肝纤维化进行血生化检查、影像学检查以及一些实验室检查等一直是研究的热点。近些年来,双源CT相对于传统多层螺旋 CT的优势在于采用短时间间隔、大螺距、往复扫描模式实现了全肝灌注[2],为弥漫性肝病血流动力学的评估提供了可靠的硬件及软件基础。本研究将双源CT灌注成像应用于兔肝纤维化模型,以病理结果为标准,检测不同分期肝纤维化肝灌注参数以及血清学指标,探讨双源CT灌注参数值联合血清学指标在诊断肝纤维化分期的应用价值。
1 材料与方法
1.1实验动物与试剂本研究通过伦理委员会审核通过。健康新西兰大白兔70只,雌雄不限,体质量约2.5~4.5 kg,平均(3.4±1.1)kg,由新疆医科大学动物实验中心提供。随机分成两组,实验组60只,对照组10只。四氯化碳(CCl4天津永晟精细化工有限公司),橄榄油(托雷斯和利贝雷斯公司),透明质酸(hyaluronic acid, HA),层黏连蛋白(laminin, LN), Ⅲ型前胶原(type Ⅲ procollagen, PC Ⅲ)及Ⅳ型胶原(Ⅳ-C)试剂盒购自北京科美东雅生物技术公司。DFM-96全自动γ计数仪(合肥众成公司)。
1.2动物模型与血清制备实验组经腹腔注射10%CCl4橄榄油溶液,对照组注射生理盐水,0.1 mL/kg,1 w2次,共24 w,均给予常规动物饮食,每隔4 w行双源CT灌注扫描。实验前禁食水8 h左右,去除耳朵及腹部体毛,经耳缘静脉留置套管针,采血5 mL,4 000 r/min离心10 min,静置留取血清,-80℃冰箱保存备用。给予3%戊巴比妥钠进行麻醉。待瞳孔反射变浅、肌张力明显下降时,将兔子以俯卧位固定于扫描床,给予腹部加压带包扎控制呼吸,然后进行扫描。扫描结束后6 h,耳源静脉给药至深度麻醉,开腹取肝脏进行病理检查。
1.3CT灌注扫描采用双源CT(Somatom Definition Flash,Forcheim,Germany)及双筒高压注射器,按2 mL/kg的比率、0.4 mL/s的流率团注碘普罗胺(370 mg/mL),以同样流率追加等量生理盐水。采用新双源全肝灌注模式扫描,扫描30个动态,每个动态1.5 s,共45 s。管电压80 kV,管电流70 mAs,准直宽度分别为32 mm、1.2 mm,层厚3 mm。
1.4肝纤维化病理学分期取材层面应尽量与图像上的ROI选取层面相一致,分别行HE及Masson染色,然后进行分期。肝纤维化分期标准参照2002年肝纤维化诊断评估标准[3]:0期:无纤维化;1期:汇管区纤维化扩大,局限于窦周和小叶内纤维化;2期:汇管区周围纤维化,纤维间隔形成,小叶结构保留;3期:纤维间隔伴小叶结构紊乱,无肝硬化;4期:早期肝硬化。
1.5血清学指标检测由-80℃冰箱取出,按照北京科美东雅生物技术公司所提供试剂盒操作步骤,均采用放射免疫法,检测HA、PCⅢ、Ⅳ-C和LN值。采用DFM-96全自动γ计数,进行统计学分析。

2 结果
2.1造模情况实验组兔60只,死亡14只,死亡率为23.3%。死亡原因有肝损伤、腹腔出血、腹泻等。造模兔符合灌注软件分析要求的共40只。对照组兔10只全部存活并完成检查。
2.2病理检测结果实验组兔肝脏质地不均,表面呈不小不等颗粒状改变;HE染色可见纤维间隔包绕正常肝组织形成假小叶(图1 a);Masson染色可见蓝色胶原纤维沉积(图1 b)。病理分期:1期为11只,2期为12只,3期为9只,4期为8只。对照组:肝脏表面光滑,正常肝小叶结构存在,肝细胞排列整齐,全部纳入0期。
2.3灌注及血清学检查结果将所得灌注图像传送至Syngo Volume perfusion CT体部灌注软件进行分析,通过软件后处理生成相对应的时间密度曲线(图2),然后通过色阶赋值生成相应的灌注伪彩图。避开大血管及胆道,分别在肝左叶、右叶图像上共选取6个感兴趣区,计算获得ALP、PVP、HPI、BF、BV的平均值(图3)。
随着肝纤维化分期的增加,PVP值呈下降趋势(P<0.05),HPI值呈上升趋势(P<0.05),ALP先轻度下降后然后上升(P>0.05)(表1)。PVP S2、S3、S4分别低于S0、S1期,差异有统计学意义(P<0.05)。PVP与肝纤维化的严重程度呈负相关(r=-0.84,P=0.013),HPI与肝纤维化的严重程度呈正相关(r=0.62,P=0.021)。BF、BV、ALP与肝纤维化严重程度无相关性(P值均>0.05)。HA、PCⅢ、IV-C和LN均逐渐增随着肝纤维化程度加重而升高(表2),血清学指标HA、IV-C与肝纤维化程度关系较为密切(r=0.75,P<0.05;r=0.62,P<0.05)。

a: HE染色显示大量纤维包绕形成假小叶(HE×100)

b: Masson染色显示大量纤维包绕形成假小叶(Masson×100)
图1实验组病理结果
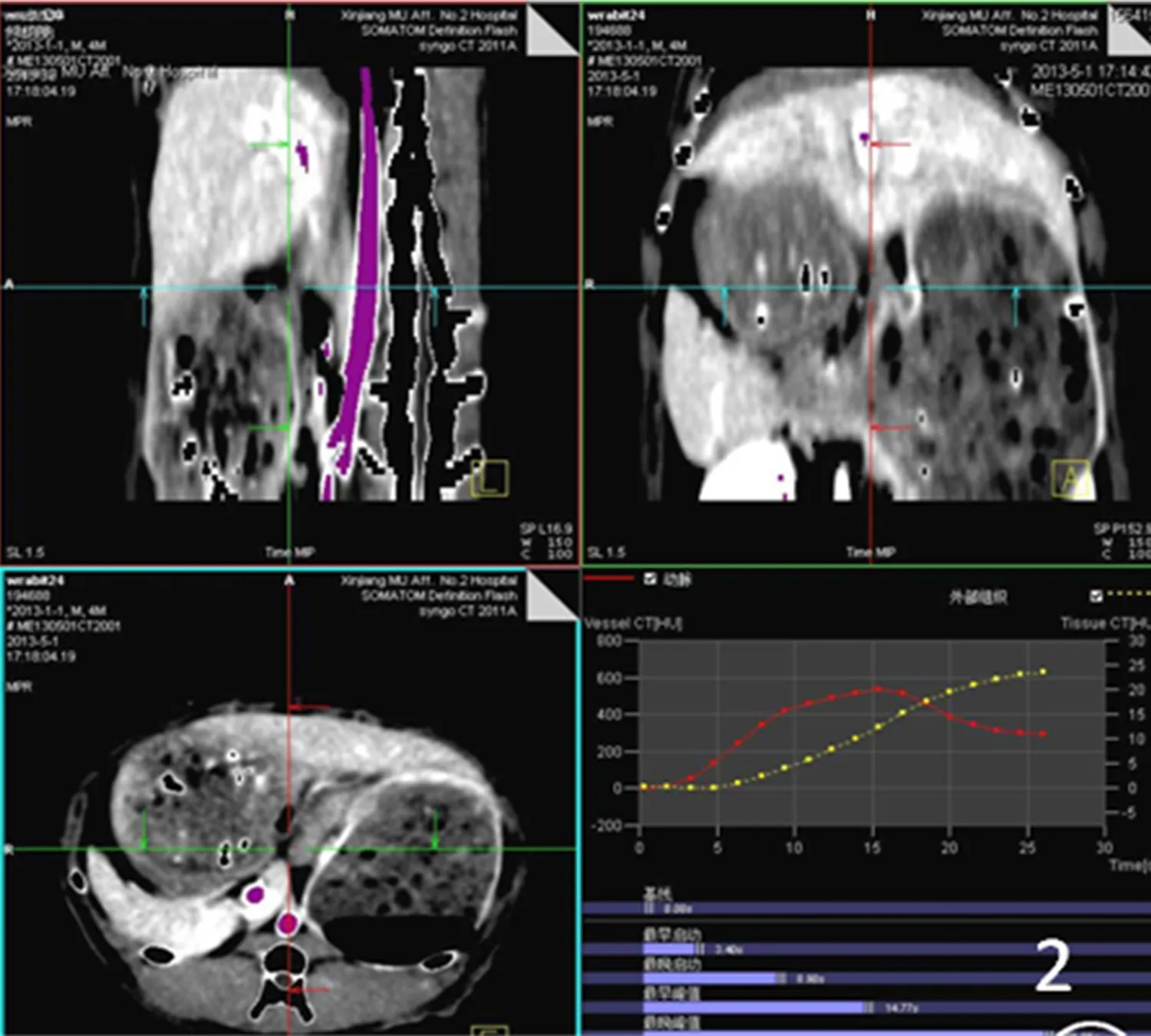
图2后处理图像生成动脉(红色)、外部组织(黄色)时间密度曲线
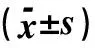
表1 不同肝纤维化分期的肝灌注参数比较
注:与S0比较,*P<0.05;与S1比较,△P<0.05。
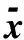
表2 不同肝纤维化分期的血清学指标比较(μg/L, ±s)
注:与S0比较,*P<0.05;与S1比较,△P<0.05。
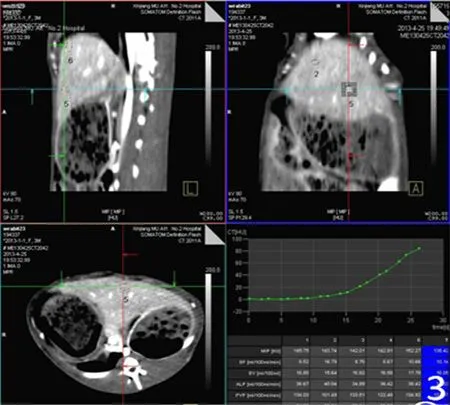
图3 多平面重建选取感兴趣区并得到相应灌注值
3 讨论
目前,诊断肝纤维化的金标准为肝穿刺活检,其为有创检查,不便动态的随访及复查,不易为患者所接受[4]。部分学者主要集中在探讨影像学或血清学指标在早期诊断肝纤维化中的应用,如何能够将二者充分利用其优势来互补,是研究中热点。肝纤维化是当炎症刺激或者其他因素导致细胞水肿、坏死时,细胞外基质异常增多或者过度沉积的一个可逆转的病理过程,主要表现为肝内纤维结缔组织增生。其随着病程加重可进展为肝硬化。随着病程的演变,病理改变主要表现为细胞水肿进而坏死、广泛纤维间隔形成以及肝细胞结节样增生。这些病理变化在早期通过形态学往往难以发现,但有研究表明,肝小叶结构的血液循环途径已经逐步发生变化。因此,通过CT灌注寻找出早期能够反映血流动力学变化的特征性指标是值得探讨的。
常规螺旋CT灌注成像在注入对比剂的同时对选定的层面进行连续扫描,以获取该层面内每一像素的密度随时间变化的曲线,并通过不同的数学模型计算出血流灌注参数,从而对组织的血流动力学的变化做出评价。由于受限于探测器的宽度,只能局限于对选定的层面进行评估。而双源CT的4D扫描覆盖范围达48 cm,实现了全脏器容积灌注。通过调整采集时间窗,4D螺旋技术可以减低辐射剂量,同时可以获得最好的时间分辨率。本研究采用的数学模型是适于对器官组织进行灌注测量的最大斜率法,其优点是不需要静脉时间密度曲线的计算,扫描时间相对短,检查流程快。同时后处理软件可实现系统运动伪影校正,同时应用4D降噪技术保证图像拥有更好的信噪比,能够更直观对图像进行分析以便能够更准确地反映血流动力学的变化。
本实验结果显示PVP随着肝纤维化严重程度的升高,呈现出下降趋势,且差异具有统计学意义。考虑是由于微循环及结构因素的共同影响,早期微循环发生障碍导致肝细胞缺血肿胀压迫门脉,导致门脉灌注量下降[5]。随着小叶纤维间隔出现(S1期)逐渐加重至最终假小叶形成(S4期),肝内微循环发生显著的变化,加之门脉血管扭曲、变形,血流灌注阻力明显加大,进而明显减少肝内血管床面积。从组织学方面来说,门脉相对于肝动脉来说,管壁平滑肌纤薄,因此受挤压影响相对较重[6]。这些因素共同作用均导致门脉灌注下降,且随着疾病严重程度加重表现的更为明显。从S0到S4期,ALP表现为先减低后逐渐升高,这与章雅琴等[7]的研究结果存在着差异,但各组间差异无统计学意义。考虑早期ALP减低是由于局部血流微循环成分发生改变,血液粘度增加,血供减弱,引起肝细胞缺血、坏死,继而刺激肝间质纤维增生,压迫肝血窦导致肝动脉灌注减低。后期灌注量升高考虑是由于PVP持续下降,为了维持总肝灌注量,肝脏发挥内源性调控作用,所以肝动脉灌注量呈现出上升趋势,即便在统计学上各组间无明显差异。而HPI 之所以逐级升高, 尤其是在后期肝动脉的血流灌注量权重比增大时, 这与肝脏自身调节功能是存在关系的,因此在评价HPI时, 要考虑到 HPI是一个相对值, 受门脉及动脉供血的双重影响[8]。另外,本研究中BF、BV与肝纤维化分期无相关性,与一些学者所报道的BF、BV随着肝纤维化的严重程度加重而减小的结果不一致[9-10],推测其原因可能是全肝各段灌注情况存在差异,本研究实行的是全肝灌注扫描相比选定的层面进行扫描所得到的数据更为准确。
血清学指标HA、PCⅢ、IV-C和LN随着肝纤维化的加重,表现为逐步升高,且以HA、IV-C与肝纤维化程度相关性为著。纤维化时,细胞外基质明显增加,而血清学指标均属于细胞外基质成分,因此血清学指标能够充分地反映肝纤维化程度。HA 提示肝窦毛细血管化,主要反映内皮细胞功能。本研究发现HA在S0、S1、S2期与S3、S4期中差异有统计学意义,与文献报道的一致,对重度肝纤维化有较大的价值。IV-C与持续沉积的LN是基底膜的主要成分,导致肝窦毛细血管化。有研究表明,LN与门静脉高压程度呈正相关[11]。本研究中IV-C除了S0、S1期差异无统计学意义外,其余各期都有差异,表明IV-C能够很好地反映肝纤维化的活动进程。
总之,双源灌注成像可以得到反映肝纤维化血流灌注情况的定量参数,从血管微循环的水平评估组织代谢情况,是一种非侵入性的评价方法,安全、可靠,将肝灌注的血流动力学指标与血清学的指标相结合,对临床诊断肝纤维化、动态随访及监测预后有着良好的应用前景。
参考文献:
[1] Parkes J, Guha IN, Harris S, et al. Systematic review of the diagnostic performance of serum markers of liver fibrosis in alcoholic liver disease[J]. Comp Hepatol,2012,11(1):5.
[2] 苏佰燕,金征宇,刘炜,等. 第二代双源CT对肝脏八段灌注成像的特点[J]. 中国医学科学院学报,2010,32(6):655-658.
[3] 中华肝脏病学会肝纤维化学组. 肝纤维化诊断及疗效评估共识[J]. 中华肝脏病杂志,2002,10(5):327-328.
[4] 范强,佐合拉古丽·木塔力甫,阿地力江·伊明,等. 小茴香对大鼠肝纤维化及脂质过氧化的影响[J]. 新疆医科大学学报,2011,34(9):958-962.
[5] Yeh BM,Shepherd JA,Wang ZJ,et al. Dual-energy and low-kVp CT in the abdomen[J]. AJR, 2010,193(1):47-54.
[6] Zeng Y, Zhao JN, Wu W, et al. Establishment of liver fibrosis in rabbit model and quantitative study on hepatic perfusion with dynamic whole-liver 3D MR imaging[J]. Zhonghua Gan Zang Bing Za Zhi,2009,17(5):350-353.
[7] 章雅琴,胡跃群,廖云杰,等.犬肝纤维化模型MR弥散张量成像及其与CT灌注参数、VEGF表达的相关性[J]. 中国医学影像技术,2012,28(2):216-220.
[8] Varenika V, Fu Y, Maher JJ, et al. Hepatic fibrosis: evaluation with semiquantitative contrast-enhanced CT[J]. Radiology,2013,266(1):151-158.
[9] 杨保智,郭顺林,郭吉刚,等. 64层螺旋CT灌注成像对肝纤维化的临床应用研究[J]. 中国医学影像技术,2008,24(4):565-569.
[10] 李芃,赵建农,钟维佳,等.320排容积CT全肝灌注成像模式的初步应用[J]. 临床放射学杂志,2013,32(3):352-355.
[11] Vermehren J, Vermehren A. Assessment of liver fibrosis and associated risk factors in HIV-infected individuals using transient elastography and serum biomarkers[J]. BMC Gastroenterol,2012,2(24):12-27.

