罗伯茨虫草及其无性型活性成分分析*
郭 瑞,贾学渊,虞 泓,曾文波,陈自宏,杨俊媛
(云南大学中草药生物资源研究所云百草实验室,云南 昆明 650091)
罗伯茨虫草及其无性型活性成分分析*
郭 瑞,贾学渊,虞 泓**,曾文波,陈自宏,杨俊媛
(云南大学中草药生物资源研究所云百草实验室,云南 昆明 650091)
以10株野生罗伯茨虫草及其无性型罗伯茨被毛孢液体发酵菌丝体为研究对象,采用比色法和高效液相色谱法(HPLC)分别测定其多糖、甘露醇、尿嘧啶、尿苷、鸟苷、腺嘌呤、腺苷及虫草素等活性成分含量,并与西藏那曲野生冬虫夏草作比较。结果表明,罗伯茨虫草尿嘧啶含量高于冬虫夏草,尿苷、鸟苷、腺嘌呤、腺苷含量与冬虫夏草接近,而多糖和虫草素含量与冬虫夏草差距较大。在10株罗伯茨被毛孢中,菌株HRT06的多糖、尿苷、鸟苷及腺苷含量最高,与其余菌株有显著性差异(p<0.05),且菌株HRT06的腺苷含量为0.140 mg·g-1,达到中国药典冬虫夏草腺苷含量不得少于0.100 mg·g-1的规定,可以筛选作为优良菌株加以利用。本研究测定罗伯茨虫草及其无性型罗伯茨被毛孢活性成分含量,为综合评价罗伯茨虫草应用价值及其开发利用提供科学依据。
罗伯茨虫草;罗伯茨被毛孢;多糖;甘露醇;核苷
罗伯茨虫草Ophiocordycepsrobertsii(Hook.)G.H.Sung,J.M.Sung,Hywel-Jones & Spatafora,为罗伯茨被毛孢寄生于蝙蝠蛾科幼虫上形成的子座及幼虫尸体复合体。本实验室首次从罗伯茨虫草中分离出罗伯茨虫草无性型,经分子和形态鉴定其为罗伯茨被毛孢Hirsutellarobertsii(Hook.)Hook,与冬虫夏草无性型中国被毛孢HirsutellasinensisLiu,Guo,Yu & Zeng同属于被毛孢属Hirsutella,而罗伯茨被毛孢其生长速度及生物量优于中国被毛孢。在系统地位上,罗伯茨虫草和冬虫夏草同属于线虫草属Ophiocordyceps,且在多基因系统发育树中与冬虫夏草紧密聚为一支,表明罗伯茨虫草和冬虫夏草具有非常近的亲缘关系[2]。罗伯茨虫草作为冬虫夏草近缘种,对其研究不仅能推动冬虫夏草系统与进化研究,并且可以作为冬虫夏草补充或替代资源,缓解人们对冬虫夏草的需求压力。
目前,国内外对罗伯茨虫草研究不多见,仅中国真菌志等少数几篇文献有所报道[1,3-7],尚未见对罗伯茨虫草活性成分和罗伯茨被毛孢活性成分的研究。本研究通过HPLC和比色法测定10株罗伯茨虫草及其无性型罗伯茨被毛孢活性成分含量,与西藏那曲冬虫夏草作比较,并筛选活性成分含量高的优良菌株,为罗伯茨虫草深入研究及其开发利用提供科学依据。
1 试剂及仪器
1.1 试剂
多糖(110833-200904)、甘露醇(100533-201002)、尿嘧啶(100469-200401)、尿苷(110887-200202)、鸟苷(140631-200904)、腺嘌呤(110886-200001)、腺苷(110879-200202)和虫草素(110858-200202)标准品,购自中国食品药品检定研究院;甲醇为色谱纯。
1.2 仪器
戴安ULTIMATE 3000高效液相色谱仪:LPG-3400A 四元梯度泵、WPS-3000SL自动进样器、PDA-3000二极管阵列检测器、TCC-3000柱温箱、戴安原装ACCLAIM C18色谱柱、5 μm,4.6000 mm×250 mm,“变色龙”(Chromeleon 6.80)控制分析色谱工作站软件;高速万能粉碎机FW-100,北京中兴伟业仪器有限公司;北京普析T-6紫外可见分光光度计。
1.3 材料
本试验材料罗伯茨虫草采自云南省昭通市水富县铜锣坝国家森林公园(表1),根据形态、ITS及多基因分子系统分析,鉴定为Ophiocordycepsrobertsii(Hook.)G.H.Sung,J.M.Sung,Hywel-Jones & Spatafora。本研究菌株分离自罗伯茨虫草,根据形态、ITS及多基因分子系统分析,鉴定为Hirsutellarobertsii(Hook.)Hook,为罗伯茨虫草无性型。冬虫夏草Ophiocordycepssinensis(Berk.)G.H.Sung,J.M.Sung,Hywel-Jones & Spatafora采自西藏那曲。
表1 本研究实验材料来源
1.4 样品的制备
分别从10株不同罗伯茨新鲜虫草样品的菌核或子实体中分离出罗伯茨被毛孢菌株,菌株编号为HRT01~HRT10,在固体PPDA培养基上,18℃活化培养 60 d,取 1 cm2大小的菌块放入含 100 mL 液体PPDA培养基的三角瓶中,置于转速为100 r·min-1的摇床上18℃恒温摇菌培养 21 d,再静止培养 60 d。将三角瓶中的菌丝体取出,40℃恒温干燥,粉碎至80目待用。将分离菌种后的野生罗伯茨虫草分别标记为ORT01~ORT10,40℃恒温干燥,粉碎至80目待用。冬虫夏草40℃恒温干燥,粉碎至80目待用。
2 试验方法
2.1 多糖含量测定方法
称取虫草粉 0.100 g,90℃水浴热回流 2 h,冷却后用滤纸过滤,蒸馏水定容至 50 mL。吸取定容好的溶液 20 mL,70℃水浴挥干,加 1 mL 蒸馏水溶解,再加 5 mL 无水乙醇,4 000 r·min-1离心 15 min,弃上清液,加 1 mL 蒸馏水将沉淀彻底溶解,重复3次。最后加水将沉淀溶解并定溶至 50 mL。取溶液 2 mL,加入质量分数为5%苯酚溶液 1 mL,迅速加入 7 mL 浓硫酸,然后40℃水浴 30 min,冰浴 5 min,降至室温后用紫外分光光度计在 490 nm 处测定其吸光度,以蒸馏水代替供试品溶液,同样方法制作空白对照[8,9]。
2.1.1 多糖标准曲线
分别制备质量浓度为10 mg·L-1、20 mg·L-1、30 mg·L-1、40 mg·L-1、50 mg·L-1的多糖标准品溶液,按多糖含量测定方法操作,以蒸馏水代替标准品溶液同样方法制作空白对照,490 nm 处测定吸光度。以多糖标准品溶液质量浓度Y为纵坐标,吸光度A为横坐标绘制标准曲线,求出回归方程为Y=73.502X+1.5366,r=0.9994,线性范围为10 μg·mL-1~50 μg·mL-1。
2.2 甘露醇含量测定方法
精密称取虫草粉 0.100 g,加入 20 mL 蒸馏水,90℃水浴热回流 2 h,冷却后滤纸过滤,蒸馏水定容至 50 mL。取溶液 1 mL,加入 1 mL 高碘酸钾溶液,再加入质量分数为0.1% 的L-鼠李糖 2 mL 和新鲜配制的NaSh溶液 4 mL,53℃水浴加热 15 min,显色后冷却至室温,412 nm 处测定溶液吸光度。以蒸馏水代替供试品溶液,同样方法制备空白对照[10,11]。
2.2.1 甘露醇标准曲线
分别制备质量浓度为20 mg·L-1、30 mg·L-1、40 mg·L-1、50 mg·L-1、60 mg·L-1的甘露醇标准溶液,按“甘露醇含量测定方法”分别操作,以蒸馏水代替标准品溶液同样方法制作空白对照,在 412 nm 处分别测定吸光度。以甘露醇质量浓度Y为纵坐标,吸光度X为横坐标绘制标准曲线,求出回归方程为Y=59.535X+2.1864,r=0.9991,线性范围为20 μg·mL-1~60 μg·mL-1。
2.3 罗伯茨虫草核苷类成分测定(HPLC)
精密称取虫草粉 0.100 g,置于 5 mL 离心管中,加入质量分数为20%的甲醇溶液 2 mL,超声 90 min,放置至室温,用 0.450 μm 微孔滤膜过滤,滤液即为供试品溶液,注入高效液相色谱仪中检测。
2.3.1 色谱条件
流动相:甲醇-水为流动相(15∶85);流速:1.000 mL·min-1;检测波长:260 nm;柱温:30℃。该色谱条件下,8种核苷类峰图与相邻色谱峰均基线分离[12-16]。
2.3.2 线性关系的制备
精密称取干燥至恒重的标准品,尿嘧啶、尿苷、鸟苷、腺嘌呤、腺苷和虫草素(3’-脱氧腺苷)各3.000 mg,分别用质量分数为20%的甲醇溶解定容至100 mL。
分别精密吸取混合对照品溶液5 μL、10 μL、25 μL、50 μL、100 μL注入液相色谱仪中,按上述色谱条件测定峰面积,以峰面积Y为纵坐标,以对照品质量浓度X为横坐标,计算回归方程。线性范围均为0.150 μg·mL-1~3.000 μg·mL-1,尿嘧啶:Y=75.724X+0.1782,r=0.9999;尿苷:Y=52.991X-0.1546,r=0.9996;鸟苷:Y=37.339X-0.0381,r=0.9996;腺嘌呤:Y=90.441X-0.3028,r=0.9999;腺苷:Y=54.827X+0.0235,r=0.9995;虫草素:Y=67.471X-0.0627,r=0.999 7。
3 结果与分析
3.1 色谱图
本研究中核苷类标准品、罗伯茨虫草、罗伯茨被毛孢的HPLC图见图1~图3。
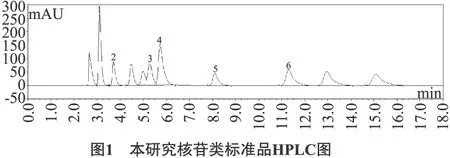
注:1为尿嘧啶Uracil;2为尿苷Uridine;3为鸟苷Guanosine;4为腺嘌呤Adenine;5为腺苷Adenosine;6为虫草素Cordycepin。

注:1为尿嘧啶Uracil;2为尿苷Uridine;3为鸟苷Guanosine;4为腺嘌呤Adenine;5为腺苷Adenosine;6为虫草素Cordycepin。
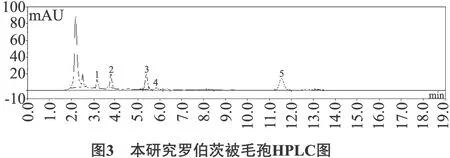
注:1为尿嘧啶Uracil;2为尿苷Uridine;3为鸟苷Guanosine;4为腺嘌呤Adenine;5为腺苷Adenosine。
由图1~图3可以看出,在该色谱条件下,各成分波峰均基线分离。罗伯茨被毛孢波峰图在 15 min 处没有波峰,因此不含虫草素。
3.2 测定结果与分析
罗伯茨虫草和冬虫夏草活性成分测定结果见表2。
由表2可知,罗伯茨虫草含有的主要活性成分种类与冬虫夏草相同,其中,罗伯茨虫草尿嘧啶含量高于冬虫夏草;尿苷、鸟苷、腺嘌呤、腺苷含量与冬虫夏草接近,但多糖和虫草素含量与冬虫夏草差距较大。罗伯茨被毛孢活性成分测定结果见表3。
如表2、表3可知,除多糖外,罗伯茨虫草主要活性成分含量都高于罗伯茨被毛孢。在10株罗伯茨被毛孢中,菌株HRT06的多糖、尿苷、鸟苷及腺苷含量为10株菌中最高,且是10株菌中唯一腺苷含量达到中国药典冬虫夏草规定(腺苷含量不得少于0.100 mg·g-1)的菌株。菌株HRT01甘露醇含量最高,菌株HRT02尿嘧啶和腺嘌呤含量最高。
3.3 HRT06菌株与其余菌株多糖、尿苷、鸟苷及腺苷含量比较
利用spss统计软件,对罗伯茨被毛孢菌株HRT06和其余9株菌的多糖、尿苷、鸟苷及腺苷含量进行多重比较。比较结果见表4。
由表4可见菌株HRT06与菌株HRT01、HRT05多糖含量相比差异显著(p<0.05),与其余7株菌株多糖含量相比差异极显著(p<0.01);菌株HRT06尿苷、鸟苷、腺苷含量与其余9株菌含量相比差异极显著(p<0.01)。
4 讨论
本研究中罗伯茨虫草主要分布于云南省昭通市水富县铜锣坝国家森林公园,其环境为亚热带常绿阔叶林,具有生物多样性丰富,雨水充足,温度适宜等特点[17]。虫草主要活性成分有多糖、甘露醇、腺苷、虫草素等,其中多糖具有提高机体免疫能力,抗疲劳、抗肿瘤,降低血胆固醇等功效[18-20];甘露醇具有利尿脱水、镇咳祛痰、平喘等多种功效[21,22];腺苷具有促进细胞分化,改善心脑血液循环,抑制蛋白质激酶和反转录酶活性等功效;虫草素具有抑制肿瘤,抗病毒,免疫调节和降血糖等功效[23-27]。虫草主要活性成分含量的高低已成为虫草产品的质控指标之一,因此通过对虫草主要活性成分含量的检测,可以为虫草内在品质的评价提供科学依据。
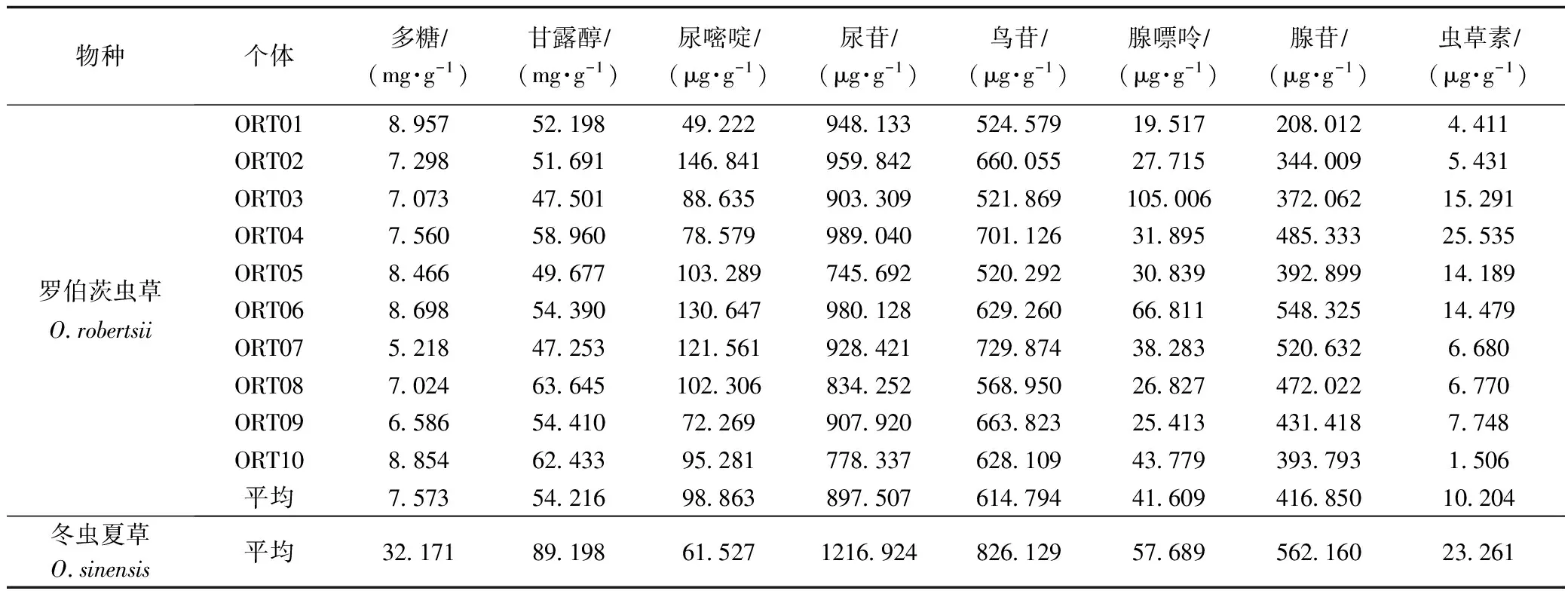
表2 罗伯茨虫草和冬虫夏草活性成分测定结果
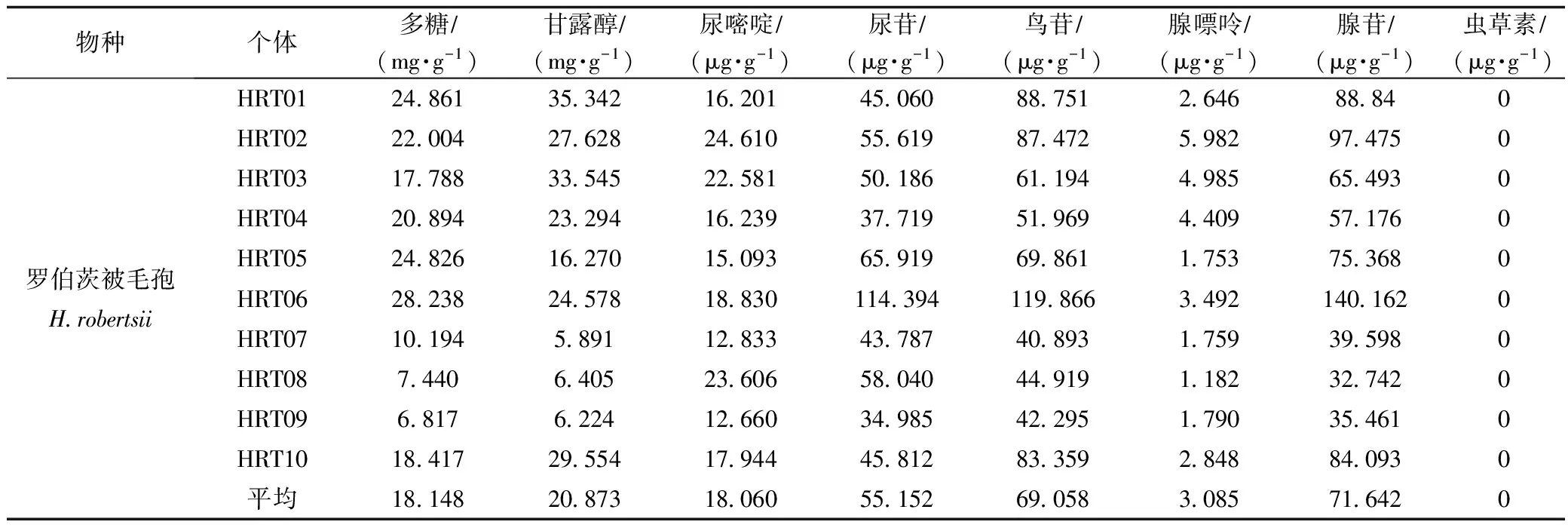
表3 罗伯茨被毛孢活性成分测定结果
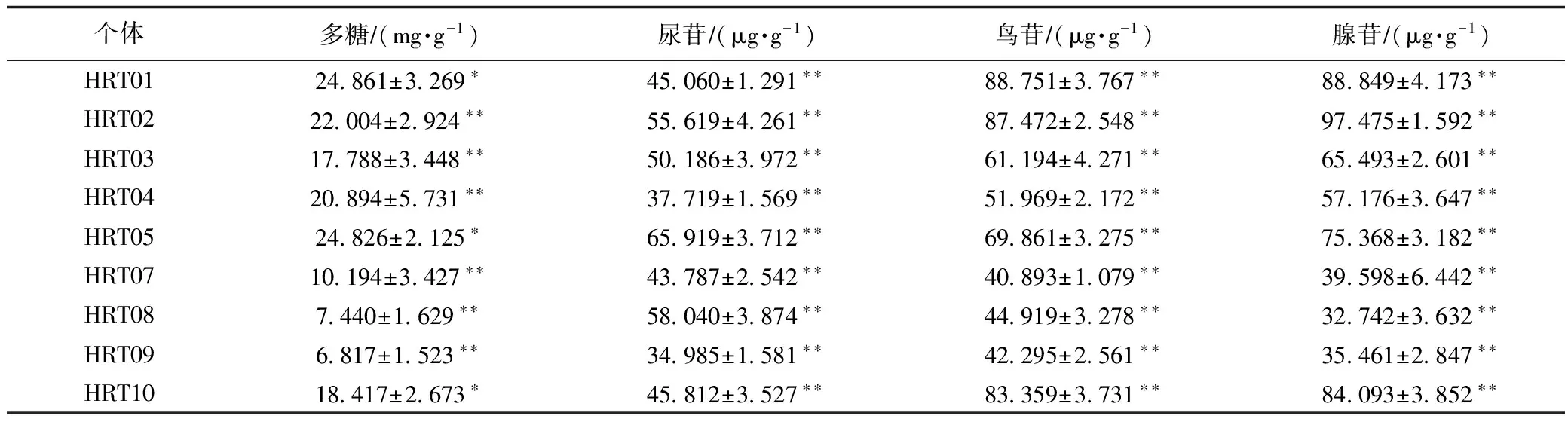
表4 HRT06菌株与其余菌株多糖、尿苷、鸟苷及腺苷含量比较结果a
注:a为多重比较结果;无*表示无统计学差异,*表示差异达到0.05显著水平,**表示差异达到0.01极显著水平。
本研究首次测定罗伯茨虫草及其无性型罗伯茨被毛孢的主要活性成分含量,研究发现,罗伯茨虫草主要活性成分种类与冬虫夏草相同;罗伯茨虫草中含有虫草素,但罗伯茨被毛孢中不含虫草素,其原因还需做下一步研究。罗伯茨虫草尿嘧啶含量高于冬虫夏草、尿苷、鸟苷、腺嘌呤、腺苷含量,与冬虫夏草接近,而多糖和虫草素含量与冬虫夏草差距较大。在10株罗伯茨被毛孢中,菌株HRT06多糖、尿苷、鸟苷及腺苷含量为10株菌中最高,且与其余9株菌株含量相比差异显著(p<0.05)。菌株HRT06是10株菌中唯腺苷含量达到中国药典冬虫夏草规定腺苷含量不得少于0.100 mg·g-1的菌株[23],因此菌株HRT06为罗伯茨被毛孢优良菌株,可用于规模化发酵生产。
目前,罗伯茨虫草还处于未开发阶段,具有较好的开发利用潜力。本研究所筛选的罗伯茨被毛孢优良菌株HRT06,生长速度及生物量都优于中国被毛孢,具有潜在应用和经济价值。因此罗伯茨虫草可以作为冬虫夏草补充或替代资源,缓解人们对冬虫夏草的需求压力。
[1]梁宗琦,刘爱英,黄建忠,等.宽阔水自然保护区的虫草及其相关真菌Ⅰ[J].真菌学报,1996,15(4):264-271.
[2]Sung GH,Nigel LHJ,Sung JM,et al.Phylogenetic classification ofCordycepsand theClavicipitaceousFungi[J].Studies in Mycology,2007,57 (1):5-59.
[3]梁宗琦.中国真菌志(虫草属)[M].北京:科学出版社,2007:120.
[4]朱国胜,刘作易,吴兴亮,等.中国滇黔桂喀斯特地区部分虫草属真菌研究[J].贵州科学,2004,22(1):27-30.
[5]宋斌,李泰辉,吴兴亮,等.滇黔桂虫草资源多样性初步研究[J].贵州科学,2004,12(4):41-44.
[6]邹方伦,钟金霞.贵州宽阔水自然保护区多孔菌种类及其生态研究[J].贵州科学,1998,16(3):221-225.
[7]Stephen T,Kevin M.HPLC levels of adenosine in awheto-lndigenous New ZealandCordycepsrobertsiiHooker (Ascomycetes)[J].International Journal of Medicinal Mushrooms,2008,10(1):55-63.
[8]史薇娜,唐庆久,唐庆九,等.比色法测定冬虫夏草和蛹虫草中多糖和甘露醇的含量[J].食用菌学报,2007,14(3):53-57.
[9]闫文娟,李泰辉,唐芳勇,等.广东虫草多糖的提取及含量测定[J].华南农业大学学报,2009,30(4):52-56.
[10]唐艳萍,李敏,余弦.冬虫夏草及其发酵虫草中甘露醇含量比较研究[J].成都中医药大学学报,2009,32(4):85-88.
[11]肖代敏,肖建辉,孙中华,等.药用虫草中甘露醇、多糖的高通量测定及提制工艺[J].食品科学,2010,31(6):11-15.
[12]王蕾,罗巍,胡瑕,等.虫草素高产菌株的筛选及不同添加物对虫草素产量的影响研究[J].菌物学报,2012,31(3):382-388.
[13]陈安徽,陈宏伟,徐洋,等.蝉花虫草中核苷类成分的分离纯化和鉴定[J].食品科学,2013,34(1):131-134.
[14]Yuan JP,Zhao SY,Wang JH,et al.Distribution of nucleosides and nucleobases in edible fungi[J].Food Chem,2008(56):809-815.
[15]Li SP,Li P,Lai CM,et al.Simultaneous determination of ergosterol,nucleosides and their bases from natural and culturedCordycepsby pressurised liquid extraction and high performance liquid chromatography[J].Journal of Chromatography A,2004(1036):239-243.
[16]Rie I,Miho N,Yen S,et al.Simple HPLC-UV determination of nucleosides and its application to the authentication ofCordycepsand its allies[J].Biomed Chromatogr,2008(22):630-636.
[17]张保兰,樊国盛,魏开云,等.铜锣坝国家森林公园生物多样性保护规划的研究[J].西南林学院学报,2004,24(4):23-25.
[18]Zhou X,Gong Z,Su Y,et al.Cordycepsfungi:natural products,pharmacological functions and developmental products[J].J Pharm Pharmacol,2009,61(3):279-291.
[19]Zhong S,Pan H,Fan L,et al.Advances in research of polysaccharides inCordycepsspecies[J].Food Technol Biotechnol,2009,47(3):304-312.
[20]刘冠军,王辉,袁芳.冬虫夏草药理作用及临床应用综述[J].黑龙江医药,2009,22(6) :866-867.
[21]Yilmaz N,Dulger H,Kiymaz N,et al.Activity of mannitol and hypertonic saline therapy on the oxidant and antioxidant System during the acute term after traumatic brain injury in the rats[J].Brain Res,2007(164):132-135.
[22]Gu YX,Wang ZS,Li SX,et al.Effect of multiple factors on accumulation of nucleosides and bases inCordycepsmilitaris[J].Food Chem,2007,102(4):1304-1306.
[23]国家药典委员会.中华人民共和国药典:一部[M].北京:化学工业出版社,2010:106.
[24]胡丰林,李增智.虫草及相关真菌的次生代谢产物及其活性[J].菌物学报,2007,26(4):607-632.
[25]刘东泽,陈伟,高新华,等.虫草菌素(3’-脱氧腺苷)研究进展[J].上海农业学报,2004,20(2):89-93.
[26]Joc Y,Urbano AG,Sweeney EB,et al.Induction of apoptosis by cordycepin in ADA inhibited Td Tpositive leukemia cells[J].Leukemia,1996,10(6):1019-1024.
[27]Yue K,Ye M,Zhou ZJ,et al.The genusCordyceps:a chemical and pharmacological review[J].Journal of Pharmacy and Pharmacology,2012(65):474-493.
Analysis on Active Components ofOphiocordycepsrobertsiiand Its AnamorphHirsutellarobertsii
GUO Rui, JIA Xue-yuan, YU Hong, ZENG Wen-bo, CHEN Zi-hong, YANG Jun-yuan
(Yunnan Herbal Laboratory, Institute of Herb Biotic Resources, Yunnan University, KunmingYunnan650091)
In this study, the ten samples of wildOphiocordycepsrobertsiiand their mycelia ofHirsutellarobertsiistrains by liquid fermentation were detected in order to analyze the active components. The contents of polysaccharide, mannitol, uracil ,uridine, guanosine, adenine, adenosine, cordycepin were determined by colorimetry and HPLC, comparing wildOphiocordycepssinensisfrom Naqu of Tibet. The results indicated that the contents of uracil inO.robertsiiwere higher than that ofO.sinensis,and the contents of uridine, guanosine, adenine and adenosine were close to those ofO.sinensis. However, the contents of polysaccharide and cordycepin inO.robertsiiwere lower than those ofO.sinensis. The strain HRT06 ofH.robertsiihad the highest contents of polysaccharide, uridine,guanosine and adenosine among the ten strains ofH.robertsii.In addition, the adenosine content of strain HRT06 was 0.140 mg·g-1,which was higher than the quality standard (0.100 mg·g-1) ofO.sinensisin Chinese Pharmacopoeia.Therefore, the strain HRT06 was selected as an excellent strain with high yield to ferment mycelia at scale.The conclusion could provide scientific basis for evaluating the potential value ofO.robertsiiandH.robertsii, and exploiting their economic and pharmaceutical values.
Ophiocordycepsrobertsii;Hirsutellarobertsii;Polysaccharide;Mannitol;Nucleoside
*项目来源:国家教育部博士点基金项目“冬虫夏草复合体种群DNA序列生态地理变异式样研究”(20125301110001);云南省基础应用研究重点项目“云南虫草遗传资源及其开发利用研究”(2008CC019)。
郭瑞(1989-),男,在读硕士研究生,主要从事虫草真菌分类及开发利用研究。E-mail∶414621016@qq.com
**通信作者: 虞泓,教授,主要从事虫草资源遗传与利用研究。E-mail∶hongyu@ynu.edu.cn或herbfish@163.com
2014-06-20
S646.9
A
1003-8310(2014)05-0054-05
———“人民的选择”

