Schlesinger法合成硼氢化钠工艺条件及优化途径
侯殿保,李海民,党亚,2
(1中国科学院青海盐湖研究所,青海 西宁 810008;2中国科学院大学,北京 100039)
Schlesinger法合成硼氢化钠工艺条件及优化途径
侯殿保1,李海民1,党亚1,2
(1中国科学院青海盐湖研究所,青海 西宁 810008;2中国科学院大学,北京 100039)
目前工业化合成硼氢化钠的工艺有Schlesinger法和Bayer法,而Schlesinger法是工业化合成硼氢化钠应用最广的工艺,其关键步骤为氢化钠和硼酸三甲酯的合成。本文一方面从氢化钠的合成、硼酸三甲酯的合成及硼氢化钠的合成3个方面详细论述了Schlesinger法合成工艺进展情况;并指出目前方法存在的问题,如采用油液分散金属钠法合成的氢化钠活性差,制约了氢化钠的应用,硼酸三甲酯工业合成过程中过多使用浓硫酸造成环境严重污染。另一方面对Schlesinger法工艺改进提出了几点设想,如企业全流程合成硼氢化钠可节约外购成本和仓储成本;硼酸三甲酯的合成取代浓硫酸的应用,提纯采用盐析的方法均可以减轻环境污染;硼氢化钠水解过程中采用稀液碱溶液代替淡水,可避免硼氢化钠水解,提高产品收率。
硼氢化钠;施莱辛格法;合成
固体硼氢化钠是常用的络合型氢化物,是一种性能独特的还原剂和高储氢密度材料,以其优良的还原性而著称。作为还原剂,硼氢化钠广泛地应用于医药、农药中间体的合成、有机化学品的纯化、纸浆的漂白脱墨、贵金属与重金属的回收及工业废水处理等诸多领域,亦可作为制备含硼化合物的原料[1-4]。因为硼氢化钠的广泛应用,21世纪又引起了社会的强烈关注。
硼氢化钠是由Brown和Schlesinger于1942年在芝加哥大学发现的。当时利用金属氢化物和硼烷合成硼氢化物过程中偶然发现生成了硼氢化钠,由于战时保密直至1953年才公开发表[5],Brown也因此获得了诺贝尔化学奖。自从硼氢化钠发现至今70多年里,有上百种硼氢化钠的合成方法被提出。硼氢化钠合成的论文发表经历了两个高峰:20世纪60年代和21世纪初,具体趋势详见图1[6]。硼氢化钠主要的合成的方法有Schlesinger法、Bayer法[8]、电解法[9-10]、直接还原法[11]、机械-化学还原法[12-14]、微波法[15]等,目前工业化的方法有Brown-Schlesinger法和Bayer法,而Brown-Schlesinger法是目前应用最普遍最广的工艺[7]。
Schlesinger法是利用氢化钠和硼酸三甲酯作为原料于523~553K合成硼氢化钠的,具体反应方程式如(1)所示。
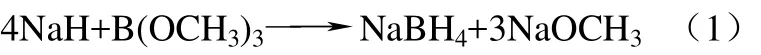
加酯过快时有不良反应,如式(2)。

其中氢化钠主要由金属钠与氢气反应得到,硼酸三甲酯则由硼酸与甲醇反应得来,具体反应式分别如式(3)和式(4)所示。
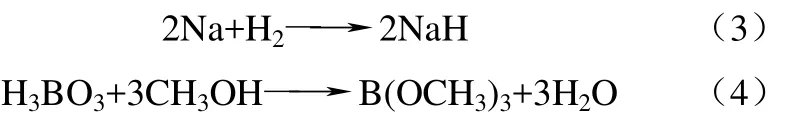
具体工艺流程图如图2所示[16]。
由于众多较为分散的原材料生产商及较低的反应收率造成原材料成本居高不下,这也正是施莱辛格路线制备硼氢化钠成本高,路线复杂的症结所在。Brown-Schlesinger法合成硼氢化钠路线中,氢化钠的合成和硼酸三甲酯的合成是关键步骤[17],以下从氢化钠的合成、硼酸三甲酯的合成和硼氢化钠的合成3个方面详细论述。
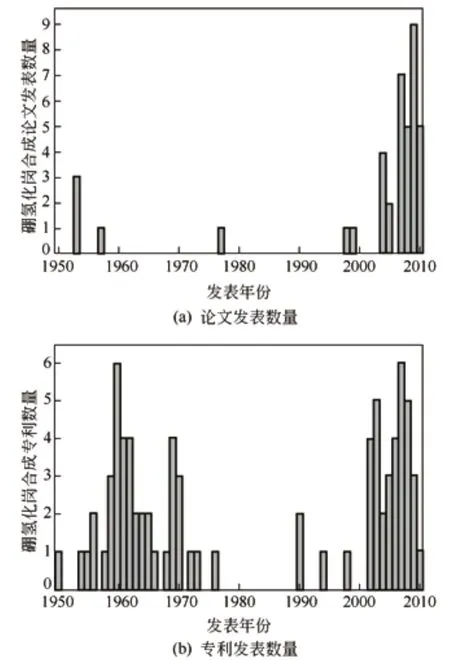
图1 硼氢化钠合成论文及专利发表数量图
1 氢化钠的合成
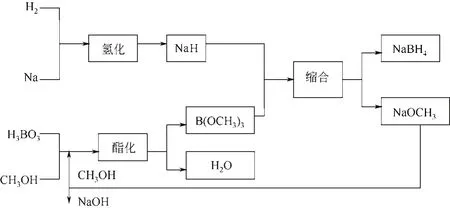
图2 硼氢化钠的Schlesinger法合成工艺流程图
氢化钠的工业合成是通过金属钠与氢气直接化合来完成的。首先将反应釜预热,然后将金属钠和表面活性剂加入,在高温高压作用下,合成氢化钠[18-20]。但由于金属表面生成一层质密的氢化物膜,阻碍氢气的扩散,造成反应变慢甚至终止,为此将熔融钠分散到液体石蜡中,高速搅拌,升温通氢,在常压氢气下,当温度升至200℃时,开始吸氢,氢化反应高峰在260~290℃,氢化完毕,可以得到氢化钠的浓度在25%~75%之间,纯度达98%以上[21-28]。李辉等[29]以石蜡油作分散剂,金属钠和氢气为原料,在反应温度300~320℃、反应时间1h、常压氢气的条件下,可得到钠转化率80%以上、比表面积测定值为5.8m2/g的高活性的氢化钠。王晓梅等[30]采用合成-降温-静置-压滤的工艺流程得到浓度在50%~65%、纯度≥95%的氢化钠产品,液体石蜡回收利用,极大地提高了氢化钠产品的市场竞争力。此法得到氢化钠便于储运,液体石蜡可以循环利用,产品收率高。利用此法合成的油液氢化钠可直接作为原料合成硼氢化钠。使用此类氢化钠有操作方便之长,但其活性较差,虽然可用有机溶剂洗去矿物油,这又给使用造成不便,加之氢化物的活性与其状态、纯度和分散度密切相关,市售氢化钠在许多反应中的活性不能满足市场需求,因而有关氢化钠的合成研究一直非常活跃[31]。
2 硼酸三甲酯的合成
硼酸三甲酯合成方式主要有3种[32]。①利用三氧化二硼和甲醇反应制备。此方法得到硼酸三甲酯的收率达99.4%,共沸液中硼酸三甲酯含量达71.4%,但此方法硼酸在300℃以上才可以脱水分解生成三氧化二硼,故能耗高,而且转化率只有50%,其余转化成硼酸。②利用甲醇和硼酸合成。此方法可以避免硼转化率低的问题,硫酸虽然能促进反应进行到底,但由于其与甲醇酯化,而影响甲醇的回收率,可以利用精馏设备不断将共沸物移除的方法,促进反应进行到底。③利用硫酸、甲醇和硼砂制备。Schlesinger等[33]利用此方法得到共沸液中硼酸三甲酯收率92%~93%,甲醇与硼砂最佳比例为8∶1,苏裕光[34]利用硼砂、硫酸和甲醇制备硼酸三甲酯,硼砂与硫酸按化学计量比,甲醇与硼砂克分子比最佳为(28~32)∶1之间,硼转化率最高为95.3%。此方法优点原料最廉价,但原料本身就存在大量的水,随着反应进行,整个反应体系的水不断增加,会影响反应速度和转化率,而蒸馏除去这些水分又消耗大量的能量。廖仕学等[35]以硼酸在70~110℃、加热脱水生成偏硼酸和焦硼酸固体然后搅拌下将固体加入到甲醇中升温回流反应,得到共沸物分离可得到硼酸三甲酯产品,单程转化率80%。目前工业化的方法是硼酸-甲醇法。
硼酸三甲酯合成的难点在于硼酸三甲酯易与甲醇形成共沸物,需要进一步分离提纯才能得到产品硼酸三甲酯[36]。硼酸三甲酯的提纯分离方法有4种。①利用浓硫酸脱醇。此方法浓硫酸的加入使得甲醇脱除率提高,但也使得被甲醇带走硼酸三甲酯的损失达15%。钱兵荣等[37]对此方法进行了改进,利用浓硫酸打破共沸物,粗馏得到含量94%硼酸三甲酯,由于恒沸物和甲醇的沸点相差10℃,将该混合物进行精馏,塔顶得到恒沸物,即可分离出甲醇,再收集溜出液,可以得到99%的硼酸三甲酯,单程收率73%。②加入萃取剂与甲醇形成共沸物,其沸点低于硼酸三甲酯的沸点,如二硫化碳,加入占甲醇质量的14%的二硫化碳,其共沸物沸点38℃,硼酸三甲酯提纯收率可达92%。③盐析的方法(最好的办法)[38-43]。Schlesinger利用无水氯化锂对共沸物进行分离,可以得到纯度99.6%、收率96%的硼酸三甲酯,无水氯化锂可以循环利用。苏裕光[34]比较了氯化锂、氯化锌、氯化钙和氯化钠4种盐的盐析效果,氯化钠没有效果,氯化锂大于氯化钙大于氯化锌,盐析得到硼酸三甲酯纯度99%以上。师新玉等[44]在前人工作基础上更为细致的考察了氯化钙、氯化锌和氯化锂3种盐的盐析效果,得出结论:每摩尔共沸物消耗13g氯化锂,可以得到纯度和产率均为99.5%以上的硼酸三甲酯;每摩尔共沸物消耗45g氯化锌,可以得到纯度99.5%、收率达87.5%的产品;每摩尔共沸物消耗14g氯化钙,可以得到纯度94%、收率达92.3%的产品。3种盐中以氯化锂最佳。④白力英[45]、刘方明[46]等采用萃取精馏法分离共沸物,将共沸物加入精馏釜中,再加入DMF,其加入量为共沸物质量的15%~25%。将塔釜加热至80~105℃,进行精馏,回流比控制在(8~12)∶1,塔顶温度为67~69℃,即可得到硼酸三甲酯产品,纯度≥98%。
目前工业化硼酸三甲酯生产工艺为硼酸-甲醇法,合成收率普遍在90%以上,而硼酸三甲酯的提纯大多采用萃取精馏法,萃取剂为DMF。萃取过程中因用到大量的有机溶剂,甲醇与DMF分离过程耗能较大, DMF循环利用率在85%左右,损失较大,对环境影响很大,这些因素直接造成硼酸三甲酯生产成本居高不下。目前亟需一种好的分离方法来代替萃取精馏法。盐析法以分离效率高、低耗能、无机盐能够循环利用、环保压力低等优势在近年来又引起了人们的重视。
3 硼氢化钠的合成
Schlesinger等[1,47]发现,在无溶剂存在时,氢化钠与气态硼酸三甲酯反应生成硼氢化钠和甲醇钠。氢化钠与硼酸三甲酯反应合成硼氢化钠,但此反应由于反应物混合不均匀首先生成酸碱加合物三甲氧基硼氢化钠(Na[HB(OCH3)3)]),然后歧化反应得到硼氢化钠,即使不断移除生成的硼酸三甲酯,此反应只有约80%三甲氧基硼氢化钠歧化反应生成硼氢化钠,而20%则分解生成甲醇钠和硼酸二甲酯,由此反应可以得到纯度为50%硼氢化钠。此法缺点如下:搅拌困难,不容易混合均匀,经常团聚;温度不容易控制,硼氢化钠容易分解,造成产率低;因氢化钠和生成的硼氢化钠均为固态,纯品,容易吸湿,操作条件苛刻。因此以上方法只适用于实验室少量制备及小规模生产,产率只有85%~94%。Govenale[48]、Brown[49]和Walter Fedor[50]等采用将氢化钠分散在溶剂中,在290~310℃、27PSI压力下滴加硼酸三甲酯,然后保温,经提纯可以得到产品收率97%,产品纯度98%。刘志贤等[51]采用将氢化钠分散在溶剂中,在240~260℃、常压氮气保护下下滴加硼酸三甲酯,然后保温,经提纯可以得到产品收率86%~92%,产品纯度98%以上。Çetin 等[52-53]以氢化钠和含有70%硼酸三甲酯、30%甲醇的混合物为原料,在氩气保护下于275℃、反应时间90min、硼酸三甲酯过量60%的条件下得到粗产品硼氢化钠,然后利用乙二胺萃取,干燥得到硼氢化钠产品。
4 结语与展望
Schlesinger法作为硼氢化钠工业化生产的主流工艺,国内生产规模均较小,生产工艺落后,生产原料像氢化钠、硼酸三甲酯均需要外购,这就加大了生产成本,目前可以从以下几个方面对Schlesinger法合成硼氢化钠进行改进。
(1)硼氢化钠生产厂家多采用外购氢化钠和硼酸三甲酯来合成硼氢化钠,原料采购、运输、仓储成本较高,因而使得硼氢化钠生产成本提高,硼氢化钠全流程生产可以大大降低生产成本,而且氢化钠和硼酸三甲酯均可以作为商品直接出售。2013年1月8日,江苏华昌化工股份有限公司1000吨/年固体硼氢化钠生产线技术改造项目生产线联动成功,生产出符合设计要求的固体硼氢化钠产品。
华昌化工采用全流程工艺生产硼氢化钠,在市场上占据先机,加大了产品的市场竞争力。这也是其他硼氢化钠生产厂家效仿的楷模。
(2)氢化钠合成因对设备、操作要求较苛刻,这也是大多数企业采取外购原料的主要原因。将来需要解决的重中之重就是研制出氢化装置,改进搅拌方式,加大钠的分散度,使钠与氢气充分接触,从而提高金属钠的转化率。
(3)硼酸三甲酯的合成难点是提纯工作,目前的提纯方法是萃取精馏和盐析法。盐析法因利用无机盐,为绿色无污染,而萃取精馏因用到DMF,增加环保压力,故盐析法前景较好。
(4)硼氢化钠合成工艺较为成熟,目前工业化方法是利用油液分散氢化钠和硼酸三甲酯常压下合成,加酯速度和搅拌速度对产率有很大影响,加酯过快或搅拌不均匀都将造成酯局部过量导致副反应发生。
因此选择合适的搅拌设备和控制好硼酸三甲酯的加料速度成为合成硼氢化钠的关键所在,此外硼氢化钠提纯过程采用先将粗品水解,然后利用异丙胺提纯,干燥得到硼氢化钠产品。在此过程中硼氢化钠水解温度应控制在30℃以下,最好采用一定浓度的氢氧化钠溶液代替淡水,从而提高硼氢化钠的收率。
[1] 刘志贤,石双群,宋新芳. 硼氢化钠的性质及合成[J]. 河北师范大学学报:自然科学版,1997,21(1):71-75.
[2] 车荣睿. 硼氢化钠及其在化学化工上的应用[J]. 广东化工,1983 (3):19.
[3] 天津市化工研究院. 无机盐工业手册[M]. 北京:化学工业出版社,1994:229.
[4] 戴利. 活化硼氢化钠再有机合成中的应用[J]. 山东化工,2012,41 (1):65-67.
[5] Schlesinger H I,Herbert C Brown,Finholt A E. The preparation of sodium borohydride by the high temperature reaction of sodium hydride with borate esters[J].J.Am.Chem.Soc.,1953,75(1):205-209.
[6] Santos D M F,Sequeira C A C. Sodium borohydride as a fuel for the future[J].Renewable and Sustainable Energy Reviews,2011,15(8):3980-4001.
[7] Wade R C. In Specialty Inorganic Chemicals[M]. London:Royal Society of Chemistry,1981:25-57.
[8] Buchner W,Niederprüm H. Sodium borohydride and amine-boranes,commercially important reducing agents[J].Pure Apply Chem.,1977,49:733-743.
[9] Santos D M F,Sequeira C A C. On the electro synthesis of sodium borohydride[J].International Journal of Hydrogen Energy,2010,35 (18):9851-9861.
[10] 周永全,房艳,房春晖. 硼氢化钠的电化学制备研究进展[J]. 盐湖研究,2012,20(4):57-62,72.
[11] Yoshitsugu Kojima,Tetsuya Haga. Recycling process of sodium metaborate to sodium borohydride[J].International Journal of Hydrogen Energy,2003,28(9):989-993.
[12] Li Z P,Liu B H. Preparation of potassium borohydride by a mechano-chemical reaction of scline hydrides with dehydrated borate through ball milling[J].Alloys and Compounds,2003,354:243-247.
[13] Li Z P,Morigazaki N. Preparation of sodium borohydride by the reaction of MgH2with dehydrated borax through ball milling at room temperature[J].Alloys and Compounds,2003,349(1-3):232-236.
[14] Murat Bilen,Metin Gürü,Çetin Çakanyıldırım. Role of NaCl in NaBH4production and its hydrolysis[J].Energy Conversion and Management,2013,72:134-140.
[15] Aysel Kantürk Figen,Sabriye Piskin. Microwave assisted green chemistry approach of sodium metaborate dehydrate (NaBO2·2H2O) synthesis and use as raw material for sodium borohydride (NaBH4)thermo chemical production[J].International Journal of Hydrogen Energy,2013,38(9):3702-3709. .
[16] 郑学家. 硼氢化合物[M]. 北京:化学工业出版社,2011:22-26.
[17] Wu Y,Michael T Kelly,Jeffrey V Ortega. Review of chemical processes for the synthesis of sodium borohydride[R]. Millennium Cell Inc.,2004-01-26.
[18] Jaroslav Vita,Vladimir Prochazka,Oldrich Strouf. Method of preparing sodium hydride:US,3595617[P]. 1971-07-27.
[19] Stanislav Landa,Bedrich Lebl. Process for the production of sodium hydride:US,3535078[P]. 1970-10-20.
[20] Sullivan E A,Wade R C,Kirk-Othmer. Encyclopedia of Chemical Technology[M]. 3rd Ed. New York:Wiley Interscience,1980:772.
[21] Banus Mario D,Bragdon Robert W,et al. Method for preparing borohydrides of alkali metals:US,2720444[P]. 1955-10-11.
[22] Fedor Walter S,Banus Douglas M,Ingalls David P. Potassium borohydride manufacture[J].Industrial andEngineering Chemistry,1957,49(10):1664-1672.
[23] Šubrt J,Kříž P,Skřivánek J,et al. Kinetic model for the hydrogenation of sodium to sodium hydride[J].J.Am.Chem.Soc.,1975,40(12):3766-3773.
[24] Banus M D,Hinckley A A. Handling and Uses of the Alkali Metals[M]. New York:American Chemical Society,1957:106-117.
[25] Herbert Jenkner,Hannover-Wulfel,Hannover,et al. Preparation of sodium hydride:US,3116112[P]. 1963-12-31.
[26] Hansley Virgil L,Cincinnati,Fred Keith Morgan,et al. Process for preparing sodium hydride:US,3222288[P]. 1965-12-07.
[27] Peter Rittmeyer,Chemetall GmbH,Frankfurt. Hydrides[M]. Ullmann's Encyclopedia of Industrial Chemistry,2000:5-6.
[28] Anders Andreasen. Predicting formation enthalpies of metal hydrides[R]. Roskilde,Denmark:Ris National Laboratory,2004:10-19.
[29] 李辉,迟玉兰. 活性催化剂NaH直接合成方法的研究[J]. 抚顺石油学院学报,1997,17(4):5-8.
[30] 王晓梅,邵全毅. 氢化钠工艺研究[J]. 天津化工,2011,25 (3):37-38.
[31] 侯殿保,李海民,党亚. 氢化钠的合成、性质及应用[J]. 盐湖研究,2013,21(4):49-52,59.
[32] 成本诚,吴海鹰. 有机硼酸酯的应用及制备[J]. 湖南化工,1996, 26(4):9-12.
[33] Schlesinger H I,Brown Herbert C,Mayfield Darwin L,et al. Procedures for the preparation of the Methyl Borate[J].J.Am.Chem.Soc.,1953,75(1):213-215.
[34] 苏裕光. 硼酸三甲酯的制备[J]. 化学世界,1964(3):125-126.
[35] 廖世学,李奇斌,李进伟. 一种硼酸三甲酯的制备方法:中国,102002064A[P]. 2011-04-06.
[36] Girgin I. Trimethyl Borate B(OCH3)3production methods[J].Madencilik,2003,42:37-42.
[37] 钱兵荣,李小保. 一种生产高纯度硼酸三甲酯的精馏方法:中国,101318969A[P]. 2008-12-10.
[38] Sabriye piskin,Muge Sari Yilmaz. Production of methyl borate for sodium borohydride (NaBH4) hydride storage medium[J].IPCBEE,2011 (10):59-63.
[39] Chiras S J,Falls N. Process of preparing trimethyl borate:US,2947776[P]. 1960-08-02
[40] James B. Process for manufacture of trimethyl borate:CA,640596[P]. 1961-01-05.
[41] Scheehte W H. Production of trimethyl borate:US,2689259[P]. 1954-09-14.
[42] Mason R G. Method for the preparation of trimethyl borate:UK,81862[P]. 1955-11-08.
[43] 邱学青,车富东,杨卓如,等. 盐析效应在酯提纯中的应用研究[J].广东化工,1994(1):23-26.
[44] 师新玉. 用盐析法分离硼酸甲酯共沸物的研究[J]. 山西化工,1995 (4):33-34.
[45] 白力英,金鑫,谢京林. 硼酸三甲酯制备中的分离新方法[J]. 上海化工,1998(13):37-38.
[46] 刘道明,周章凯,杨成. 硼酸三甲酯无“三废”合成工艺[J]. 化工与环保,2011(5):49-51.
[47] Schlesinger H I,Herbert C Brown. Methods of preparing alkali metal borohydrides:US,2534533[P]. 1950-12-19.
[48] Luck J Gobernale,Arthur F Limper,Jesse Roger Mangham,et al. Preparation of alkali metal borohydrides:US,3002806[P]. 1961-10-03.
[49] Brown Herbert C,Mead Edward J,Tierney Paul A. The reaction of sodium hydride with methyl borate in solvents:Convenient new procedures for the synthesis of sodium borohydride[J].J.Am.Chem.Soc.,1957,79 (20):5400-5404.
[50] Walter Fedor,Douglas Banus M,David Ingalls. Potassium borohydride manufacture[J].Industrial and Engineering Chemistry,1957,49(10):1664-1672.
[51] 刘志贤,宋新芳,石双群,等. 硼氢化钠的制备及萃取工艺研究[J].河北化工,1996(3):20-25.
[52] Çetin Çakanyıldırım,Metin Gürü. Hydrogen cycle with sodium borohydride[J].International Journal of Hydrogen Energy,2008,33:4634-4639
[53] Çetin Çakanyıldırım,Metin Gürü. Production of NaBH4and hydrogen release with catalyst[J].Renewable Energy,2009,34(11):2362-2365.
Analysis on technological conditions and optimization approach of Schlesinger process for sodium borohydride production
HOU Dianbao1,LI Haimin1,DANG Ya1,2
(1Qinghai Institute of Salt Lakes,Chinese Academy of Sciences,Xining 810008,Qinghai,China;2University of Chinese Academy of Sciences,Beijing 100039,China)
:Currently,Schlesinger process and Bayer process are both industrial synthesis process of sodium borohydride. The Brown-Schlesinger process is the major process in use today for making sodium borohydride. The key steps of the process are the production of sodium hydride and trimethyl borate. The synthesis process of sodium hydride,trimethyl borate and sodium borohydride are reviewed. The existing problems are commented,such as sodium hydride prepared in mineral oil is poor in activity,serious environmental pollution caused by excessive use of concentrated sulfuric acid in industrial production of trimethyl borate. Some directions for further study are given. Integration of the process steps from start to finish will impact the bottom line cost. Synthesis of trimethyl borate instead of using sulfuric acid and purification by the salting out method can both reduce environmental pollution. In the process of sodium borohydride hydrolysis use of liquid dilute alkali solution instead of fresh water can avoid sodium borohydride hydrolysis and improve product yield.
sodium borohydride; Schlesinger process; synthesis
O 613.81
A
1000-6613(2014)11-3021-05
10.3969/j.issn.1000-6613.2014.11.031
2014-02-26;修改稿日期:2014-03-07。
中国科学院知识创新工程项目(KZCX2-EW-307)。
及联系人:侯殿保(1981—)男,硕士,助理研究员。E-mail houdb@isl.ac.cn。

