水热法合成具有优异倍率性能的纳米LiFePO4
王福庆,陈剑,衣宝廉
(1.中国科学院大连化学物理研究所,辽宁大连 116023;2.中国科学院研究生院,北京 100039)
水热法合成具有优异倍率性能的纳米LiFePO4
王福庆1,2,陈剑1*,衣宝廉1
(1.中国科学院大连化学物理研究所,辽宁大连 116023;2.中国科学院研究生院,北京 100039)
利用水热法,通过优化反应物的浓度、反应的温度和时间,在碱性体系中成功合成了粒径约为100 nm、具有橄榄石结构、纯相、平板状LiFePO4纳米材料,并采用蔗糖热解处理制得LiFePO4/C复合材料。同时,还研究了材料粒径对其电化学性能的影响。结果表明,反应物LiOH·H2O的浓度为4.5 mol/L时,所合成的LiFePO4粒径为100 nm。随粒径的减小,LiFePO4/C复合材料的电化学性能显著提高。粒径约为100 nm的LiFePO4/C表现出优异的倍率性能;以0.2放电,材料的比容量为168.2 mAh/g;以10和20放电,比容量分别可达114.2和94.7 mAh/g。同时,材料还具有良好的充放电循环稳定性。
水热法;磷酸亚铁锂;纳米材料;正极材料;锂离子电池
LiFePO4具有安全性高、充放电循环稳定、无毒和低成本等优点,被认为是极具潜力的锂离子动力和储能电池正极材料之一;但是,较低的电子电导率和离子电导率限制了LiFe-PO4的实际应用。主要通过采用碳包覆[1]和离子掺杂[2]等方法提高LiFePO4的电子电导率;以及通过减小材料的粒径缩短锂离子在LiFePO4固相中的扩散路径,来提高材料的电化学性能,特别是倍率性能[3]。目前,合成纳米LiFePO4的方法主要有高温固相法[1]、溶胶凝胶法[2]、共沉淀法[3]、水热法[4-13]和喷雾干燥法[14]等。与其它合成方法相比,水热合成在密闭体系中完成,易于调节环境气氛;同时,反应过程中,水溶液粘度下降,扩散和传质加快,反应速率加快,可以有效降低反应温度、缩短反应时间。同时,水热法合成的产物物相均一、产率高、粉体颗粒粒径小且分布均匀。因此,水热法成为合成纳米材料的常用方法之一。
目前报道的采用水热法合成的LiFePO4的粒径往往大于200 nm,材料的倍率性能尚不理想;例如,以20放电,材料的比容量一般小于80 mAh/g[4-8]。形貌是影响LiFePO4倍率性能的另一重要因素。Dokko等人的研究表明,平板状的LiFe-PO4拥有更多有利于Li+在LiFePO4晶体中嵌入和脱出的ac晶面,因此,平板状的LiFePO4具有更好的倍率性能[7]。Dokko等人还发现,利用水热法合成LiFePO4,在酸性介质中易生成针状LiFePO4;而在弱碱性介质中,产物为平板状[7]。但是,利用水热法在碱性介质中合成具有较小粒径的平板状LiFePO4则存在一定困难。Ellis等人发现在碱性介质中利用水热法合成LiFePO4,提高反应物的浓度可以减小产物的粒径;如Li+的浓度由0.75 mol/L增加至2.25 mol/L,LiFePO4的粒径由1~5 μm减小至250 nm[8]。而进一步减小LiFePO4的粒径则比较困难。Dokko等人将反应物Li+的浓度提高至3.0 mol/L,由于碱性介质中反应中间产物Li3PO4的溶解度较低,导致最终产物中含有Li3PO4杂质,而未能得到纯相的LiFePO4[7]。提高反应温度,可以提高Li3PO4的溶解度,但同时导致产物LiFePO4的粒径增大[8]。延长反应时间可以提高LiFePO4的相纯度,但材料的粒径增大[8]。为实现在较低反应物浓度时利用水热合成制备具有较小粒径的平板状LiFePO4,模板剂是最常用的方法之一。Xia等利用抗坏血酸为模板剂,在LiOH的浓度为0.6 mol/L时,合成了厚度约为50 nm的平板状LiFePO4;以5充、放电,材料的放电比容量为111 mAh/g[9]。同样采用抗坏血酸为模板剂,Xiang等人在LiOH的浓度为0.9 mol/L时,合成了厚度为50~80 nm的平板状LiFePO4;以8充、放电,材料的放电比容量为104 mAh/g[10]。Yang等以PEG为模板剂,在LiOH的浓度为1.0 mol/L时合成了厚度为100 nm的平板状纳米LiFe-PO4,材料具有较好的倍率性能,以10充、放电,材料的放电比容量达到130 mAh/g[11]。
本文工作在碱性体系中,仅通过优化水热反应的温度和时间,在LiOH·H2O的浓度为0.3~4.5 mol/L,合成出粒径为8.00 μ m~100 nm的平板状的纯相LiFePO4,讨论了在碱性介质中获得较小粒径纳米LiFePO4的方法,并研究了材料的粒径对LiFePO4的电化学性能的影响。
1 实验
1.1 样品制备
LiFePO4的制备:首先,按摩尔比1∶1∶3称取(NH4)2Fe-(SO4)2·6 H2O(AR)、H3PO4(AR)和LiOH·H2O(AR);然后,将(NH4)2Fe(SO4)2·6 H2O和H3PO4溶于去离子水,得到混合溶液;再向混合溶液中滴加LiOH水溶液,制得反应物前驱体。用pH计测得此时反应体系的pH约为8.0。将反应前驱体转移至水热反应釜中,并向釜中通氩气20 min,排除釜内的空气。将水热反应釜密封后置于烘箱中,于190℃反应4 h。反应完成后,将反应釜从烘箱中取出,冷却至室温,取出反应产物,以去离子水洗涤3次。最后于真空60℃干燥12 h得到LiFePO4。依次改变反应物LiOH·H2O的浓度为0.3、1.5、3.0和4.5 mol/L,按相同的摩尔比(Fe∶P∶Li=1∶1∶3)加入(NH4)2Fe(SO4)2· 6 H2O和H3PO4,按照与上文相同的实验方法制备LiFePO4。
LiFePO4/C的制备:将一定量的蔗糖溶解于去离子水,然后将制得的LiFePO4分散于蔗糖溶液中,得到混合物。将该混合物于85℃蒸去溶剂水,然后置于管式炉中,氩气保护下,在700℃煅烧1 h,得到碳包覆的LiFePO4/C。将所制得的LiFe-PO4/C分别标记为LFP-01、LFP-02、LFP-03和LFP-04,分别对应合成LiFePO4时所用反应物LiOH·H2O的浓度0.3、1.5、3.0 和4.5 mol/L。
1.2 材料表征
利用X射线衍射仪(Rigaku D/max B)分析LiFePO4的物相。测试条件:Cu Kα辐射源(=0.154 06 nm),管压40 kV,管流20 mA,扫描范围为10°~70°,扫描速率为5(°)/min。利用扫描电镜(JEOL 6360LV,Japan)观察样品的形貌和粒径。
1.3 制备LiFePO4电极及组装Li/LiFePO4半电池
制备LiFePO4电极:将聚偏氟乙烯(PVDF)完全溶解于N-甲基吡咯烷酮(NMP)中,然后向其中加入LiFePO4/C和乙炔黑,研磨混合均匀,得到粘稠状浆料。将浆料用刮刀刮涂于厚度为20 μm的铝箔上,于75℃干燥45 min,然后裁成1.1 cm×1.1 cm的极片;将极片辗压后置于真空干燥箱中,在80℃干燥至恒重,称重后继续真空干燥1 h,取出后转移至手套箱中备用。
组装Li/LiFePO4扣式电池:以LiFePO4电极为正极,金属锂片为负极,Celgard 2400为隔膜,1 mol/L LiPF6/(EC+DMC)(体积比为1∶1)为电解液,在充满氩气的手套箱中组装成2016型扣式电池。
1.4 电化学表征
以LiFePO4电极为工作电极,金属锂作为对电极和参比电极,利用PARSTAT 2263电化学工作站(Princeton applied research Co.,Ltd,USA)测量LiFePO4电极的交流阻抗谱,频率范围为106~0.1 Hz,电势正弦波振幅为5 mV,测量温度为室温。
采用新威电池测试系统(深圳新威,中国)测量Li/LiFePO4半电池在室温下的充放电性能、倍率性能和循环稳定性等。充、放电的电压范围为2~4.2 V。测量材料的比容量和循环稳定性时,充、放电倍率均为0.2。测量材料的倍率性能,充、放电倍率依次设为0.2、1、5、10、30和40。
2 结果与讨论
2.1 材料的制备及物理表征
图1为采用不同反应物浓度制备的LiFePO4的XRD图谱。从图中可以看到,对照LiFePO4的标准卡(JCPDS 40-1499),所有样品的XRD谱均出现明显的特征峰,峰形尖锐,属于正交晶系,空间群,并且未观察到杂质峰,说明所制样品均为纯相LiFePO4,具有良好的结晶性。Saravanan等人的研究结果表明[12],平板状LiFePO4的XRD谱特征峰I (020)的强度大于特征峰I(200)。由图1可以看出,本文所合成的LiFePO4的特征峰I(020)的强度均大于I(200)的强度,所制备的LiFePO4均为平板状。
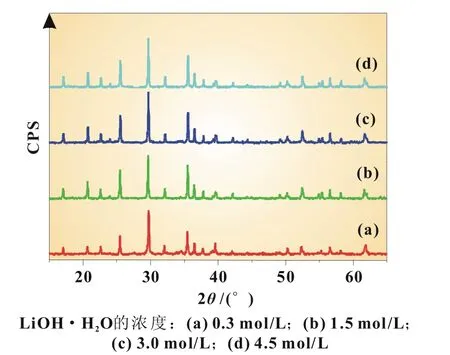
图1 所合成样品LiFePO4的XRD图谱
图2为所合成的LiFePO4的SEM图。从图中可看出,所制得的LiFePO4的形状也基本为平板状,这与XRD的实验结果一致。并且,随反应物浓度增加,产物LiFePO4的粒径明显减小。反应物LiOH·H2O的浓度为0.3和1.5 mol/L时,产物LiFePO4的粒径分别为8.00和1.80 μm;进一步增大LiOH· H2O的浓度至3.0 mol/L,LiFePO4的粒径减小至约500 nm,也可见一些粒径为200 nm的较小粒子;LiOH·H2O的浓度进一步增大至4.5 mol/L时,LiFePO4的粒径减小至约100 nm。
水热法制备LiFePO4符合“消溶-再沉淀”机理,即反应前驱体消溶后,经历成核和生长两个阶段后从液相中析出固体产物[13]。增大反应物的浓度,可提高反应物的过饱和度,增大产物的成核速率,有利于得到更小粒径的产物。本实验结果表明,当反应物LiOH·H2O的浓度从0.3 mol/L增大到4.5 mol/L时,产物LiFePO4的粒径从约8.00 μm减小至约100 nm。
与Dokko等[7]的工作比较,本文工作成功地采用更高的LiOH浓度(4.5 mol/L)合成了粒径更小(约100 nm)的纯相LiFePO4。这主要是由于,本文工作采用了更高的水热反应温度(190℃),并且较高的反应温度进一步增大了釜内的反应压力,这些均有助于提高反应中间产物Li3PO4的溶解度。同时,本文工作还采用更短的反应时间(4 h),消减由于提高反应温度而导致的LiFePO4粒子的长大。因而,在LiOH·H2O的浓度为4.5 mol/L时,合成了粒径约为100 nm的结晶性良好的纯相LiFePO4。

图2 所合成的LiFePO4的SEM图片
2.2 电化学表征
图3(a)为测得的具有不同粒径的LiFePO4/C的Nyquist图,图3(b)是图3(a)中的高频部分。从图中可以看到,图中电化学交流阻抗谱均包含出现在高频区的压缩半圆和出现在低频区的斜线。从图3(a)和(b)中可以看出,随着材料粒径的减小,高频区代表电荷传递电阻的半圆逐渐减小。LFP-01、LFP-02、LFP-03和LFP-04的电荷传递电阻分别为974、164、82和32Ω,表明随着LiFePO4的粒径的减小,LiFePO4的电极反应活性明显提高。
图4是LiFePO4/C材料的充放电性能。从图中可以看出,随LiFePO4粒径的减小,材料的充放电比容量增大。其中,粒径为100 nm的LFP-04材料的充、放电比容量均为168.2 mAh/g,几乎达到LiFePO4的理论比容量;充放电的库仑效率为100%。
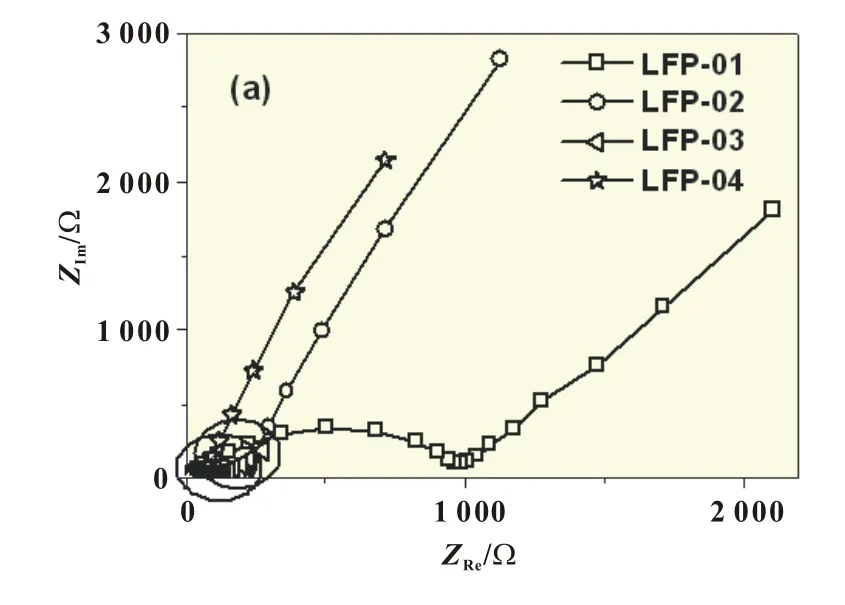
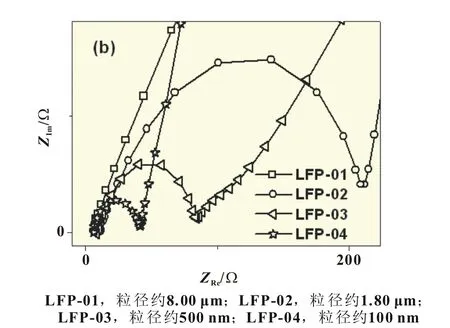
图3 具有不同粒径的LiFePO4/C的电化学交流阻抗谱(a)及其高频区的放大图(b)
将Li/LiFePO4半电池在2~4.2 V分别以0.2、1、5、10、30和40的倍率进行充放电,测量具有不同粒径的LiFe-PO4/C复合材料的倍率性能,数据在表1中给出。从表中可以看到,随LiFePO4/C粒径的减小,材料的倍率性能提高。在实验所采用的全部充放电倍率下,粒径约为100 nm的LFP-04均具有最高的放电比容量:分别为149.4(1)、132.1(5)、114.2(10)和81.5 mAh/g(30)。与文献报道的工作相比[4-8,10,12],本文工作所合成的100 nm的LiFePO4材料具有较优的倍率性能。
对所合成的LiFePO4/C进行充放电循环稳定性测试,结果在图5中给出。测量的电压范围为2~4.2 V,充放电倍率均为0.2。如图所示,LiFePO4/C材料表现出良好的循环稳定性,50个充放电循环后,几乎未见容量衰减。
3 结论
本文利用水热法在碱性介质中通过优化反应物的浓度、反应的温度和时间,成功制备了粒径约为100 nm的具有橄榄
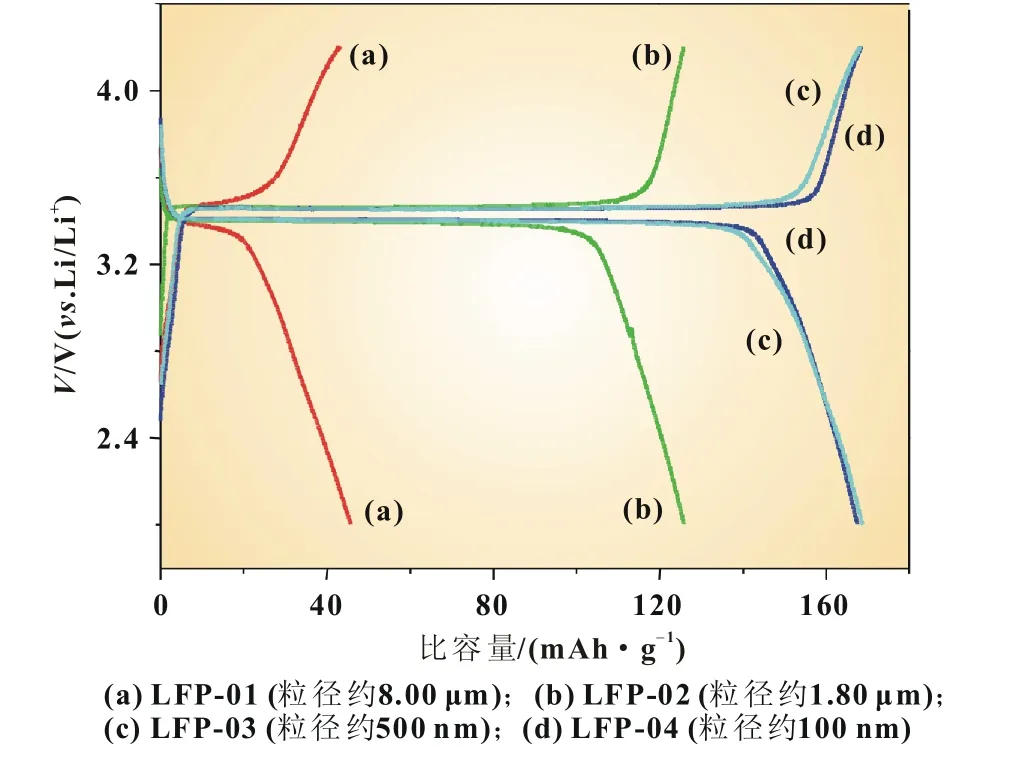
图4 LiFePO4/C材料的充放电曲线
石结构的纯相LiFePO4,并采用蔗糖热解处理制得LiFePO4/C复合材料。讨论了反应物浓度等工艺参数对所合成LiFePO4材料粒径的影响,以及粒径对材料电化学性能的影响。研究结果表明,当反应物LiOH·H2O的浓度为4.5 mol/L时,通过适当提高反应温度和缩短反应时间,获得了纯相的、粒径约100 nm 的LiFePO4。研究结果还表明,随材料粒径的减小,LiFePO4/C复合材料的电化学性能,特别是倍率性能明显得到提高。粒径约为100 nm的LiFePO4/C复合材料以0.2ffff85放电,材料的比容量为168.2 mAh/g;以10ffff84和20ffff83放电,比容量可达114.2 和94.7 mAh/g。并且,材料还具有良好的充放电循环稳定性。

表1 不同粒径LiFePO4/C的倍率性能

图5 所合成的LiFePO4/C(LFP-04,粒径约100 nm)的循环稳定性
[1]DOEFF M M,HU Y,MCLARNON F,et al.Effect of surface carbon structure on the electrochemical performance of LiFePO4[J].Electrochem Solid-State Lett,2003,6(10):A207-A209.
[2]WANG D,LI H,SHI S,et al.Improving the rate performance of LiFePO4by Fe-site doping[J].Electrochim Acta,2005,50(14): 2955-2958.
[3]DELACOURT C,POIZOT P,LEVASSEUR S,et al.Size effects on carbon-free LiFePO4powders:The key to superior energy density [J].Electrochem Solid-State Lett,2006,9(7):A352-A355.
[4]赵浩川,宋杨,郭孝东,等.半水溶剂热法合成LiFePO4及其性能研究[J].电源技术,2011,35(10):1201-1204.
[5]LU Z,CHEN H,ROBERT R,et al.Citric acid and ammonium-mediated morphological transformations of olivine LiFePO4particles[J]. Chem Mater,2011,23(11):2848-2859.
[6]KUWAHARA A,SUZUKI S,MIYAYAMA M.Hydrothermal synthesis of LiFePO4with small particle size and its electrochemical properties[J].J Electroceram,2010:24(1):64-75.
[7]DOKKO K,KOIZUMI S,NAKANO H,et al.Particle morphology, crystal orientation,and electrochemical reactivity of LiFePO4synthesized by the hydrothermal method at 443 K[J].J Mater Chem, 2007,17(45):4803-4810.
[8]ELLIS B,KAN W H,MAKAHNOUK W R M,et al.Synthesis of nanocrystals and morphology control of hydrothermally prepared LiFePO4[J].J Mater Chem,2007,17(30):3248-3254.
[9]XIA Y,ZHANG W,HUANG H,et al.Self-assembled mesoporous LiFePO4with hierarchical spindle-like architectures for high-performance lithium-ion batteries[J].J Power Sources,2011,196(13): 5651-5658.
[10]XIANG H,ZHANG D,JIN Y,et al.Hydrothermal synthesis of ultra-thin LiFePO4platelets for Li-ion batteries[J].J Mater Sci, 2011,46(9):4906-4912.
[11]YANG S,ZHOU X,ZHANG J,et al.Morphology-controlled solvothermal synthesis of LiFePO4as a cathode material for lithium-ion batteries[J].J Mater Chem,2010,20(30):8086-8091.
[12]SARAVANAN K,BALAYA P,REDDY M V,et al.Morphology controlled synthesis of LiFePO4/C nanoplates for Li-ion batteries [J].Energy Environ Sci,2010,3(4):457-464.
[13]QIN X,WANG X,XIANG H,et al.Mechanism for hydrothermal synthesis of LiFePO4platelets as cathode material for lithium-ion batteries[J].J Phys Chem C,2010,114(39):16806-16812.
[14]LIU J,CONRY T E,SONG X,et al.Nanoporous spherical LiFePO4for high performance cathodes[J].Energy Environ Sci,2011,4(3): 885-888.
Hydrothermal synthesis of LiFePO4nanoparticles with high rate capability
WANG Fu-qing1,2,CHEN Jian1*,YI Bao-lian1
Synthesis of nano-sized LiFePO4in an alkaline system with high lithium ion concentration was achieved by optimizing the hydrothermal temperature and time.The plate-like pure phase LiFePO4crystal with orthorhombic olive structure in size of 100 nm was obtained successfully with lithium-ion concentration of 4.5 mol/L.The LiFePO4/C composite was prepared by sintering the prepared LiFePO4with sucrose.The electrochemical performance of LiFePO4/C was enhanced obviously as decreasing the particle size of LiFePO4/C.Good rate capability of the LiFePO4/C with particle size of 100 nm was presented.The specific capacity of the material was 168.2 mAh/g at 0.2;the specific capacity of the material was 114.2 mAh/g at 10and 94.7 mAh/g at 20.The charge-discharge cycling performance of the LiFePO4/C was also obtained.
hydrothermal synthesis;lithium iron phosphate;nanoparticles;cathode material;rechargeable lithium battery
TM 912
A
1002-087 X(2014)02-0214-03

2013-06-29
辽宁省工业攻关计划(2010220034);大连市科技基金(2010A17GX096)
王福庆(1985—),男,山东省人,博士生,主要研究方向为锂离子电池。
陈剑

