利多卡因对背根节神经元诱发簇放电的影响及机制
孙 涛宋 英雷 振
实验研究
利多卡因对背根节神经元诱发簇放电的影响及机制
孙 涛1,2宋 英3雷 振4△
目的 探讨低浓度利多卡因对慢性背根节压迫(CCD)模型大鼠背根节(DRG)神经元诱发簇放电(EB)的影响及电流机制。方法24只SD大鼠分为正常对照组和CCD组,每组12只。CCD组用小钢柱在左侧腰4、5背根节行慢性压迫,正常对照组未做任何处理。应用在体细胞内技术记录2组大鼠EB放电的发生率及利多卡因对阈下膜电位振荡的影响,用离体全细胞膜片钳技术记录不同浓度利多卡因对持续性钠电流(INaP)的影响。结果CCD 组EB发生率增高,达45.97%(57/124),和正常对照组相比差异有统计学意义(χ2=26.810,P<0.01);DRG局部给予低浓度(50 μmol/L)利多卡因抑制INaP,致阈下膜电位振荡幅度抑制,进而影响EB发生。结论低浓度利多卡因通过阻断INaP抑制EB放电而发挥外周镇痛作用。
神经元;利多卡因;背根节神经元;诱发簇放电;钠电流
触诱发痛是神经病理性疼痛的常见症状,目前临床上缺乏有效治疗方法[1]。研究显示外周神经损伤后,损伤区域及相应的背根节(DRG)Aβ神经元胞体兴奋性增高及产生的异位自发放电活动,可能是触诱发痛的直接原因[2],但其参与触诱发痛发生的确切机制还不清楚。本课题组已经在慢性背根节压迫(CCD)模型大鼠DRG的Aβ神经元记录到一种放电模式,命名为诱发簇放电(evoked-bursting,EB)[3],推测其可能是触诱发痛的电信号。利多卡因静脉或口服给药可用于治疗神经病理痛,但会有恶心、呕吐、眩晕等不良反应。本研究主要应用电生理学方法,观察低浓度利多卡因对DRG神经元EB放电的影响,探讨其能否作为抑制触诱发痛的外周镇痛药物。
1 材料与方法
1.1 主要溶液与试剂 人工脑脊液(artificial cerebrospinal fluid,ACSF,mmol/L):NaCl 125、KCl 3.8、NaH2PO31.2、NaHCO326、葡萄糖10、MgCl21.0、CaCl22.0,pH 7.4;电极内液(mmol/L):葡糖酸钾115、KCl 25、NaCl 9、羟乙基哌嗪乙硫磺酸(HEPES)10、乙二醇二乙醚二胺四乙酸(EGTA)0.2、MgCl21、K2-ATP 3,pH 7.4;测持续性钠电流(persistent sodium cur-rent,INaP)电极内液(mmol/L):氟化铯130、NaCl 9、HEPES 10、EGTA 10、MgCl21、K2-ATP 3,pH 7.4;测INaP灌流液(mmol/L):NaCl 131、HEPES10、KCl 3、葡萄糖10、CaCl21、MgCl22、氯化四乙胺(TEA-Cl)10、氯化铯10、4-氨基吡啶3、氯化镉0.3,pH 7.4;消化液含人工脑脊液100 mL,蛋白酶40 mg,胶原酶100 mg;蛋白酶、胶原酶、HEPES、EGTA、K2-ATP、利多卡因均为美国Sigma公司产品,其余试剂均为国产分析纯。
1.2 实验对象及模型建立分组 健康Sprague-Dawley(SD)大鼠由徐州医学院实验动物中心提供,雌雄不限,体质量180~250 g。将24只SD大鼠分为2组:正常对照组12只,CCD模型组12只。CCD组腹腔注射1%戊巴比妥钠40 mg/ kg麻醉,手术暴露左侧L4和L5椎间孔,将直径0.4 mm,长4 mm“L”型不锈钢柱插入孔内,对相应DRG形成稳定压迫。术毕切口处用青霉素抗感染,逐层缝合肌肉和皮肤。正常对照组未做任何处理。
1.3 机械痛敏行为学测试 2组大鼠均进行行为学测试,测试前大鼠在测试笼内适应30 min,室温控制在(20±2)℃,再按刺激强度递增顺序依次施加Von Frey纤维细丝(1~26 g)至大鼠足底中心,以细丝稍微弯曲作为完全受力标准,连续测量5次,间隔15 s,5次检查过程中抬腿次数≥3次的值为机械缩足反射阈值(paw withdraw threshold,PWT)。
1.4 在体细胞内记录 2组大鼠术后2~8 d在17.0%乌拉坦及1.0%α-氯醛糖复合麻醉药腹腔注射麻醉下(5.0 mL/kg),常规手术暴露L4和L5 DRG,用脊柱固定器将大鼠固定,提起切口周围皮肤及筋膜做一灌流槽,充灌ACSF,撕除DRG表面被膜,在显微镜下,将尖端电阻40~60 MΩ,内充3 mol/L乙酸钾的玻璃微电极刺入胞内,记录信号经AxoClamp-700A放大器采集输入计算机存储。观察利多卡因对EB作用时选取1 200 ms时间段的阈下膜电位振荡(SMPO)进行傅里叶变换分析(FFT),观察药物的作用。
1.5 离体膜片钳记录 2组大鼠术后2~8 d经戊巴比妥钠腹腔麻醉(40 mg/kg),暴露L4和L5 DRG,取出带外周神经DRG至于ACSF,剥除表面被膜,在消化液中消化45 min,取出孵育1 h后移至记录槽,压片固定,吸引电极固定游离的神经末端。在显微镜下用电阻为4~8 MΩ,充灌电极内液玻璃微电极进行巨阻封接,破膜后形成全细胞记录模式。在检测INaP时需采用二次钳制方法:首先形成全细胞记录,检测细胞放电模式,更换电极,充灌测INaP电极内液,再次钳制,同时细胞外液置换测钠外液,在电压钳测量INaP。
1.6 统计学方法 采用SPSS 16.0软件进行统计处理,计量数据以±s表示。2组间比较采用独立样本t检验,率的比较用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 行为学结果 CCD组术后24 h术侧后肢出现触诱发痛现象,PWT术后开始下降,此敏化状态持续至术后10 d,而正常对照组大鼠同侧后肢PWT在持续的检测过程中没有明显改变,2组术后各时点组间比较差异有显著统计学意义(P<0.01),见表1。
Tab.1 Paw withdraw threshold test in normal control and CCD groups of rats表1 正常对照组和CCD组大鼠机械缩足阈值测试(n=12,g,±s)

Tab.1 Paw withdraw threshold test in normal control and CCD groups of rats表1 正常对照组和CCD组大鼠机械缩足阈值测试(n=12,g,±s)
**P<0.01
组别正常对照组CCD组t术前1 d 14.17±1.94 13.75±2.26 0.484术后1 d 14.58±1.44 3.10±2.03 15.962**术后2 d 15.00±0.00 2.55±1.35 31.724**组别正常对照组CCD组t术后4 d 14.58±0.41 2.71±1.80 23.587**术后6 d 12.50±2.61 2.96±1.75 10.503**术后10 d 13.75±2.26 4.25±2.17 10.478**
2.2 EB放电发生率 正常对照组外周感受野给予轻触刺激,在DRG Aβ神经元记录到离散、动作电位间期不规则的多个放电,刺激停止后,放电中止;坐骨神经电刺激在DRG只记录到1个动作电位,见图1。CCD组,外周感受野触刺激诱发部分Aβ神经元胞体产生高频簇放电(>70 Hz),放电持续时程超出刺激时间;给予坐骨神经电刺激(0.1 mA,0.05 ms)也可诱发胞体产生长时程的高频簇放电(>70 Hz),见图1,即EB。正常对照组EB的出现率仅为14.55%(16/110);CCD组术后Aβ神经元EB出现率达45.97%(57/124),和正常对照组相比差异有统计学意义(χ2=26.810,P<0.01)。
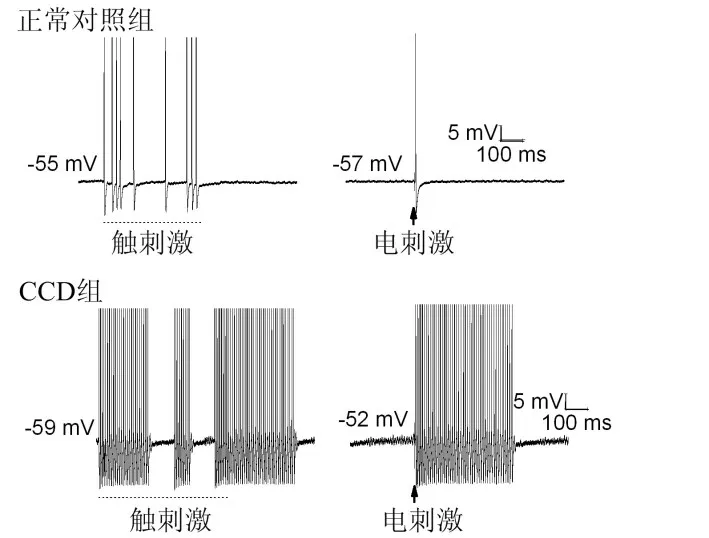
Fig.1 The reactive mode of DRG neurons to stimuli applied on peripheral receptive field in normal and CCD groups图1 正常对照组和CCD组DRG神经元对外周感受野刺激的反应模式
2.3 利多卡因对EB影响及电流机制 在记录液槽中加入利多卡因1滴(10 μL),液槽内终浓度为50 μmol/L,3 min后可见EB串长减小,5 min后EB完全消除,但坐骨神经刺激诱发的首个动作电位不受影响,洗脱后10 min EB部分恢复(n=5),对膜电位没有显著影响,见图2A。图2B显示加药后3、4、5 min局部膜电位的放大图,图中可见SMPO,FFT分析显示此浓度利多卡因主要影响振荡幅值,而对振荡频率没有显著影响,见图2C。
更换外液及电极内液后对EB神经元二次钳制,测量INaP,在-60 mV膜电位水平,给予胞体从-80~0 mV,时程为3 s的去极化斜波刺激,细胞在去极化刺激过程中出现较长时程内向持续电流,在-55 mV左右被激活,-35 mV左右达峰值,即INap。利多卡因在1 μmol/L时可以将INaP的峰值抑制(29.00±7.70)% (n=6),且有浓度依赖性,在应用10及50 μmol/L利多卡因对INaP的抑制程度分别为(65.71±6.76)%(n= 5)和(90.30±4.96)%(n=4),见图3。

Fig.2 The effects of lidocaine on EB firing and SMPO图2 利多卡因对EB放电及SMPO的作用
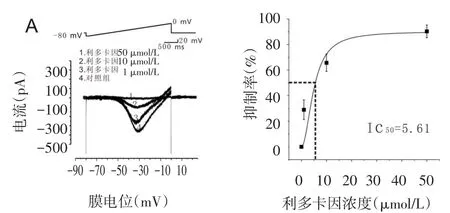
Fig.3 The effects of lidociane on INaPof EB neurons图3 利多卡因对EB神经元INaP的影响
3 讨论
3.1 利多卡因的临床应用 利多卡因是临床常用的局部麻醉药,静脉全身给药可以用于治疗慢性痛综合征[4],但因心脏和中枢神经系统的不良反应未能广泛应用。近年来临床运用利多卡因治疗神经病理痛获得了很大的关注,但是其作用机制尚不清楚。
3.2 背根节EB放电参与触诱发痛的发生 触诱发痛是神经病理性疼痛的常见症状,产生机制不清,目前临床上缺乏有效治疗方法,是疼痛研究领域关注的一个难点[1]。本研究在前期CCD大鼠DRG神经元记录到一种由外周刺激诱发胞体产生的长时程簇放电,即EB,该放电模式有效地放大了外周传入的电信号,能有效增强脊髓背角突触传递效率,契合了临床轻触刺激诱发剧烈、电击样触诱发痛的感觉特征,推测可能是触诱发痛的外周痛信号[3]。而且DRG处于血脑屏障之外,如果能在DRG局部使用利多卡因干扰EB放电,不但能抑制慢性痛信号发生,而且能避免全身给药带来的中枢神经系统的不良反应。
3.3 EB与SMPO的关系 SMPO是受损DRG神经元出现的膜电位周期性波动,是DRG神经元异位自发放电产生的必要条件[5-6]。本研究结果显示EB的发生与SMPO密切相关,50 μmol/L利多卡因可以通过抑制SMPO而抑制EB放电的发生,但外周刺激诱发的首个动作电位的传导没有影响,即不影响正常外周动作电位的传导,该结果与文献报道[2]一致。
3.4 利多卡因外周镇痛的可能机制 神经病理性痛情况下DRG神经元产生SMPO的机制与电压依赖性钠电流和钾电流之间的平衡有关[7]。电压依赖性的INap可以影响神经元的静息膜电位水平,使之向去极化方向漂移,参与SMPO的产生,从而增大神经元对阈下刺激反应的敏感性。本研究结果显示,利多卡因明显降低EB神经元的INap,推测DRG局部给予低浓度利多卡因可通过阻断INap抑制SMPO的幅度,进而抑制EB放电模式,从而发挥外周镇痛作用。
[1]Louter M,Wardenaar K,Veen G,et al.Allodynia is associated with a higher prevalence of depression in migraine patients[J].Cephalalgia,2014,34(7):568-577.
[2]Xie RG,Zheng DW,Xing JL,et al.Blockade of persistent sodium currents contributes to the riluzole-induced Inhibition of spontaneous activity and oscillations in injured DRG neurons[J].PLoS One,2011,6(4):e18681.doi:10.1371/journal.pone.0018681.
[3]Song Y,Li HM,Xie RG,et al.Evoked bursting in injured Abeta dorsal root ganglion neurons:a mechanism underlying tactile allodynia[J]. Pain,2012,153(3):657-665.doi:10.1016/j.pain.2011.11.030.
[4]Dong H,Fan YH,Wang YY,et al.Lidocaine suppresses subthreshold oscillations by inhibiting persistent Na(+)current in injured dorsal root ganglion neurons[J].Physiol Res,2008,57(4):639-645.
[5]Devor M.Ectopic discharge in Abeta afferents as a source of neuropathic pain[J].Exp Brain Res,2009,196(1):115-128.doi: 10.1007/s00221-009-1724-6.
[6]Devor M,Amir R,Rappaport ZH.Pathophysiology of trigeminal neuralgia:the ignition hypothesis[J].Clin J Pain,2002,18(1):4-13.
[7]Hsiao CF,Kaur G,Vong A,et al.Participation of Kv1 channels in control of membrane excitability and burst generation in mesencephalic V neurons[J].J Neurophysiol,2009,101(3):1407-1418. doi:10.1152/jn.91053.
(2014-04-23收稿 2014-06-24修回)
(本文编辑 李鹏)
The Effects and Mechanism of Lidocaine on Evoked-Bursting Firing of Injured Dorsal Root Ganglion Neurons
SUN Tao1,2,SONG Ying3,LEI Zhen4△
1Liaoning Medical College,Liaoning 121000,China;2The Xingcheng Sanatorium of Shenyang Military Region;3Department of Anesthetic Physiology,Xuzhou Medical College;4First Affiliated Hospital of Liaoning Medical College
△
E-mail:leizhen2004@163.com
ObjectiveTo study the effects and current mechanism of low concentration of lidocaine on evokedbursting(EB)firing of dorsal root ganglion(DRG)neurons in rat model of chronic compression(CCD)of DRG.MethodsTwenty-four SD rats were divided into normal control group(n=12)and CCD model group(n=12).CCD group was treated with chronic oppression on L4 and L5 DRG with L shape bar.Normal control group
no treatment.In vivo intracellular recording was used to record the incidence of EB and the effect of lidocaine on subthreshold membrane potential oscillation(SMPO).Patch clamp recording was used to record the effect of lidocaine on persistent sodium current(INaP).ResultsThe incidence of EB increased in CCD group(45.97%,57/124),which was significantly different when compared with normal group(χ2=26.810,P<0.01).The magnitude of SMPO,INaPand EB were inhibited in a reversible way by lidocaine(50 μmol/L).ConclusionThe low concentration of lidocaine might play an analgesic effect in peripheral nervous system by selectively inhibiting INap,which participates in SMPO formation.
neurons;lidocaine;dorsal root ganglion neuron;evoked-bursting;sodium current
R338.2
A
10.3969/j.issn.0253-9896.2014.11.005
国家自然科学青年科学基金项目(31200836)
1辽宁医学院(邮编121000);2沈阳军区兴城疗养院;3徐州医学院麻醉学院;4辽宁医学院附属第一医院
△通讯作者 E-mail:leizhen2004@163.com

