SDF-1对糖尿病外周血EPCs功能的影响及其与PI3K/ AKT信号通路的关系
黎金凤 林安华 邓 颖 霍亚南 刘精东 吴明斌 王晨秀
SDF-1对糖尿病外周血EPCs功能的影响及其与PI3K/ AKT信号通路的关系
黎金凤 林安华 邓 颖 霍亚南△刘精东 吴明斌 王晨秀
目的 观察基质细胞衍生因子-1(SDF-1)对糖尿病外周血内皮祖细胞(EPCs)功能的影响,探讨SDF-1对EPCs的影响是否与PI3K/AKT信号通路有关。方法采集糖尿病患者(DM组)和健康对照者(HC组)外周血30 mL,提取并培养EPCs。(1)SDF-1干预组加入100 μg/L SDF-1培养液,非干预组加入EGM-2MV培养基,采用Boyden小室和体外血管生成试剂盒观察EPCs的迁移和体外血管生成能力。(2)将培养的EPCs分为空白对照组、1 μg/L SDF-1组、10 μg/L SDF-1组、100 μg/L SDF-1组、单纯AMD3100组及100 μg/L SDF-1+AMD3100组,通过Western blot法检测各组EPCs中AKT蛋白的表达水平。结果(1)无SDF-1干预时,DM组EPCs迁移和血管形成能力低于HC组,SDF-1干预后,2组的EPCs迁移和血管形成能力均较干预前增强,但DM组增强的幅度高于HC组。(2)同一浓度下,DM组的AKT蛋白表达水平均低于HC组(均P<0.01)。无论是DM组还是HC组,AKT蛋白的表达均随着加入SDF-1浓度的增加而呈递增趋势(P<0.05);100 μg/L SDF-1+AMD3100组AKT蛋白的表达水平较100 μg/L SDF-1组明显降低(P<0.05)。结论SDF-1可增强外周血EPCs迁移和血管形成能力,对糖尿病患者效果更为明显,且SDF-1对EPCs的影响与PI3K/AKT信号通路有关。
基质细胞衍生因子-1;内皮祖细胞;PI3K/AKT;糖尿病
外周血内皮祖细胞(endothelial progenitor cells, EPCs)在糖尿病血管并发症的发生中起重要作用,它不仅参与血管新生过程,也参与血管内皮细胞的损伤后修复[1-2]。利用EPCs的血管新生能力治疗糖尿病缺血性疾病已成为研究热点。研究发现,基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)呈剂量依赖性地促进EPCs增殖,并显著增强EPCs的克隆能力[3],然而其具体机制不明,有研究显示,SDF-1干预健康成人外周血EPCs,能够呈时间-浓度依赖性地促使丝/苏氨酸蛋白激酶(AKT,又称蛋白激酶B)、内皮型一氧化氮合酶(eNOS)和细胞外调节蛋白激酶1/2(ERK1/2)蛋白的磷酸化[4]。本研究旨在观察SDF-1对糖尿病患者外周血EPCs迁移能力、血管形成能力的影响,并探讨其可能的作用机制,以期为EPCs应用于临床治疗糖尿病血管并发症提供依据。
1 材料与方法
1.1 材料与试剂 人SDF-1购自PeproTech公司;EGM-2MV培养基购自lonza公司;DiI标记的乙酰化低密度脂蛋白(DiI-acLDL)购自Molecular Probe公司;FITC标记荆豆凝集素(FITC-UEA-1)购自美国Sigma公司;Boyden小室购自江苏海门麒麟公司;体外血管生成试剂盒ECM625购自Chemicon公司;AKT兔抗人抗体、β-actin鼠单克隆抗体购自Anbo公司;蛋白Marker、辣根过氧化酶(HRP)标记的羊抗兔IgG购自北京全式金生物技术有限公司;HRP标记的羊抗鼠IgG购自Earthox公司;AMD3100(CXCR4趋化因子受体拮抗剂)购自Sigma公司;SDS-PAGE凝胶配制试剂盒购自碧云天生物技术研究所;uper Signal West Pico试验试剂盒购自Thermo公司。
1.2 研究对象 选取在我科住院的糖尿病患者15例(DM组)及在体检中心健康体检者15例(HC组),于2组中各选取10例用于EPCs迁移和血管形成能力的检测,余下各5例用于检测EPCs中AKT蛋白的表达水平。所有入选对象年龄40~50岁,均排除合并高血压、血液系统疾病、近期手术、感染、外伤等情况以及服用雌激素、他汀类药物、噻唑烷二酮类、中药等可能影响EPCs的药物。糖尿病患者符合1999年WHO糖尿病诊断标准,且排除有糖尿病并发症的患者。研究获江西省人民医院伦理委员会批准,所有研究对象均签署知情同意书。
1.3 方法
1.3.1 EPCs的培养 取受试者空腹外周静脉血30 mL,用密度梯度离心法获取单个核细胞,将其接种在包被有人纤维连接蛋白(HFN)的6孔培养板中,在EGM-2MV培养基(含5%胎牛血清)中培养4 d后换液,3孔中加入100 μg/L SDF-1培养基(SDF-1干预组),另外3孔加入EGM-2MV培养基(非干预组)。
1.3.2 EPCs的鉴定 将细胞与DiI-ac LDL(2.4 mg/L)37℃孵育1 h,以PBS洗3次后,用2%多聚甲醛固定细胞10 min。固定后,用PBS浸洗,加入FITC-UEA-1(10 mg/L),37℃继续孵育1 h,激光共聚焦显微镜鉴定LDL和UEA双染色阳性的细胞为正在分化的EPCs。
1.3.3 EPCs的迁移能力检测 采用Boyden小室检测EPCs趋化迁移能力,收集贴壁细胞并计数,对于非干预组,Boyden小室的下室仅加入20 μL(50 μg/L)血管内皮生长因子(VEGF),对于SDF-1干预组,在非干预组的基础上加入100 μL(100 μg/L)的SDF-1。将2×105/mL EPC悬浮在100 mL培养液注入上室,37℃5%CO2孵箱孵育过夜,取出微孔滤膜,经过漂洗、固定、染色、二甲苯透明,任意选取3个视野于100倍显微镜下计数迁移到下室的细胞。
1.3.4 EPCs的体外血管生成能力检测 采用体外血管形成试剂盒检测EPCs的血管生成能力,将900 μL ECMatrixTM胶液与100 μL ECM 10×稀释液混匀,加入96孔培养板(50 μL/孔),37℃孵育1 h成胶,每孔加入150 μL含细胞的培养液接种于聚合的ECMatrixTM胶的表面,37℃孵育24 h,在40倍倒置显微镜下观察小血管的形成。
1.3.5 Western Blot检测AKT蛋白 EPCs的分离、培养如前,细胞培养至第4天换液,6孔依次为空白对照组、1 μg/L SDF-1组、10 μg/L SDF-1组、100 μg/L SDF-1组、单纯AMD3100组及100 μg/L SDF-1+AMD3100组。培养至第7天,收集各组贴壁的EPCs,提取蛋白质后进行SDS-PAGE电泳、转膜、封闭,p-AKT(Ser473)一抗4℃孵育过夜,二抗孵育1 h,进行后续发光、压片、显影、定影等。β-actin为内参。X线片扫描成像后,经ImageJ 1.410图像分析软件对图中印迹区带进行灰度分析。
2 结果
2.1 EPCs形态学观察 从外周血刚分离获得的EPCs大部分呈小圆形,培养24 h后,细胞数目开始增加,形态亦开始增大,第3天可见细胞集落形成(集落呈发芽式向外生长,中央为圆形细胞,周围为梭形细胞),见图1。第4天有较广泛的细胞变形(以梭形细胞为主),以后梭形细胞逐渐增多;第7天可见典型的长梭形细胞,见图2。细胞培养2周后,梭形细胞开始消失,取而代之的出现的是椭圆形细胞,呈铺路石样形态,见图3。
2.2 EPCs的鉴定 EPCs培养4 d后通过激光共聚焦显微镜鉴定,细胞摄取DiI-ac LDL(红色,激发波长543 nm)和结合FITC-UEA-1(绿色,激发波长477 nm),DiI-ac LDL和FITC-UEA-1双染色阳性细胞(呈黄色)被认为是正在分化的EPCs,见图4。
2.3 SDF-1对EPCs迁移能力的影响 无SDF-1干预时,DM组EPCs迁移能力低于HC组(P<0.05);SDF-1干预后,2组的EPCs迁移能力均较干预前增强,但DM组增强的幅度高于HC组(P<0.05),见表1。
Tab.1 Comparison of effects of SDF-1 on the migration ability of EPCs表1 SDF-1对EPCs迁移能力影响的比较 (个,±s)
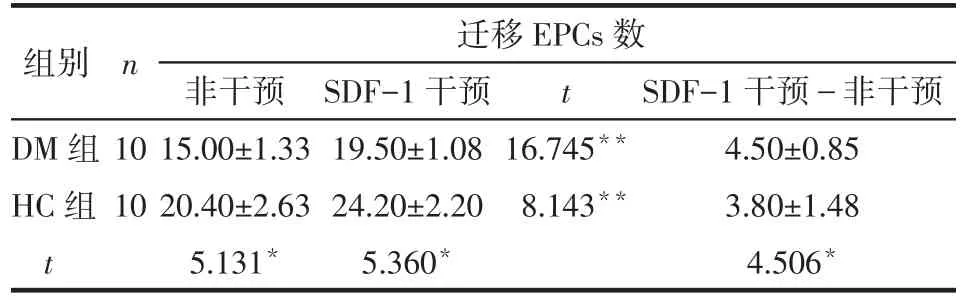
Tab.1 Comparison of effects of SDF-1 on the migration ability of EPCs表1 SDF-1对EPCs迁移能力影响的比较 (个,±s)
*P<0.05,**P<0.01
组别DM组HC组t n 迁移EPCs数t 10 10非干预15.00±1.33 20.40±2.63 5.131*SDF-1干预19.50±1.08 24.20±2.20 5.360*16.745**8.143**SDF-1干预-非干预4.50±0.85 3.80±1.48 4.506*
2.4 SDF-1对EPCs血管形成能力的影响 无SDF-1干预时,DM组EPCs血管形成能力低于HC组(P<0.01);SDF-1干预后,2组的EPCs血管形成能力均较干预前增强,但DM组增强的幅度高于HC组(P<0.05),见表2。
Tab.2 Effects of SDF-1 on angiogenesis ability of EPCs表2 SDF-1对EPCs血管形成能力的影响(μm,±s)

Tab.2 Effects of SDF-1 on angiogenesis ability of EPCs表2 SDF-1对EPCs血管形成能力的影响(μm,±s)
*P<0.05,**P<0.01
组别DM组HC组t n EPCs血管形成长度非干预116.99±7.98 184.24±7.44 19.490**SDF-1干预138.02±9.65 198.88±8.99 14.586**t 10 10 8.386**5.477*SDF-1干预—非干预21.03±12.14 14.64±5.52 6.825*
2.5 不同浓度的SDF-1干预对EPCs中AKT蛋白表达的影响 同一浓度下,DM组的AKT蛋白表达水平均低于HC组(均P<0.01)。无论是DM组还是HC组,AKT蛋白的表达均随着加入SDF-1浓度的增加而呈递增趋势(P<0.05);100 μg/L SDF-1+ AMD3100组 AKT蛋白的表达水平较 100 μg/L SDF-1组明显降低(P<0.05),见图5、表3。
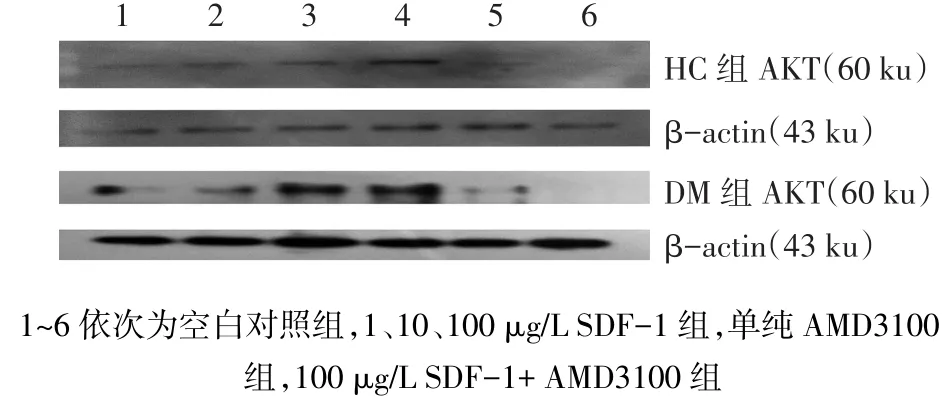
Fig.5 AKT protein expressions under different concentrations of SDF-1 in two groups图5 不同浓度SDF-1干预2组人群EPCs中AKT蛋白表达水平
Tab.3 AKT protein expressions under different concentrations of SDF-1 in two groups表3 不同浓度SDF-1干预2组人群EPCs中AKT蛋白表达水平 (n=5,±s)
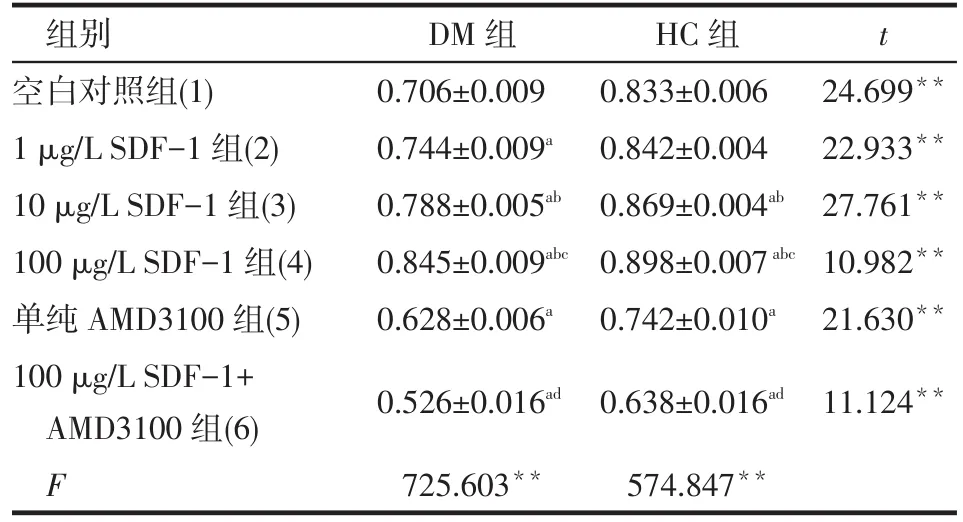
Tab.3 AKT protein expressions under different concentrations of SDF-1 in two groups表3 不同浓度SDF-1干预2组人群EPCs中AKT蛋白表达水平 (n=5,±s)
**P<0.01;a与(1)比较,b与(2)比较,c与(3)比较,d与(4)比较,P<0.05
组别空白对照组(1) 1 μg/L SDF-1组(2) 10 μg/L SDF-1组(3) 100 μg/L SDF-1组(4)单纯AMD3100组(5) 100 μg/L SDF-1+ AMD3100组(6) F DM组0.706±0.009 0.744±0.009a0.788±0.005ab0.845±0.009abc0.628±0.006a0.526±0.016ad725.603**HC组0.833±0.006 0.842±0.004 0.869±0.004ab0.898±0.007abc0.742±0.010a0.638±0.016ad574.847**t 24.699**22.933**27.761**10.982**21.630**11.124**
3 讨论
研究发现,糖尿病患者外周血中EPCs数量较健康人明显减少,且EPCs数量减少与糖化血红蛋白(HbA1c)、低密度脂蛋白胆固醇(LDL-C)呈负相关,提示高血糖、高LDL-C均可导致EPCs数量的减少[5]。刘华伟等[6]研究发现糖尿病危险因素的存在与EPCs数量呈负相关,说明糖尿病在该特殊群体中对EPCs的影响。王丽莉等[7]研究也发现,糖尿病患者EPCs数量下降,且高龄、血糖控制差及有血管病变的患者EPCs数量下降更为明显。因此,早期治疗、严格控制血糖、血脂有利于增加糖尿病患者体内的EPCs并改善其功能,进而促进糖尿病血管病变的恢复。
Hamed等[8]通过对55例糖尿病合并心血管病患者的研究发现,高血糖和高LDL-C能够降低CXCR4基因表达并抑制PI3K/AKT/eNOS信号级联反应系统的活化,从而抑制EPCs的迁移。本研究结果亦证实,糖尿病患者EPCs迁移能力和血管形成能力较健康成人明显减弱,加入SDF-1干预后,EPCs迁移能力和血管形成能力均增强,且DM组的EPCs迁移能力和血管形成能力增强的幅度均高于HC组。由此推测,SDF-1能促进EPCs迁移能力和血管形成能力,对于EPCs功能受损的糖尿病患者效果更为明显。
SDF-1是细胞膜CXC趋化因子家族一员,它与EPCs受体CXCR4结合,激活的SDF-1/CXCR4轴进而动员骨髓的EPCs进入血液循环和诱导细胞的迁移。但其激活机制涉及多种信号分子途径,包括蛋白酶的激活、细胞因子的释放和基质的降解[9]。有研究发现,SDF-1α干预EPCs,能够呈时间-浓度依赖性促使AKT、eNOS和ERK1/2蛋白的磷酸化,从而激活PI3K/AKT/eNOS信号通路[4]。本研究结果显示:糖尿病患者AKT蛋白表达水平较健康对照者明显降低,可能与糖尿病状态下EPCs数量下降、功能受损有关。且AKT蛋白的表达在1、10、100 μg/L SDF-1组呈递增趋势;100 μg/L SDF-1+AMD3100 组AKT蛋白的表达较100 μg/L SDF-1组明显降低,笔者推测,SDF-1呈浓度依赖性上调EPCs中p-AKT-Ser473的表达,而SDF-1受体CXCR4拮抗剂AMD3100可以明显阻断SDF-1上调p-AKT-Ser473的作用,提示SDF-1通过PI3K激活了EPCs中AKT信号通路。本研究结果中,单纯AMD3100组AKT蛋白的表达较空白对照组低,分析可能与AMD3100阻断EPCs自身表达的SDF-1α的自分泌和旁分泌调节作用有关。
有研究发现,增殖性糖尿病视网膜病变患者玻璃体内SDF-1有明显升高,而有黄斑水肿者SDF-1浓度更高,同时通过动物模型实验表明采取玻璃体腔内注射外源性的SDF-1能明显地促进视网膜新生血管生成,而注射SDF-1中和抗体则可阻止新生血管形成[10]。本研究中也观察到,AMD3100可阻滞PI3K/ AKT信号通路,在糖尿病增殖性视网膜病变的患者中,是否可局部应用SDF-1拮抗剂来阻止脉络膜新生血管的形成,从而为增殖性糖尿病视网膜病变、黄斑水肿提供一个安全有效的治疗方法,值得探讨。对于糖尿病缺血性血管病变患者,是否有望通过局部注射人SDF-1改善血供,是有待探索的新方向。

Fig.1 Colony formation after three days(×20)图1 第3天集落形成(×20)

Fig.2 Cells showing long fusiform after seven days(×10)图2 第7天细胞呈长梭形(×10)

Fig.3 Cells showing“cobblestone”appearance after two weeks(×10)图3 第14天细胞呈铺路石样形态(×10)
[1]Churdchomjan W,Kheolamai P,Manochantr S,et al.Comparison of endothelial progenitor cell function in type 2 diabetes with good and poor glycemic control[J].BMC Endocr Disord,2010,10:5.
[2]Kawamoto A,Losordo DW.Endothelial progenitor cells for cardiovascular regeneration[J].Trends Cardiovasc Med,2008,18:33-37.
[3]Xia YP,Wei DH,Tong ZY,et al.Effects of stromal cell-derived factor-1α on proliferation and clone formation of rat bone marrow derived endothelial progenitor cells[J].Zhongguo Shiyong Yiyao,2008, 3(21):3-5.[夏艺萍,危当恒,童中艺,等.SDF-1α对大鼠骨髓源性内皮祖细胞克隆形成能力及增殖的影响[J].中国实用医药,2008,3 (21):3-5.]
[4]Zheng H,Fu G,Dai T,et al.Migration of endothelial progenitor cells mediated by stromal cell-derived factor-1 alpha/CXCR4 via PI3K/ AKT/eNOS signal transduction pathway[J].J Cardiovasc Phamacol,2007,50(3):274-280.
[5]Guo L,Huo YN,Deng Y.The relationship between circulating endothelial progenitor cells and its influential factors in Type 2 diabetics mellitus of male[J].Practical Clinical Medicine,2010,11(1):11-15.[郭莉,霍亚南,邓颖.男性2型糖尿病患者外周血内皮祖细胞与其各影响因素间的相关性分析[J].实用临床医学,2010,11(1):11-15.]
[6]Liu HW,Wang LL,Liu QJ,et al.The number of changes and discussion on mechanism of endothelial progenitor cells from peripheral blood in patients with type 2 diabetes[J].Journal of Tianjin Medical University,2013,19(4):323-325.[刘华伟,王丽莉,刘庆君,等.2型糖尿病患者外周血内皮祖细胞数量变化及机制探讨[J].天津医科大学学报,2013,19(4):323-325.]
[7]Wang LL,Zhuge X,Chen YL,et al.Changes of angiogenic factors in patients with type 2 diabetes mellitus[J].Chinese Journal of Endocrinology and Metabolism,2012,28(3):219-220.[王丽莉,诸葛欣,陈翊玲,等.2型糖尿病患者血管新生相关因子水平的变化[J].中华内分泌代谢杂志,2012,28(3):219-220.]
[8]Hamed S,Brenner B,Abassi Z,et al.Hyperglycemia and oxidized-LDL exert a deleterious effect on endothelial progenitor cell migration in type 2 diabetes mellitus[J].Thromb Res,2010,126(3):166-174.
[9]Isabelle P,David J,Shahin,R.The SDF-1/CXCR4 signaling pathway:amolecular hubmodulating neoangiogenesis[J].Trends Immunol,2007,28:299-307.
[10]Butler JM,Guthrie SM,Koc M,et al.SDF-1 is both necessary and sufficient to promote proliferative retinopathy[J].J Clin Invest,2005, 115(1):86-93.
(2014-06-03收稿 2014-07-04修回)
(本文编辑 闫娟)
Effects of Stromal Cell-Derived-Factor-1 on Endothelial Progenitor Cells of Peripheral Blood and Their Relationship with PI3K/AKT Signal Transduction Pathway in Patients with Diabetes
LI Jinfeng,LIN Anhua,DENG Ying,HUO Ya’nanΔ,LIU Jingdong,WU Mingbin,WANG Chenxiu
Department of Endocrinology,The People's Hospital in Jiangxi Province,Nanchang 330006,China△
E-mail:hyn_hyn0216@126.com
ObjectiveTo observe the effects of stromal cell-derived-factor-1(SDF-1)on the function of endothelial progenitor cells(EPCs)of peripheral blood in patients with diabetes,and to discuss the effects of PI3K/AKT signaling pathway on the role of SDF-1 in EPCs.MethodsThe peripheral blood samples(30 mL)were collected in 10 diabetes patients (DM group)and 10 healthy controls(HC group).(1)The 100 μg/L SDF-1 was added in intervention group.EGM-2MV was added in non-intervention group.The Boyden chamber and in vitro angiogenesis kit were used to analyze the migration and in vitro angiogenesis of EPCs.(2)Cultured EPCs were divided into blank control group,1 μg/L SDF-1 group,10 μg/L SDF-1 group,100 μg/L SDF-1 group,pure AMD3100 group and 100 μg/L SDF-1+AMD3100 group.AKT protein expression levels of endothelial progenitor cells were detected by Western blot assay in each group.Results(1)Without intervention with SDF-1,EPCs’migration and angiogenesis ability were lower in DM group than those in HC group.After intervention with SDF-1,the migration and angiogenesis ability were enhanced in two groups,but the increased level was higher in DM group than that of HC group.(2)Under the same concentration,AKT protein expression level was significantly lower in DM group than that in HC group(P<0.01).AKT protein expression levels were increased with the increased levels of SDF-1 in DM group and HC group(P<0.05).AKT protein expression was significantly lower in 100 μg/L SDF-1+AMD3100 group than that of 100 μg/L SDF-1 group(P<0.05).ConclusionSDF-1 can increase the chemotactic migration and angiogenesis ability of EPCs in peripheral blood,especially for patients with diabetes.The effects of SDF-1 on EPCs were related to the PI3K/AKT signaling pathway.
stromal cell-derived-factor-1;endothelial progenitor cells;phosphoinositide3-kinase/protein kinase B; diabetes
R587.1
A
10.3969/j.issn.0253-9896.2014.11.004
江西省科技厅科技支撑计划(20111BBG70018-1)
南昌,江西省人民医院内分泌科(邮编330006)
△通讯作者 E-mail:hyn_hyn0216@126.com

