胃癌伴神经内分泌分化和胃混合性腺神经内分泌癌临床病理及预后分析
宋 魏 于庆凯
胃癌伴神经内分泌分化和胃混合性腺神经内分泌癌临床病理及预后分析
宋 魏 于庆凯△
目的 探讨胃癌伴神经内分泌分化(NED)和胃混合性腺神经内分泌癌(MANECs)的临床病理特点及与预后的关系。方法回顾性分析61例胃癌伴NED和34例MANECs患者的临床病理资料,对其组织学HE染色及免疫组织化学染色进行观察。通过生存分析比较2组患者的预后差异,对影响胃癌患者生存预后相关因素进行COX风险比例模型分析。结果胃癌伴NED和MANECs患者肿瘤发病部位、远处转移及区域淋巴结转移差异有统计学意义(P<0.05);胃癌伴NED患者组织免疫组化染色突触素(Syn)的阳性表达率高于嗜铬素A(CgA)、CD56;MANECs患者术后生存期短于胃癌伴NED患者(P<0.05);多因素分析结果显示区域淋巴结转移和远处转移是预后的独立影响因素(P<0.05)。结论免疫组化染色对胃癌伴NED和MANECs的确诊具有重要价值,肿瘤神经内分泌细胞数量的多少对患者预后评估及辅助治疗有指导意义。
胃肿瘤;癌,神经内分泌;免疫组织化学;预后;神经内分泌分化;胃混合性腺神经内分泌癌
胃癌伴神经内分泌分化(neuroendocrine cell differentiation,NED)是指分化的神经内分泌细胞以单个或细胞巢的形式散在分布于胃癌细胞之间,为胃癌组织的一种伴随成分,归为腺癌一类,其神经内分泌细胞占肿瘤成分≤30%。胃混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinomas,MANECs)属于胃神经内分泌肿瘤范畴,其神经内分泌细胞占肿瘤成分>30%。2010年第4版WHO消化系统肿瘤分类对胃癌伴NED和MANECs的定义进行了修订和统一。本研究回顾分析我院收治的662例胃癌患者的胃癌组织免疫组化染色结果,筛选出61例胃癌伴NED和34例MANECs患者,并结合随访结果,探讨两者的临床病理特点及预后。
1 资料与方法
1.1 一般资料 为我院2007年4月—2009年4月收治的662例胃癌患者。61例胃癌伴NED患者中男50例,女11例,年龄24~79岁;34例MANECs患者中男25例,女9例,年龄44~78岁。所有患者均接受外科手术治疗,其中60例患者进行了根治切除,35例姑息切除。
1.2 方法 所有标本经10%中性福尔马林固定,石蜡包埋,切片经HE染色和SP法免疫组化染色。以CK18、癌胚抗原(CEA)作为胃腺癌的诊断指标。嗜铬素A(CgA)、突触素(Syn)、神经细胞黏附分子(CD56)3个特异的神经内分泌标志物中有任何一项标志物表达即判定为免疫组化神经内分泌标志物阳性。在光镜下判定神经内分泌细胞在癌组织中所占比例,≤30%诊断为胃癌伴NED,>30%诊断为MANECs。
1.3 随访 2组患者通过门诊定期复查,以电话、短信联系及邮件等方式获得,随访36个月,截止日期2013年1月。无失访病例。
1.4 统计学方法 采用SPSS 19.0软件进行统计学处理,计数资料比较采用χ2检验。应用Kaplan-Meier法计算生存率。应用COX风险比例模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床特点 61例胃癌伴NED及34例MANECs患者主要症状为消化不良、上腹部不适、腹胀、腹痛,其他症状包括恶心、黑便、食欲减退和消瘦等。61例胃癌伴NED患者中3例存在类癌综合征表现,34 例MANECs患者有2例出现不典型类癌综合征表现。胃癌伴NED及MANECs患者之间性别、年龄、T分期、TNM分期及肿瘤分化程度差异无统计学意义,肿瘤发病部位、区域淋巴结转移及远处转移差异有统计学意义(P<0.05),见表1。

Tab.1 Relationships between gastric cancer with NED or MANECs in clinicopathological feature表1 胃癌伴NED及MANECs临床病理特征的关系
2.2 HE及免疫组化 胃癌伴NED和MANECs的HE染色多表现为中或低分化腺癌的特点。必须通过免疫组化染色才能准确判定胃癌组织中的神经内分泌癌成分。61例胃癌伴NED和34例MANECs的腺癌组织和神经内分泌癌组织均表达CK18。CEA在胃癌伴NED阳性率为86.9%(53/61),在MANECs阳性率为47.1%(16/34)。神经内分泌细胞呈单个细胞、片状或巢状分布在胃腺癌组织中,Syn、CgA、CD56在胃癌伴NED的组织中阳性率分别为80.3% (49/61)、49.2%(30/61)、67.2%(41/61),在MANECs组织中分别为85.3%(29/34),82.4%(28/34),85.3% (29/34),见图1~8。
2.3 生存分析
2.3.1 生存率分析 胃癌伴NED患者术后1年生存率为65.57%,3年生存率为26.22%,中位生存期为19个月。MANECs患者术后1年生存率为50.00%,3年生存率为11.76%,中位生存期为12个月,MANECs患者术后生存期短于胃癌伴NED患者(χ2=5.012,P= 0.025),见图9。

Fig.9 Kaplan-Meier survival curves of gastric cancer patients with NED and MANECs图9 胃癌伴NED与MANECs患者的Kaplan-Meier生存曲线
2.3.2 多因素分析结果 将性别、年龄、胃癌伴NED/MANECs、发病部位、T分期、淋巴结转移、远处转移、TNM分期纳入COX风险比例模型,见表2。结果显示区域淋巴结转移、远处转移是预后的独立影响因素,出现区域淋巴结转移、远处转移患者生存时间将缩短。胃癌伴NED/MANECs不是影响胃癌预后的因素。

Tab.2 Assessment of independent factors influencing prognosis of gastric cancer patients in COX proportional hazard model表2 运用COX比例风险模型评估胃癌预后的影响因素
3 讨论
2010年第4版《WHO消化系统肿瘤》将胃肠胰神经内分泌肿瘤分为神经内分泌瘤、神经内分泌癌和MANECs[1]。胃神经内分泌瘤属于高分化肿瘤,预后良好;胃神经内分泌癌具有恶性生物学行为,预后不良[2]。胃癌伴NED归属为腺癌范畴。有研究证实胃神经内分泌癌的组织学起源与一般腺癌相似,可能都来源于多潜能原始干细胞的增殖,分别向神经内分泌癌和腺癌分化[3]。电镜下也观察到同一个癌细胞内既有内分泌颗粒又有黏液颗粒[4]。Syn、CgA是近年来发现的作为诊断NED存在和分布的特异性标志物[5]。本组所有病例均表达CK18,CEA在胃癌伴NED和MANECs的阳性表达率分别为86.9%和47.1%。3个特异的神经内分泌标志物中Syn的阳性表达率最高,本研究选择Syn、CgA、CD56共同应用,可以提高NED分化的诊断率,为临床诊断和治疗提供可靠依据。
以手术为主的综合治疗是胃癌伴NED以及MANECs的首选治疗方式,手术方式与胃腺癌的相同。本研究的所有患者均接受手术治疗。肿瘤伴发的神经内分泌细胞是肿瘤发展过程中干细胞多向分化的结果,细胞分化障碍时肿瘤细胞获得较强的增殖优势,肿瘤很快进入相对晚期[5]。于红梅等[6]研究发现胃癌伴NED患者的术后生存时间短于不伴有神经内分泌分化的胃腺癌。申健等[7]发现MANECs预后较普通腺癌差。在本研究中MANECs患者术后生存期明显短于胃癌伴NED患者,预后不良,并且区域淋巴结转移和远处转移是预后的独立影响因素。目前对胃肠胰神经内分泌肿瘤化疗有效率报道差异较大。生长抑素类药物可以抑制神经内分泌细胞分泌多种生物活性物质的分泌,改善临床症状;同时通过阻断细胞周期G1期和阻断非生长素释放抑制激素受体依赖的途径,调节免疫、抑制血管生成、促进凋亡等,阻断肿瘤生长[8],对这两类肿瘤的治疗效果逐渐得到临床的认可。
综上所述,神经内分泌标志物检测对胃癌伴NED和MANECs的鉴别诊断、预后评估及辅助治疗的选择有一定价值。胃癌伴NED和MANECs预后的相关分子生物学机制及术后个体化疗方案的制定有待于进一步研究。
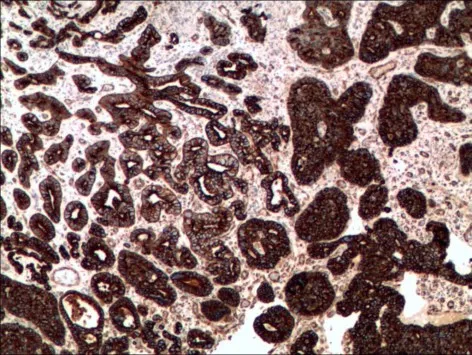
Fig.1 CK18 positive staining in gastric carcinoma with NED图1 CK18在胃癌伴NED组织中的表达(SP法,×40)

Fig.2 CK18 positive staining in MANECs图2 CK18在MANECs组织中的表达(SP法,×100)

Fig.3 Syn positive staining in gastric carcinoma with NED图3 Syn在胃癌伴NED组织中的表达(SP法,×40)
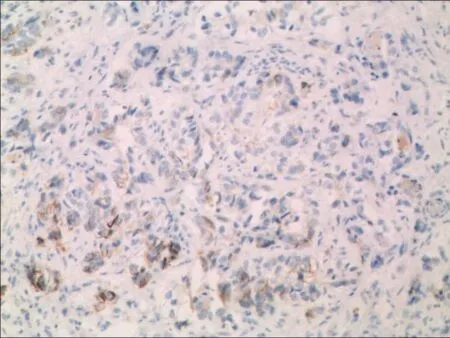
Fig.4 CgA positive staining in gastric carcinoma with NED图4 CgA在胃癌伴NED组织中的表达(SP法,×100)
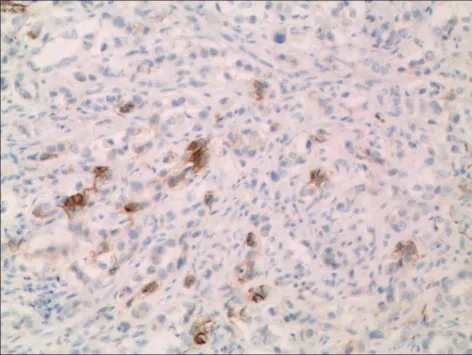
Fig.5 CD56 positive staining in gastric carcinoma with NED图5 CD56在胃癌伴NED组织中的表达(SP法,×100)

Fig.6 Syn positive staining in MANECs图6 Syn在MANECs组织中的表达 (SP法,×100)

Fig.7 CgA positive staining in MANECs图7 CgA在MANECs组织中的表达(SP法,×100)

Fig.8 CD56 positive staining in MANECs图8 CD56在MANECs组织中的表达(SP法,×100)
[1]Pericleous M,Toumpanakis C,Lumgair H,et al.Gastric mixed adenoneuroendocrine carcinoma with a trilineage cell differentiation: case report and review of the literature[J].Case Rep Oncol,2012,5 (2):313-319.
[2]La Rosa S,Inzani F,Vanoli A,et al.Histologic characterization and improved prognostic evaluation of 209 gastric neuroendocrine neoplasms[J].Hum Pathol,2011,42(10):1373-1384.
[3]董兰花,沈虹,潘文胜.消化道神经内分泌癌生长模式的探讨[J].实用肿瘤杂志,2008,14(2):37-41.
[4]陈旭东,何松,严桥,等.胃癌神经内分泌分化的免疫组化及超微结构观察[J].胃肠病学和肝病学杂志,2007,16(5):447-450.
[5]Furlan D,Cerutti R,Uccella S,et al.Different molecular profiles characterize well-differentiated endocrine tumors and poorly differentiated endocrine carcinomas of the gastroenteropancreatic tract [J].Clin Cancer Res,2004,10(3):947-957.
[6]于红梅,刘晓文,龙子文,等.胃癌伴NED的临床病理及预后分析[J].中国癌症杂志,2013,23(1):42-46.
[7]申健,杨红梅,达小萍.胃肠混合性腺神经内分泌癌的回顾性病例分析[J].胃肠病学,2013,18(9):552-555.
[8]Mejias M,Garcia-Pras E,Tiani C,et al.The somatostatin analogue octreotide inhibits angiogenesis in the earliest,but not inadvanced,stages of portal hypertension in rats[J].J Cell Mol Med,2008,12(5A): 1690-1699.
(2013-10-09收稿 2014-04-04修回)
(本文编辑 李国琪)
Analysis of Clinicopathological Features and Prognosis of Gastric Carcinoma with Neuroendocrine Differentiation and Mixed Gonadal Neuroendocrine Carcinoma of the Stomach
SONG Wei,YU Qingkai
Department of Pathology,Affiliated Cancer Hospital of Zhengzhou University,Henan 450003,China YU Qingkai,E-mail:Yuqingkai@hotmail.com
ObjectiveTo investigate the clinical pathological features and prognosis of gastric carcinoma with neuroendocrine differentiation(NED)and mixed gonadal neuroendocrine carcinoma of the stomach(MANECs).MethodsA retrospective analysis of 61 cases of gastric carcinoma with NED and 34 cases of MANECs and their histochemistry and immunohistochemistry were also observed.Prognosis of the 2 groups were compared by the Kaplan-Meiers survival analysis. Prognostic factors associated with patients with gastric cancer were analyzed by COX proportional hazards model.ResultsTumor location,distant metastasis and lymph node metastasis were statistically different between these 2 groups(P<0.05). Syn positive expression rate is higher than CgA and CD56 in the gastric carcinoma with NED group;Postoperative survive period of the gastric carcinoma with NED is shorter than that of MANECs(P<0.05).Lymph node metastasis and distant regional transfer is obviously correlated with prognosis(P<0.05).ConclusionImmunohistochemistry is important for the diagnosis of these two tumor.The number of neuroendocrine cells can help to assess prognosis and guide treatment.
stomach neoplasms;carcinoma,neuroendocrine;immunohistochemistry;prognosis;neuroendocrine differentiation;mixed gonadal neuroendocrine carcinoma of the stomach
R735.2
A
10.3969/j.issn.0253-9896.2014.08.018
郑州大学附属肿瘤医院病理科(邮编450003)△
E-mail:Yuqingkai@hotmail.com

