三段生物制剂-石灰法深度处理酸性重金属废水
张天芳,魏文武,彭许文
(1.株洲冶炼集团股份有限公司,湖南株洲 412004;2.铅锌联合冶金湖南省重点实验室,湖南株洲412004)
·环 保·
三段生物制剂-石灰法深度处理酸性重金属废水
张天芳1,2,魏文武1,2,彭许文1,2
(1.株洲冶炼集团股份有限公司,湖南株洲 412004;2.铅锌联合冶金湖南省重点实验室,湖南株洲412004)
采用生物制剂与石灰三段法深度处理株洲冶炼集团股份有限公司酸性重金属废水,工业试验运行过程中对总废水及处理后出水中各重金属浓度进行监测,并对渣样进行分析。结果表明:重金属浓度分别由锌84.63~583.39 mg/L,铅1.11~20.43 mg/L,镉2.38~19.18 mg/L,铜0.35~6.51 mg/L,砷0.71~1.19 mg/L,汞0.001 2~0.063 mg/L脱除至锌0.12~0.83 mg/L,铅0.18~0.46 mg/L,镉0.008~0.046 mg/L,铜0.12~0.19 mg/L,砷0.005~0.009 mg/L,汞0.000 12~0.002 2 mg/L,处理后出水各重金属含量均远低于《铅、锌工业污染物排放标准GB 25466-2010》。整套工艺只需控制一段水解pH值为9.0,无需硫酸、NaOH再次调节二段及三段水解pH值。配合渣中锌的质量分数达到了29.5%,可以作为锌冶炼企业的原料回收其中的重金属。
酸性重金属废水;生物制剂;三段
工业化的迅速发展使大量的重金属废水排放到环境中,重金属废水中主要存在汞、锡、铅、铬、镍、砷等生物毒性显著的元素[1,2],它们无法被生物体分解,一旦进入环境后就会在环境中不断积累,造成长期的环境污染。传统处理重金属废水的方法主要是物理化学法,如吸附法、离子交换法、化学沉淀法、膜分离法、氧化还原法[3~5]等,但这些方法都具有二次污染严重、处理成本高等问题。用石灰和石灰石处理酸性矿山废水成本低、适应性强,但渣量大,不利于有价金属的回收,且易造成二次污染[6,7]。生物法作为一种新兴的重金属去除技术,具有能耗少、成本低、效率高且无二次污染等优点,已经成为世界各国研究的焦点[8~10]。
株洲冶炼集团股份有限公司地处长株潭段上游,其工业污水治理成效直接影响长株潭地区饮水安全。为实现污染控制、提高资源利用率,该公司提出了以循环经济发展模式来实现自身可持续发展,2006年公司与中南大学联合开发研制了“生物制剂配合-水解”技术处理重金属废水,处理后净化水中Cu、Pb、Zn、Cd、As、Hg等污染物排放指标达到GB 8978-19965污水综合排放标准要求,但2012年正式实行的《铅、锌工业污染物排放标准GB 25466-2010》对外排水中重金属离子等含量提出了更高的要求,为此,公司从工艺路线改造着手,依附科技力量,在原有设备的基础上提出了本次实验。研究结果表明:经三段生物法深度处理的净化水锌离子、铅离子等重金属含量低于新标限定值。
1 试验方法
1.1 试验流程
试验流程如图1所示。废水流量为200 m3/h,将生物制剂通过泵打入废水管道中进行配合反应,然后进入3#斜板混合反应池,加入石灰乳调节反应池pH值至9.0进行中和沉淀,加入适量的聚丙烯酰胺(PAM)在3#沉淀池实现固液分离,上清液为处理后的一段净化水进入4#斜板反应池,与生物制剂反应后通过4#斜板进行二段沉降,上清液为处理后的二段净化水进入5#均化池。通过泵将5#均化池进一步沉降的二段净化水打入5#斜板混合反应池,加入适量生物制剂反应后进入斜板沉淀池固液分离,上清液为处理后的三段净化水回用或外排,污泥经浓密和压滤后进入冶炼系统综合利用。
1.2 试验条件
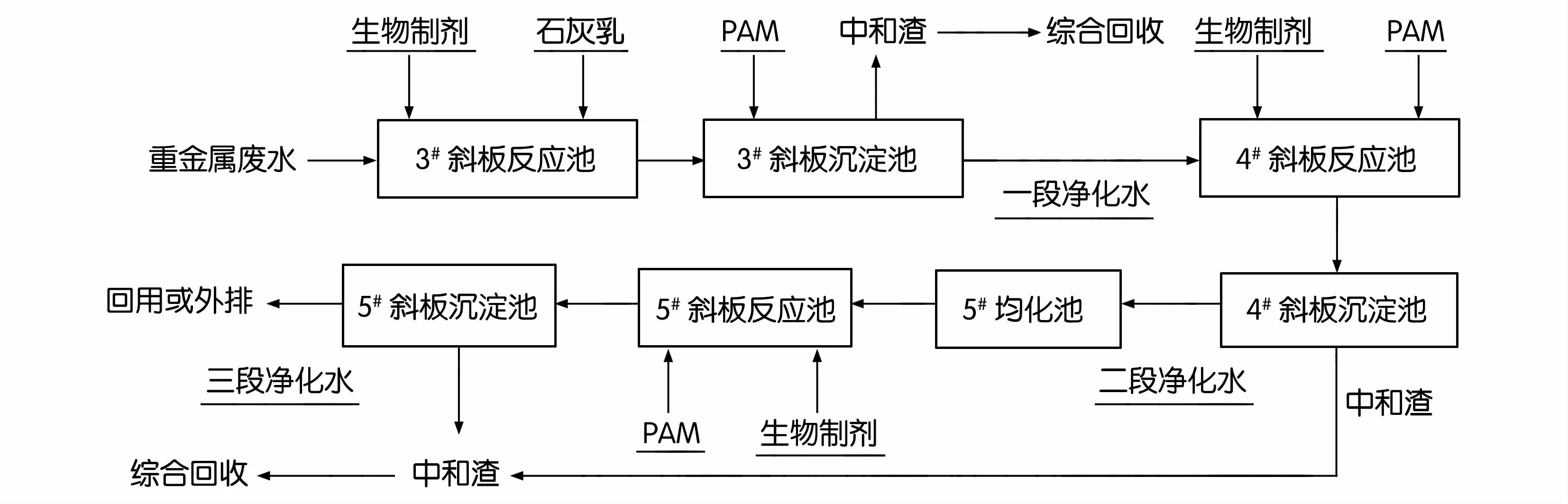
图1 生物制剂处理酸性重金属废水工业实验流程
试验中控制废水流量200 m3/h,在一段处理中生物制剂加入量10 g/m3,每2 h根据均化池中锌离子浓度调节一次生物制剂投加量,使其为锌离子浓度的2倍,用石灰乳调节pH值,控制水解pH值至9.0,PAM的加人量为3~5 g/m3。在二段与三段处理中生物制剂加入量1 g/m3,PAM的加入量为1~2 g/m3。
1.3 分析方法
分析试样取自总废水均化后、总废水与生物制剂配合反应产出的一段净化水、二段净化水及三段净化水。实验期间铜、铅、锌、镉每2 h取样一次,汞、砷每4 h取样监测一次。采用冷原子荧光测汞仪(USEPA7473)分析Hg含量,监测下限为0.05 μg/L,采用原子吸收分光光度计(VARIAN220)测定Cu、Pb、Zn、Cd,采用原子荧光分光光度计(AFS2201)测定As;采用扫描电镜(J840A,Jeol,Japan)分析水解渣的表面形貌。
2 结果与讨论
2.1 总废水中锌、铅、镉、铜的去除效果
图2~图5分别为三段生物法对废水中锌、铅、镉、铜的去除情况。可见,废水中各重金属的浓度波动很大,实验过程中废水中锌浓度在84.63~583.39 mg/L之间波动,铅浓度1.11~20.43 mg/L,镉浓度2.38~19.18 mg/L,铜浓度0.35~6.51 mg/L,经过三段生物法处理后的三段净化水中锌浓度0.12~0.83 mg/L,铅浓度0.18~0.46 mg/L,镉浓度0.008~0.046 mg/L,铜浓度0.12~0.19mg/L,均低于国家《铅、锌工业污染物排放标准GB 25466-2010》。这表明三段生物法对废水中各重金属均有很好的去除效果。
2.2 总废水中汞、砷的去除效果
图6和图7所示分别为废水及三段生物法处理后出水中砷和汞的浓度。由图6和图7可知,实验过程中废水中砷浓度在0.71~1.19 mg/L波动,汞浓度在0.002 7~0.063 mg/L波动,经过三段生物法处理后的三段净化水中砷浓度在0.005~0.009 mg/L,出水中汞浓度在0.000 12~0.002 2 mg/L,均低于国家《铅、锌工业污染物排放标准GB 25466-2010》。这表明三段生物法对废水中的汞和砷都有很好的去除效果。
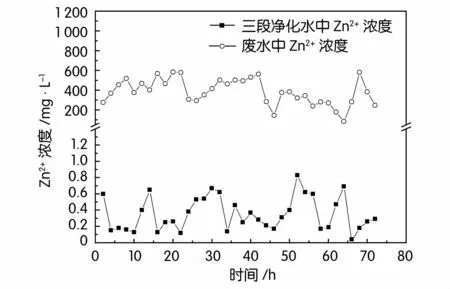
图2 三段生物法对废水中锌的去除效果
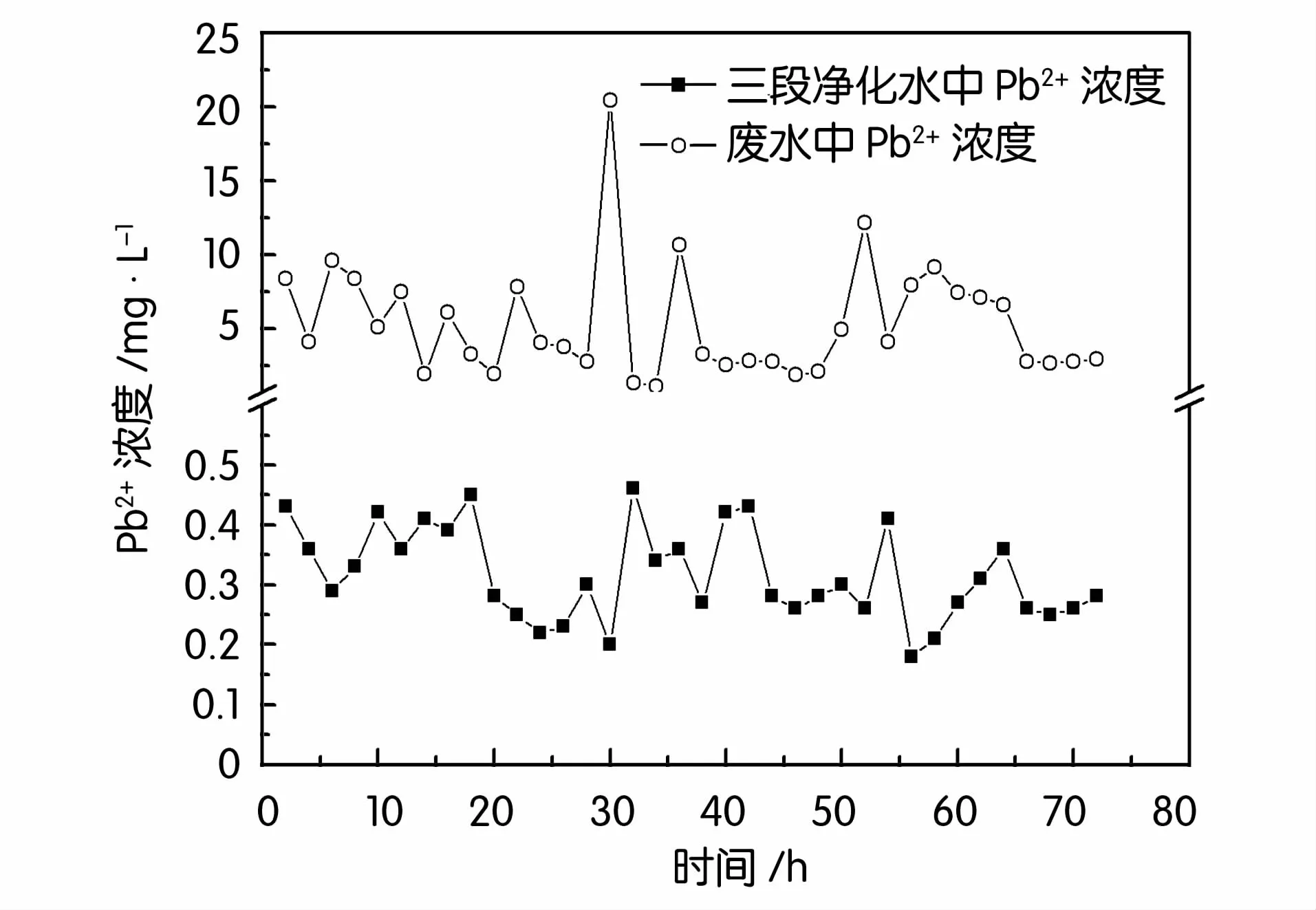
图3 三段生物法对废水中铅的去除效果
如表1所示三段生物法产出的净化水锌、镉的去除率在99.6%以上,铅、铜去除率分别达到了94.24%、92.89%,汞与砷的去除率也分别达到了97.2%与99.30%,处理效果明显优于二段处理法,各项重金属指标均低于国家《铅、锌工业污染物排放标准GB 25466-2010》,实现100%达标排放。
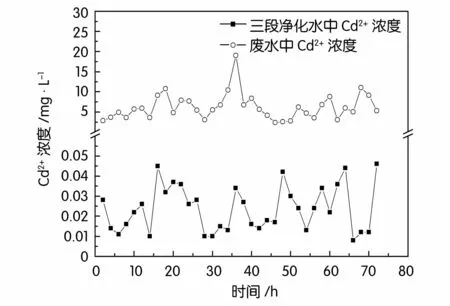
图4 三段生物法对废水中镉的去除效果
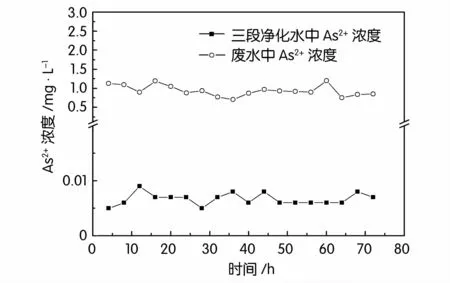
图6 三段生物法对废水中砷的去除效果
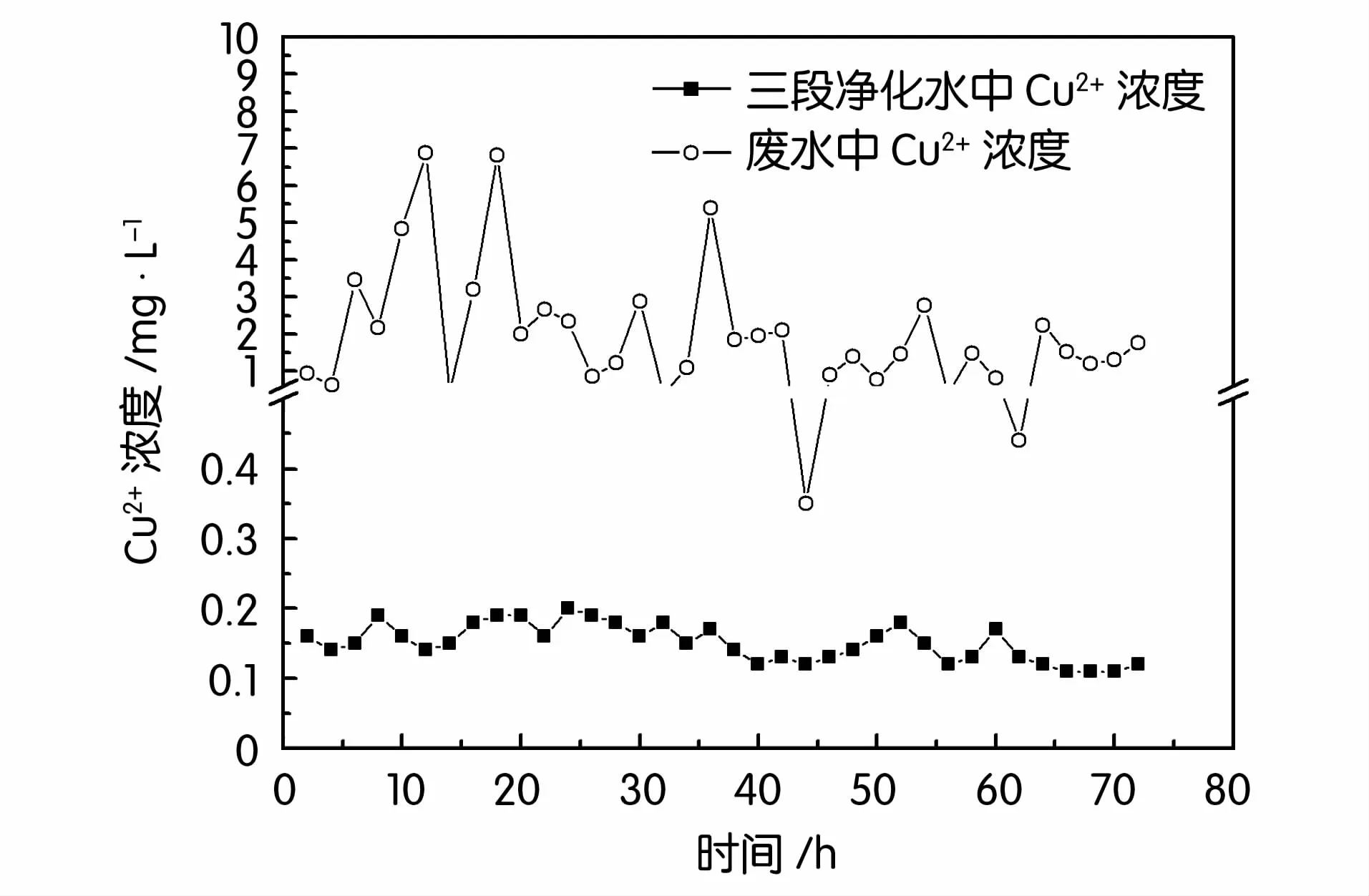
图5 三段生物法对废水中铜的去除效果

图7 三段生物法对废水中汞的去除效果
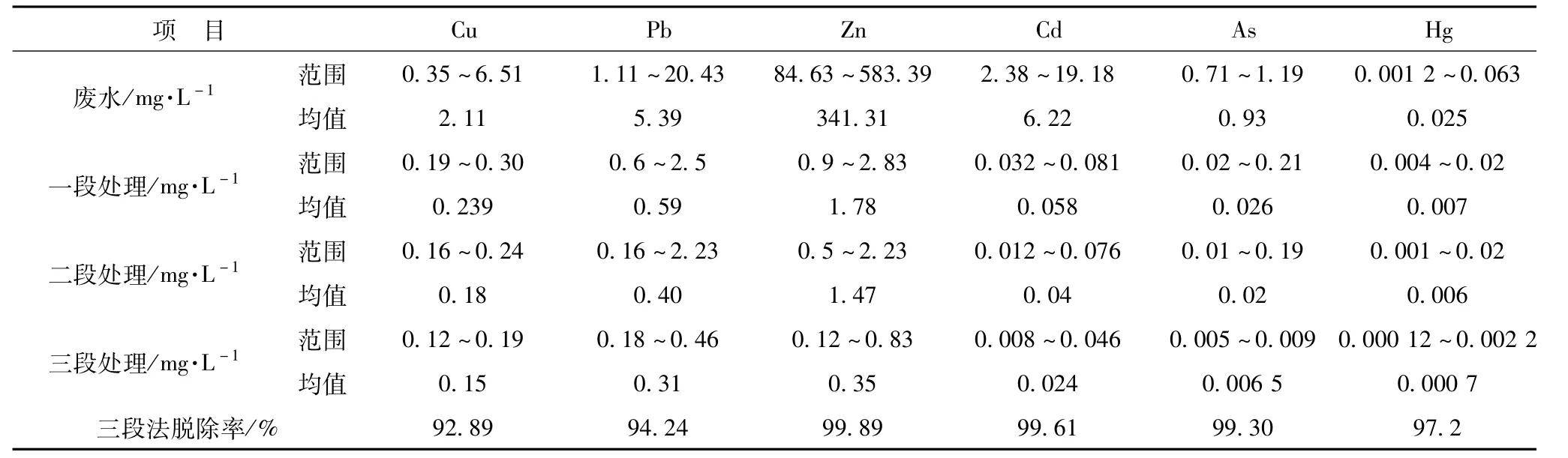
表1 三段生物法处理重金属废水工业试验结果
2.3 5#均化池净化水pH值对重金属离子去除效果的影响
尽管通过计算可以得到金属离子在何pH值条件下溶度积有最小值,但是重金属废水是一个由多种重金属离子共存的复杂体系,各种重金属的氢氧化物沉淀在相同pH值条件下却会有不同的溶解度。当废水中含有锌、铅等两性金属时,形成的氢氧化物沉淀在高pH值条件下有再溶解倾向,因此在处理时必须严格控制pH值。
二段净化水进入5#均化池后的pH值控制是试验的关键参数,通过硫酸与NaOH对二段净化水pH值进行调节,使5#均化池净化水pH值分别为4.0、6.0、7.0、8.0、9.0、10.0、11.0,以考察三段净化水重金属残余量与5#均化池净化水pH值的关系。
三段净化水重金属残余量与5#均化池净化水pH值的关系如图8所示,从图8可以看出在不同pH值情况下,三段净化水中Zn2+和Pb2+残余量随pH值变化而变化,Cu2+和Cd2+并没有非常明显的变化。当pH值为4.0~9.0时,Zn2+和Pb2+随pH值的升高,重金属残余量不断减少;当pH值在9.0时各种重金属残余量最少,而pH值大于9.0时Zn2+和Pb2+浓度又升高。
这是由于Zn2+与Pb2+的氢氧化物沉淀具有两性,既具有酸性,又具有碱性。在pH值等于9.0时,Zn2+几乎全部以Zn(OH)2的形式沉淀。但是当碱过量,使pH值>10.0时,生成的Zn(OH)2又能与碱起作用,溶于NaOH生成或离子[11]。
反应如下:
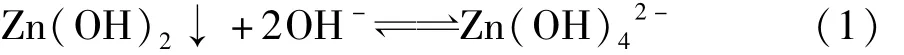
或
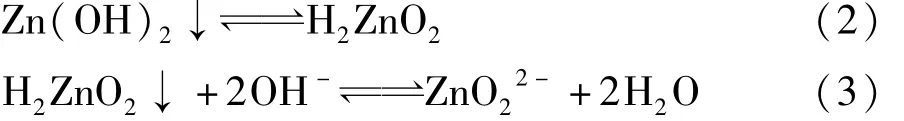
控制pH值在9.0,可使大部分金属锌离子全部转化为氢氧化物沉淀。这与不同pH值时金属锌离子以不同羟合配离子存在情况相符,当pH值小于8.4时主要以游离Zn2+以及少量Zn(OH)2分子存在,当pH值在8.4~10.8时主要以Zn(OH)2分子形态存在,以及少量的Zn2+、等离子,在pH值为9.7时Zn(OH)2分子形态含量超过90%,当pH值为9.3~11.0时Zn(OH)2逐渐减少,含量显著增加,pH值大于11.0主要以以及少量和Zn(OH)2形态存在[12]。在pH值为8.0~9.0时Zn(OH)2溶解度最小[13,14]。
在不同的pH值时金属铅离子以不同的形态存在,当pH值小于7.0时主要以游离Pb2+离子以及少量的PbOH+离子以及离子存在,并且浓度逐渐增大;当pH值在8.0~11.0时主要以以及少量的PbOH+离子和Pb(OH)2等存在。这是因为当氢氧化铅溶解于强碱溶液的羟基形成一个复杂的离子、、、体系[12]。在 pH值为10.3~11.2时Pb(OH)2溶解度最小[13,14]。
当5#均化池净化水pH值为4.0-7.0或pH≥10.0时,Zn(OH)2及Pb(OH)2溶解度降低,5#均化池中本来沉淀的Zn(OH)2及Pb(OH)2重新溶解,造成5#均化池净化水重金属离子含量增高,不利于第三段深度净化反应。且当pH≥10.0时生物制剂深度净化去除重金属的能力下降;当5#均化池净化水pH值为9.0时,Zn(OH)2溶解度最小,Pb(OH)2溶解度也较低,重金属离子可以在5#均化池进一步沉降。生物制剂在此pH值条件下可以与重金属离子水解反应,有利于重金属离子的深度净化。因此,5#均化池净化水的最佳pH值为9.0,二段净化水进入5#均化池后不需调节pH值。
2.4 水解渣表面形貌及能谱分析
水解渣的表面形貌如图9所示。由扫描电镜图可以看出,水解渣由晶态物质和无定形的非晶态物质组成;工艺过程中用石灰乳调节水解pH值,因此可以初步判断渣中晶体物质为碳酸钙,无定形的物质为生物制剂中的OH-基团、羧基、C-H键等与重金属离子形成的很稳定的配位化合物。

图9 三段生物法深度处理工艺水解渣的表面形貌
通过表面能谱分析定性分析,水解渣中各种元素组成,结果分别如图10、表2所示,由能谱图可以看出,非晶态物质组成的配合渣中含有Zn,Ca,O,C,Mg,Fe,Cd,Cu,S等元素;由各元素的含量分析可知,锌含量高达29.5%,可以作为冶炼原料回收其中的有价金属。溶解度最小,Pb(OH)2溶解度也较低,重金属离子可以在5#均化池进一步沉降。生物制剂在此pH值条件下可以与重金属离子水解反应,有利于重金属离子的深度净化。因此,5#均化池净化水的最佳pH值为
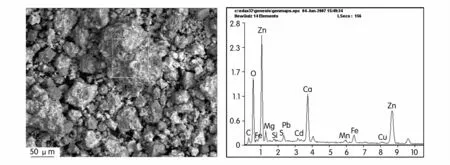
图10 水解渣SEM及EDX图

表2 水解渣EDX分析各元素的质量含量及所占比例
9.0 ,二段净化水进入5#均化池后不需调节pH值。3.水解渣主要由重金属离子配合体和碳酸钙组成。收集的配合渣中锌的质量分数达到了29.5%,综合利用价值较高,可以作为锌冶炼企业的原料回收其中的重金属。
3 实验小结
通过三段生物法工业试验可以得出如下结论:
1.该公司废水经生物制剂一段处理后的净化水pH值为9.0,进入4#斜板反应池与生物制剂反应后二段沉降,无需硫酸、NaOH再次调节pH值,直接投加生物制剂,经5#斜板三段沉降后产出的净化水中锌浓度0.12~0.83 mg/L,铅浓度0.18~0.46 mg/L,镉浓度0.008~0.046 mg/L,铜浓度0.12~0.19 mg/L,砷浓度0.005~0.009 mg/L,汞浓度在0.000 12~0.002 2 mg/L,均低于国家《铅、锌工业污染物排放标准GB 25466-2010》。锌、镉去除率在99.6%以上,铅、铜去除率分别达到了94.24%、92.89%,汞与砷去除率分别达到了97.2%与99.30%,这表明三段生物法对废水中各重金属均有很好的去除效果,生物制剂无二次污染、环境友好、工艺清洁,而且整个工艺在原有设备的基础上实施,实验数据稳定可靠,实现了酸性重金属废水的深度处理。
2.当5#均化池净化水pH值为9.0时,Zn(OH)2
[1] Stoiea,Anea-lulia.Analytieal studies on the pollution ofarges river[J]. Critical Reviews in Analytieal Chemistry,1999,29(3):243-247.
[2] Cotman M.,Slovenia Zagorc-Konean J.,Drole A.Study of impacts of treated wastewater to the krka river[J].Water Seience and Technology,2001,44(6):47-54.
[3] 汤兵,张俊浩,铁氧体法处理含Zn2+、Ni2+废水研究[J].环境保护科学,2002,28(109):12-15.
[4] 陈文森,陈炳稳,两性离子交换树脂对含锌废水的处理[J].化工时刊,2004,18(1):47-48.
[5] 张淑媛,李自法,含锌废水处理研究[J].离子交换与吸附,1994,(6):528-532.
[6] 丁希楼,丁春生,石灰石-石灰乳二段中和法处理矿山酸性废水[J].能源环境保护,2004,18(2):27-29.
[7] Kurniawan TA,Chan GY S,LoW H,etal.Physico-chemical treatment techniques forwastewater laden with heavymetals[J].Chemical Engineering Journal,2006,118(1/2):83-98.
[8] Volesky B.,Holan Z.R.,Biosorption of heavymetals[J].Bioteehnology Progress,1995,(11):235-250.
[9] Chang Duk,Kensuke f.,Ghoshs S.Stimulation of actived sludge culturers for enhaneed heavymetal removal[J].Water Environment Researeh,1999,(67):822-827.
[10]Ferraz A.I.,Teixeira J.A.The use of flocculation brewer’s yeast for Cr3+and Pb2+removal from residualwastewater[J].Bioproeess Engineering,1999,(21):43-437.
[11]王云燕,柴立元,王庆伟,等.重金属离子(Zn2+,Cu2+,Cd2+,Pb2+)—水系羟合配离子配位平衡研究[J].中国有色金属学报,2008,(18):183-191.
[12]Von Egon Wiberg,Nils Wiberg,Arnold Frederick Holleman.Inorganic Chemistry[M].Academic Press,2001.
[13]Therald Moeller,Chemistry with inorganic qualitative analysis[M]. John Wiley&Sons Inc,1982.
[14]Arnold F.Holleman,Nils Wiberg.Lehrbuch der Anorganischen Chemie[M].Auflage,de Gruyter,Berlin 2007.
[15]陈绍炎.水化学[M].北京:水利电力出版社,1989.
The Three Stage Biological Agents-lime Process for Advanced Treatment of Acidic W astewater w ith Heavy M etals
ZHANG Tian-fang,WEIWen-wu,PENG Xu-wen
(1.Zhuzhou Smelter Group Co.,Ltd,Zhuzhou 412004,China;2.Hunan Key Laboratory of Lead and Zinc Combined Metallurgy,Zhuzhou 412004,China)
The acidic wastewate with heavy metal from Zhuzhou Smelter was treated by biological agents-lime of three-stagemethod,and the removal effect of heavymetals(Zn,Pb,Cd,Cu,As,Hg)was examined.During stable industrial experiments heavymetals of acidic wastewater are removed from 84.63~583.39 mg/L Zn2+,1.11~20.43 mg/L Pb2+,2.38~19.18 mg/L Cd2+,0.35~6.51 mg/L Cu2+,0.71~1.19 mg/L As2+,0.001 2~0.063 mg/L Hg2+to 0.12~0.83 mg/L Zn2+,0.18~0.46 mg/L Pb2+,0.008~0.046 mg/L Cd2+,0.12~0.19 mg/L Cu2+,0.005~0.009 mg/L As2+,0.000 12~0.002 2 mg/L Hg2+respectively,which are all lower than those required in“Emission standard of pollutants for lead and zinc industry”(GB 25466-2010).The whole process only needs to control a hydrolysis of pH 9,there is no need to adjust two-stage and three-stage of pH hydrolysis again with sulfuric acid or NaOH.The result shows that zinc in complexing sediment reaches 29.5%,the complexing sediment can be used asmetal raw material recovery of zinc smelting enterprises.
the acidic wastewate with heavymetal;biological agents;three-stage
X703
:A
:1003-5540(2014)05-0061-06
2014-05-29
张天芳(1983-),女,工程师,主要从事重金属污染防治研究工作。

