基于培养环境的混合状态进行增光处理的新型光发酵制氢工艺
邓明达
(3M中国有限公司,上海 200336)
基于培养环境的混合状态进行增光处理的新型光发酵制氢工艺
邓明达
(3M中国有限公司,上海 200336)
实验研究了不同培养环境的混合状态下光照强度对光合细菌生长和光发酵产氢的影响,提出静态培养和动态培养状态下的光饱和点分别为4000lux和6000lux。分析了Rhodobacter sphaeroides ZX-5培养环境中,光照强度随菌体细胞浓度及光传播距离增加而衰减的变化规律,得到了光在菌液传递过程中衰减的数学模型,即I=I0exp[-(0.4 814+0.2 991 OD660nm)·L]。首次提出了基于培养环境的混合状态进行增光处理的新型光发酵制氢策略,使得最大产氢速率达到161.7mlH2/lh。
生物制氢;球形红假单胞菌;光照强度;产氢速率
随着社会文明的不断进步和工业化程度的不断提高,人类对能源的需求日益增加,有限的化石能源已经不能满足世界各国对能源的需求。能源短缺,环境污染是人类未来面临的难题,寻找可再生的清洁能源已成为世界范围内能源界及其相关领域关注的焦点问题。化石燃料燃烧时生成CHx、COx、NOx、SOx、灰尘、烟雾、焦油等有机污染物,造成了严重的环境污染并使全球气候发生变化[1]。
生物制氢所用的原料是城市污水、生活垃圾、动物粪便等有机废物,通过发酵细菌或光合细菌的生物降解处理可以获得氢气,同时净化水质,达到保护环境的作用。因此,无论从环境保护,还是从新能源开发的角度来看,生物质制氢都具有很大的发展前途,它不仅能给人们提供清洁的能源,又能处理有机废物,保护环境,获得可观的经济效益,是一条可持续发展的道路[2-4]。生物制氢作为一种符合可持续发展战略的方向,已在世界上引起广泛重视,迄今为止,国际上已有的生物制氢方法有蓝细菌和绿藻光分解制氢[5]、体外酶合成制氢[6]、厌氧发酵产氢[7-11]、光发酵产氢[12-14]以及厌氧-光合细菌耦合发酵产氢[15-17]等多种。
光合细菌简称PSB(Photosynthetic Bacteria),是一群能在厌氧或好氧条件下,以光源作为能源分解有机物进行光合作用的细菌[18]。光合细菌制氢过程中,影响光合产氢的因素很多,主要有菌株特性、温度、光照条件、pH值、种龄、C源、N源以及与氢代谢相关的三种酶的酶活等因素,其中最大的问题就是光的转化效率。光在光生物反应器(Photobioreactor,PBR)内随着光程的增加光强急剧下降,光强在反应器内部的分布很不均匀;同时,有些底物在代谢过程中,往往会产生颜色变化,更进一步阻碍光的传递。另一方面,随着细胞的代谢生长,PBR内透光率随之下降,因此赖以光能的产氢效率会显著下降。这已成为PBR光合菌制氢研究中亟待解决的技术难题[19-21]。
本实验研究了光强对光合生物产氢的影响,模拟光在生物反应器中的传递,并通过静态培养和动态培养的比较,指出光合细菌光饱和点并非固定不变的,而是随着培养环境的混合状态和菌体生理条件的变化而改变的,同时确立了基于培养环境的混合状态进行增光处理的新型光发酵制氢策略,大大提高光合细菌的产氢速率。
1 材料与方法
1.1 菌种和培养条件
菌种:Rhodobacter sphaeroidesZX-5。
种子培养:将1ml种子甘油管倒入装有100mlRCVBN种子培养基[22]的250ml三角瓶中,pH=7±0.1,180rpm,30±1℃,遮光好氧培养,约20h接种于产氢培养基。
产氢培养:将1ml种子液加入装有34mlRCVBN产氢培养基的38ml光合反应器中,pH=7±0.1,30±1℃,光照厌氧培养,并采用60ml无菌注射器计量氢气产量。
1.2 光衰减动力学的测定
取一系列菌体浓度不同的培养液,注入比色皿中,并通过改变比色皿的个数模拟反应器中光程的增加,用光照度计测量光通过不同浓度的菌液时光强的衰减程度;入射光的初始光强为7 000lux。
1.3 实验器材与检测方法
光源为60W白炽灯;pH值测量采用FE20型实验室pH计(Mettler-Toledo仪器有限公司);生物量的测量以OD660nm表示,采用Spectrumlab22pc型分光光度计(上海棱光技术有限公司);光照度的测量采用ZDS-10自动量程照度计(上海市嘉定学联仪表厂);气体成分及氢气含量的测定采用尾气质谱分析仪(Extrel CMS Max 300-LG,USA);动态培养采用TS-1型脱色摇床(江苏海门市其林贝尔仪器制造有限公司)。
2 实验结果与讨论
2.1 光照强度对光合细菌生长和产氢性能的影响
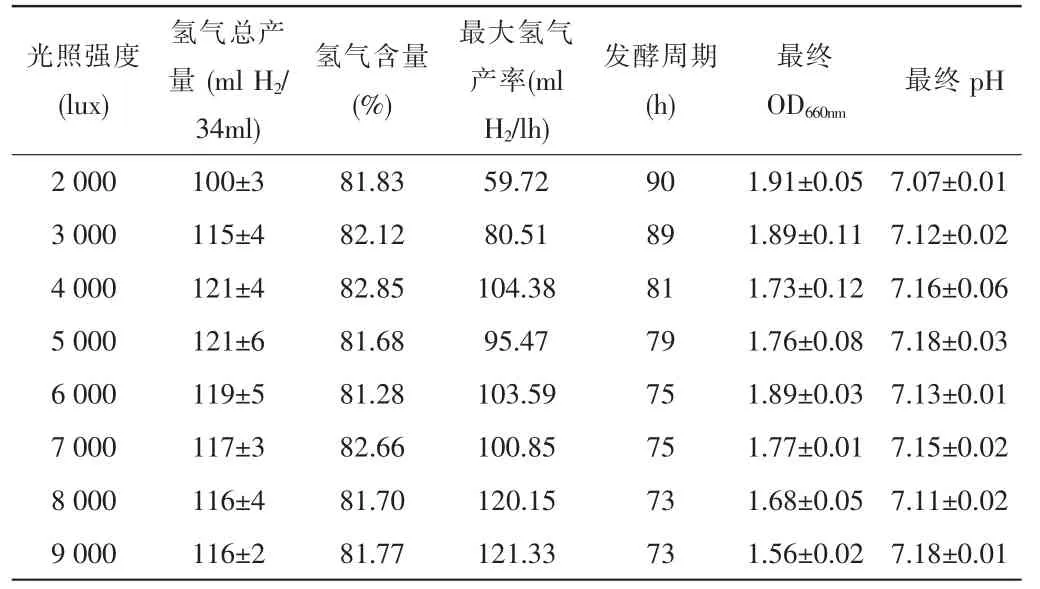
表1 -光照强度对光合细菌生长和产氢性能的影响
实验研究了不同光照强度(分别为2 000、3 000、4 000、5 000、6 000、7 000、8 000、9 000lux)对光合细菌产氢能力的影响。从表1可知,随着光照强度的增加,最大产氢速率逐渐增加,并且发酵周期由90h减少至73h,但pH几乎不随光强的变化而变化。另外,光强从2 000lux提高到4 000lux时,氢气的产量随之增加,当光强为4 000lux时产量最大,达到121mlH2/34ml culture medium;继续提高光强至9 000lux,氢气产量反而略有下降。
通过本实验说明Rhodobacter sphaeroidesZX-5的最适光强为4 000lux,此时已达到了“光饱和”现象。
2.2 光衰减动力学模型的建立
在光合细菌Rhodobacter sphaeroidesZX-5的光发酵体系中,以6 800lux为初始入射光光强,测量菌体浓度(以OD660nm表示)和光程距离的变化对光强在反应器内部分布的影响,结果见图1。从图1可以看出,在Rhodobacter sphaeroidesZX-5的光发酵体系中,随着菌体浓度和光程距离的增加,反应器内部的光照强度迅速衰减。这说明:在反应器内部的同一位置,光强是随着菌体浓度的增加而变化的。在光发酵初期,菌体细胞浓度较小,光衰减程度低,而到了光发酵后期,随着菌体细胞浓度的增加,菌体细胞的遮光作用增强,导致光衰减严重。
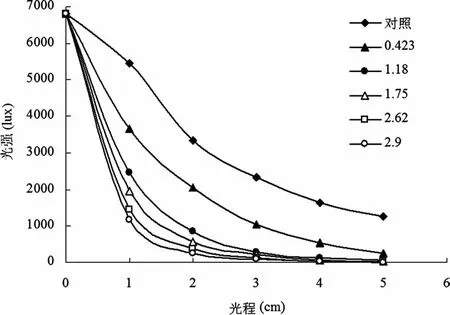
图1 光程距离和菌体浓度对光强衰减的影响
通过回归分析,可得到光照强度在Rhodobacter sphaeroides ZX-5光发酵体系中衰减的数学模型:

其中,I为某一光程距离上的实际光强(lux),I0为初始入射光强度(lux),L为光程距离(cm),OD660nm代表菌体细胞浓度。
光发酵体系中光衰减数学模型的建立,有助于我们模拟光强在反应器内部的分布,并据此对培养过程中对光照不足的位置进行增加光照处理。
2.3 培养环境的不同混合状态对光发酵产氢的影响
实验2.1采用动态培养的方式,在实验过程中,我们发现反应器底部有大量菌体沉淀的现象。因此,我们拟采用动态培养的方式将菌体细胞悬浮于培养体系中,从而使菌液混合更加均匀,同时通过动态培养使氢气析出迅速,尽量减少底物抑制,观察能否提高产氢速率。
根据实验2.1的结果,动态培养选在4000lux光强下进行,实验结果见表2。
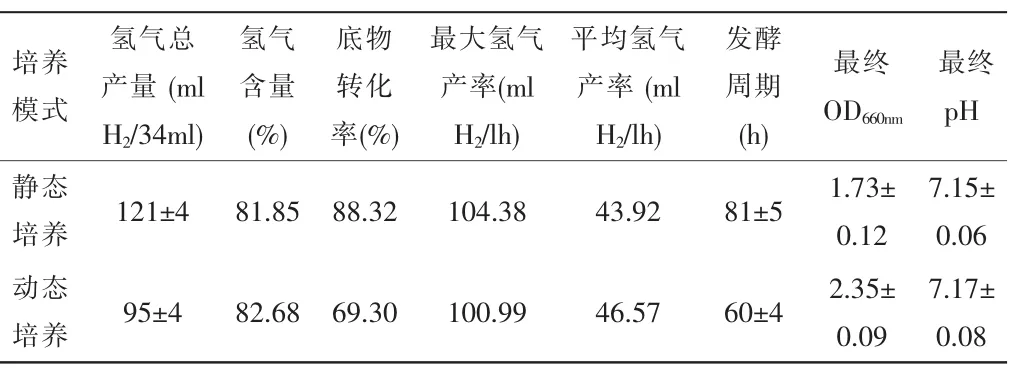
表2 -不同培养模式对光发酵产氢的影响
从表2可知,动态培养与静态培养相比,缩短了光发酵周期,但是底物转化率较低,仅为静态培养时的78.46%。因此,能否提高动态培养的底物转化率,则直接影响是否可以大幅度提高光发酵的产氢速率。
由图2可知:在光发酵过程中,动态培养从第8小时开始,菌体浓度(OD660nm)始终大于静态培养的菌体浓度(OD660nm),并且从第18小时开始,两个体系的菌体浓度(OD660nm)均趋于稳定,进入菌体生长的稳定期;另外,通过与图3比较,不管是动态培养还是静态培养,光发酵产氢过程均发生在菌体细胞生长的稳定期内。
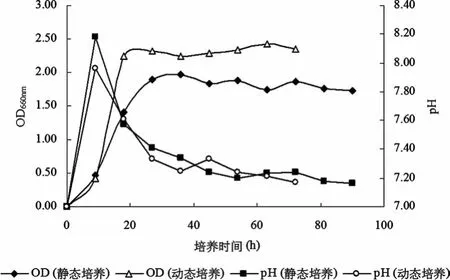
图2 静态培养与动态培养过程中OD660nm和pH的变化曲线
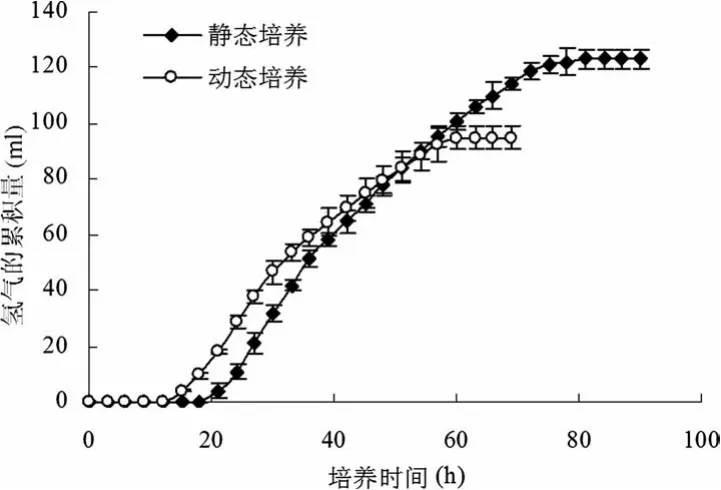
图3 静态培养与动态培养的光发酵产氢过程曲线
根据2.2得到的光衰减数学模型可知,OD660nm值大,意味着光在菌液传递的过程中衰减现象加剧。从而推断:可能是因为菌液中光强的不足,导致动态光发酵的底物转化率偏低。
拟设计增光实验,通过提高初始入射光光强,观察是否可以提高动态光发酵的底物转化率低,从而达到提高光发酵产氢速率的目的。
2.4 基于混合状态进行增光光发酵制氢工艺策略的确定
2.4.1 实验原理
根据2.2得到的光衰减数学模型进行估算:
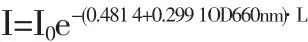
假设初始入射光为4 000lux时,静态培养结束时OD660nm为1.73,动态培养结束时OD660nm为2.35,见表2。又因为从18小时开始,两个体系的ODv值均趋于稳定,见图2,所以假定发酵结束时的OD660nm等于产氢过程中的OD660nm。那么,相同光强在动态培养和静态培养时菌液中的分布,见表3。通过提高初始入射光的强度,使得光强在动态培养时菌液中的分布与静态培养时的相当或者优于静态培养的光照条件,观察能否提高振荡光发酵的底物转化率。
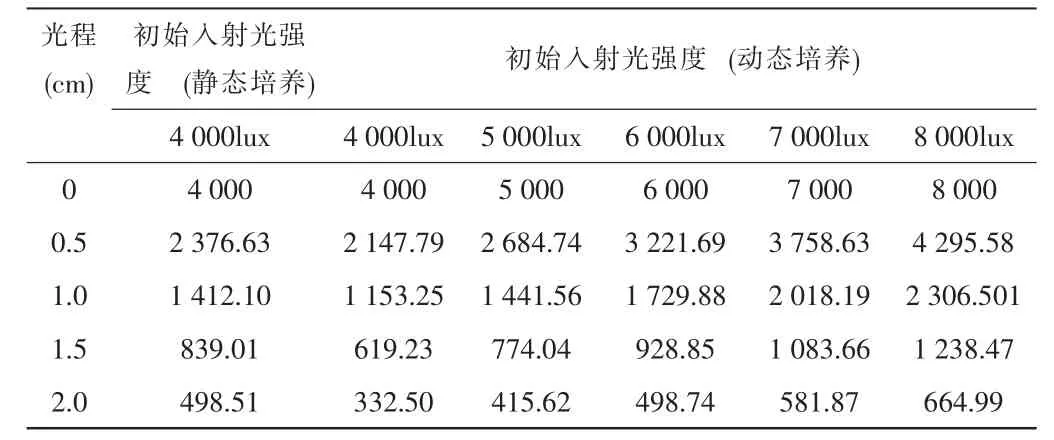
表3 不同混合状态及初始入射光强度对发酵液中光强分布的影响
与静态培养相比,初始入射光光强同样为4 000lux时,在动态培养条件下的衰减要严重的多;当把动态培养条件下的初始入射光光强提高至6 000lux时,在光程2cm处,光强度几乎与静置发酵时一致,而在反应器内部则优于静态培养内部的光强分布;继续将光强提高到7 000lux~8 000lux时,其在反应器内部的光强分布则远远优于入射光为4 000lux时的静态培养内部的光强分布(表3)。
2.4.2 实验结果
由实验结果表4可知,通过增加入射光光强,动态培养的氢气产量上升,OD660nm下降,说明反应器内部光照强度不足是导致动态培养发酵底物转化率低的原因之一。
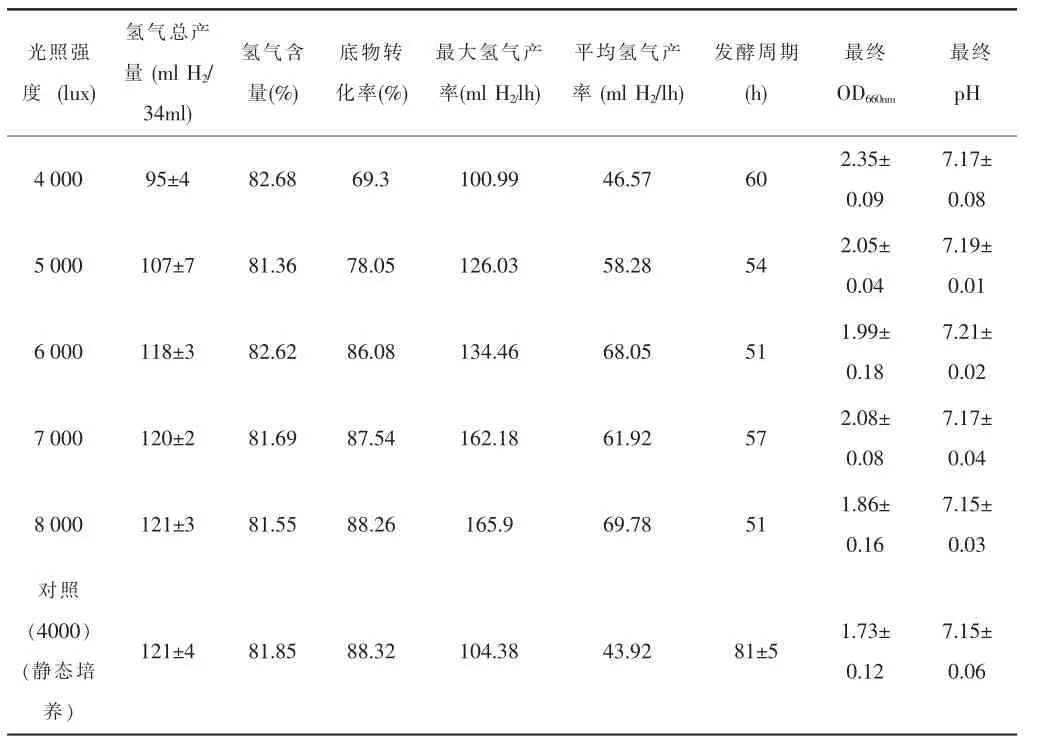
表4 不同培养模式及不同初始入射光强度对光发酵产氢的影响

图4 动态培养模式下,不同初始入射光强度对底物转化率和菌体生长(以OD660nm表示)的影响
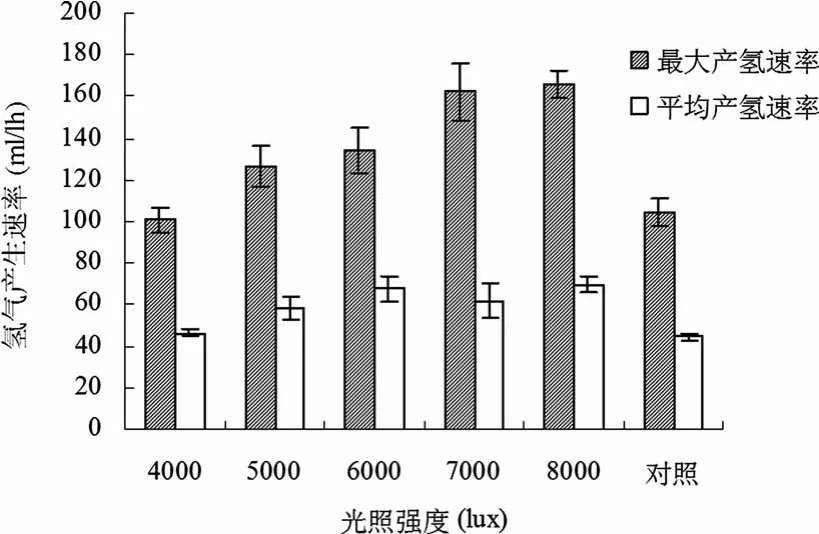
图5 动态培养模式下,不同初始入射光强度对最大产氢速率和平均产氢速率的影响
由图4知,光强从4 000lux增加到8 000lux过程中,OD660nm却从2.35下降到1.86,与静态培养的OD非常接近,而光强的增加则对pH影响不大,基本维持稳定在pH:7.18±0.03。另外,随着光强的增加,氢气的产量逐渐增加。但是当光强达到6 000lux时,再增加光强,动态培养的氢气产量不再增加,几乎维持恒定,说明光强6 000lux为动态光发酵条件下的光饱和点,这与静态培养时400lux为光饱和点是不一致的。通过该实验可以得出:光合细菌的光饱和点是随着外部环境条件的变化而发生变化的,并非固定不变的。
由图5知:通过光强的增加,动态培养的发酵周期缩短,氢气得率提高,进而使得平均产氢反应速率和最大产氢速率均得到大幅度的提高。
3 实验结论和研究趋势
3.1 实验结论
本文研究了不同光照强度对光合细菌产氢的影响,确定了3 000lux为静态培养条件下的最佳光照强度;同时模拟了光在菌液中的衰减情况,建立了光衰减动力学数学模型;实验提出了基于培养环境的混合状态进行增光处理的新型光发酵制氢工艺,提高了光发酵的最大产氢速率。
3.2 研究趋势
为了提高产氢速率和产氢量,光合细菌制氢系统目前还存在以下3个制约因素:(1)生物培养设备的太阳能转化效率;(2) H2合成过程;(3)生物反应器的设计和成本。
由于光合微生物制氢过程存在的厌养、光转化率低、连续高效率产氢时间短等问题,因此,在深入进行产氢生化机制研究,高产菌株选育的同时,应着重以下几个方面的研究:
(1)充分利用光合微生物及其它微生物的多样性和互助性,采用共培养或分步培养技术,利用微生物菌群制氢,解决酶抑制,利用基质种类单一,有机物转化利用率低等问题。
(2)深入进行光能吸收、转化和利用方面的研究,用光谱耦合,光有效导入和控制等技术提高光转化效率。
(3)开展多种原料利用研究,进行不同原料下高产菌株的选育,及其影响因素研究,最佳工艺研究,注重利用污染源为原料的产氢技术研究。
(4)光合生物反应器的研究。由于光合微生物产氢效率的高低与太阳光利用转化率有直接的联系,因此反应器结构研究、光照控制系统的研究也是制氢技术的重要课题。
[1]Bockris JO’M.The origin of ideas on hydrogen economy and its solution to the decay of the environment[J].Int J Hydrogen Energy, 2002,27:73l-740.
[2]DunnS.Hydrogenfutures:towardasustainableenergy system[J].Int J Hydrogen Energy,2002,27:235-264.
[3]傅秀梅,王亚楠,王长云,鹿守本,管华诗.生物制氢——能源、资源、环境与经济可持续发展策略[J].中国生物工程杂志, 2007,2007(2):119-125.
[4]肖建民.论氢能源与氢能源系统[J].世界科技研究与进展,1997,19(1):82-86.
[5]MelisA.Greenalgahydrogenproduction:progress, challenges and prospects[J].Int J Hydrogen Energy,2002,27:1217-1228.
[6]李永峰,任南琪,胡立杰,史英.生物制氢系统及其产氢机制[J].能源环境保护,2005,19(2):5-7.
[7]Lin CY,Lay CH.A nutrient formulation for fermentative hydrogen production using anaerobic sewage sludge microflora[J].Int J Hydrogen Energy,2005,30:285-292.
[8]Zhang YF,Shen JQ.Effect of temperature and iron concentration on the growth and hydrogen production of mixed bacteria[J].Int J Hydrogen Energy,2006,31:441-446.
[9]Hawkes FR,Dinsdale R,Hawkes DL,Huss I.Sustainable fermentativehydrogenproduction:challengesforprocess optimization[J].Int J Hydrogen Energy,2002,27:1339-1347.
[10]Li XZ,Wu JS,Sun DL.Hydrogen sulphide and volatile fatty acid removal from foul air in a fibrous bed bioreactor[J].Water Sci Technol,1998,38:323-329.
[11]N.Q.Ren,H.Chua,S.Y.Chan,etc.Assessingoptimal fermentation type for bio-hydrogen production in continuous-flow acidogenic reactors[J].Bioresource Technol,2007,98,1774-1780.
[12]Toshihiko Kondo,Tatsuki Wakayamab,Jun Miyakeb. Efficient hydrogen production using a multi-layered photobioreactor and a photosynthetic bacterium mutant with reduced pigment[J].Int J Hydrogen Energy,2006,31:1522-1526.
[13]E.Nakada,S.Nishikata,Y.Asada,J.Miyake. Photosynthetic bacterial hydrogen production combined with a fuel cell[J].Int J Hydrogen Energy,1999,24:1053-1057.
[14]YongzhenTao,YanlingHe,YongqiangWu,etal. Characteristics of a new photosynthetic bacterial strain for hydrogen production and its application in wastewater treatment[J].Int J Hydrogen Energy,2008,33:963-973.
[15]李冬敏,陈洪章,李佐虎.生物制氢技术的研究进展[J].生物技术通报,2003,4:1-5.
[16]Yongzhen Tao,Yang Chen,Yongqiang Wu,etc.High hydrogen yield from a two-step process of dark-and photofermentation of sucrose[J].Int J Hydrogen Energy,2007,32:200-206.
[17]Mark D.Redwood,Lynne E.Macaskie.A two-stage,twoorganism process for biohydrogen from glucose[J].Int J Hydrogen Energy,2006,31:1514-1521.
[18]Asada Y,Ikenaka K.Photobiological hydrogen production [J].J Biosci Bioeng,1999,88:1-6.
[19]王昶,贾士儒,贾庆竹,马少娜.光合生物制氢技术[J].生物加工过程,2005,3(4):9-13.
[20]Eiju Nakada,Yasuo Asada,Takaaki Arai,Jun Miyake. Light Penetration into Cell Suspensions of Photosynthetic Bacteria and Relation to Hydrogen Production[J].J Ferment Bioeng,1995,80 (1):53-57.
X505
A
1003-5168(2014)04-0167-04

