KCa3.1通道抑制剂TRAM-34对TGF-β1诱导系膜细胞增生的影响
付荣国,陈 钊,张 涛,马立群,杜 燕,吴喜利,田李芳,侯静静,刘晓丹,安 鹏,姚纲练
(1.西安交通大学医学院第二附属医院肾病内科,陕西西安 710004;2.西安交通大学医学院,陕西西安 710061;3.西安交通大学医学院第二附属医院中医科,陕西西安 710004;4.西安交通大学医学院第二附属医院干部病房,陕西西安 710004)
慢性肾脏疾病每年以10%的速度在进展。美国肾脏病患者总数已经超过2 000万,医院每年收治肾脏病患者高达100多万。我国目前尚无具体的慢性肾脏病流行病学调查数据,但初步结果显示,40岁以上人群慢性肾脏病的患病率为10%左右。这给社会和家庭造成巨大的的经济负担,迫切需要寻找能够防治慢性肾脏疾病进展的方法或技术。中电导钙激活钾离子通道KCa3.1(intermediate conductance Ca2+-activated K+-channel,IK/KCa3.1/KCNN4)是1997年ISHII等[1]从人胰腺组织中克隆出的一种钾离子通道,属于中电导钙激活钾离子通道和KCNN4基因家族。目前研究发现,其在红细胞[2-3]、T淋巴细胞[4]、肺脏上皮细胞[5]和树突状细胞[6]、血管内皮细胞[7]、肾小管上皮细胞、系膜细胞和成纤维细胞等均有表达[8-10]。抑制KCa3.1通道,可以减少角膜纤维化[10]、抑制肿瘤细胞[11]和血管平滑肌细胞增殖[12]。KCa3.1参与肾囊肿的形成[13],在单侧输尿管结扎(UUO)大鼠中可以加重肾间质纤维化的发展,敲除或抑制KCa3.1通道可以减少肾脏成纤维细胞增殖,从而减少肾间质纤维化的发生[14]。本实验首次研究KCa3.1通道特异性阻滞剂TRAM-34对TGF-β1诱导的大鼠系膜细胞增生的抑制作用,间接证明KCa3.1可能参与了TGF-β1诱导的肾小球硬化的发生发展过程。
1材料与方法
1.1材料与试剂系膜细胞株(HBZY-1,中国科学院上海生科院细胞资源中心);DMEM(Gibco);MTT(Amresco);DMSO(美国Sigma);Recombinant Human TGF-β1(Lot#0506S354,上海希美生物科技有限公司);TRAM-34(Biomol,product No.BML-KC161-0005);6孔板和96孔板(Nunc);酶标仪(BIO-RAD 680,美国伯乐);碘化丙啶(PI,蓝博斯特生物技术有限公司);RNase(北京柏莱斯特科技发展有限公司);BD FACSCantoⅡ(美国);RT-PCR扩增反应试剂盒(天根生化科技有限公司)。
1.2细胞培养及分组HBZY-1细胞在含有200 mL/L胎牛血清的DMEM中培养,取对数生长期的细胞,按1×106个/mL接种于培养皿内,置于37 ℃、50 mL/L CO2孵育箱中继续培养24 h后分组。TGF-β1的浓度根据预实验和文献资料确定为2 ng/mL。配制2 ng/mL TGF-β1储备液,加入抑制剂TRAM-34,使在含有2 ng/mL刺激因子TGF-β1的条件下,TRAM-34的终浓度分别为0、8、16、24 nmol/L。细胞给药分组,即Control组(空白对照组)、TGF-β1+TRAM-34组(共4组,各组TRAM-34浓度分别为0、8、16、24 nmol/L)。各组细胞给药培养24 h后分别进行流式细胞仪检测和MTT实验。
1.3流式细胞仪检测细胞周期的变化细胞按1.2分组给药培养24 h后,2.5 g/L胰酶消化细胞,收集细胞悬液,1 000 r/min离心7 min,用PBS清洗1遍,弃上清。加入700 mL/L乙醇1 mL固定细胞,轻轻混匀,4 ℃放置1~2 h。细胞悬液1 500 r/min离心5 min,弃上清,PBS清洗,1 500 r/min离心5 min,弃上清,加入RNase 100 μL,37 ℃孵育30 min。1 500 r/min离心5 min,弃上清后避光加入PI 400 μL。以标准程序用流式细胞仪检测,一般计数2~3万个细胞,结果用细胞周期拟合软件Modfit分析。
1.4MTT法检测TRAM-34对细胞增殖的抑制作用细胞按1.2分组给药,每孔加入200 μL,培养24 h后,吸弃旧培养液,每孔加入180 μL无血清培养液和MTT溶液20 μL(MTT终质量浓度为0.5 mg/mL),37 ℃继续孵育24 h,终止培养。吸弃孔内上清液每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解。在酶联免疫检测仪上选择490 nm波长测定各孔的吸光度A值,计算平均抑制率,公式为:平均抑制率=(对照组A值-实验组A值)/对照组A值。
1.5RT-PCR技术检测TRAM-34对系膜细胞α-SMA和FSP-1表达的影响将HBZY-1细胞传代并计数接种到细胞培养皿中,贴壁后,根据1.3和1.4实验结果确定TRAM-34最佳抑制浓度,分别作用0、15、30、60 min,采用RT-PCR分别检测系膜细胞α-SMA和FSP-1转录水平表达变化。用Trizol试剂提取各处理条件下的细胞总RNA,使用之前用紫外/可见分光光度计测定RNA的纯度和含量。cDNA合成过程按照TaKaRa公司反转录试剂盒(PrimeScriptⅡ 1st Strand cDNA Synthesis Kit)说明书步骤进行。RT-PCR扩增反应使用天根生化科技有限公司的RealMasterMix (SYBR Green)试剂盒进行定量,TaKaRa公司的RT-PCR仪进行实时检测,所有步骤均在冰上进行。PCR的反应条件为:初始变性(95 ℃,3 min);40个循环的变性(95 ℃,5 s);退火(58.5 ℃,10 s);延伸(72 ℃,20 s);最后延伸(72 ℃,10 min)。α-SMA和FSP-1的序列见表1。
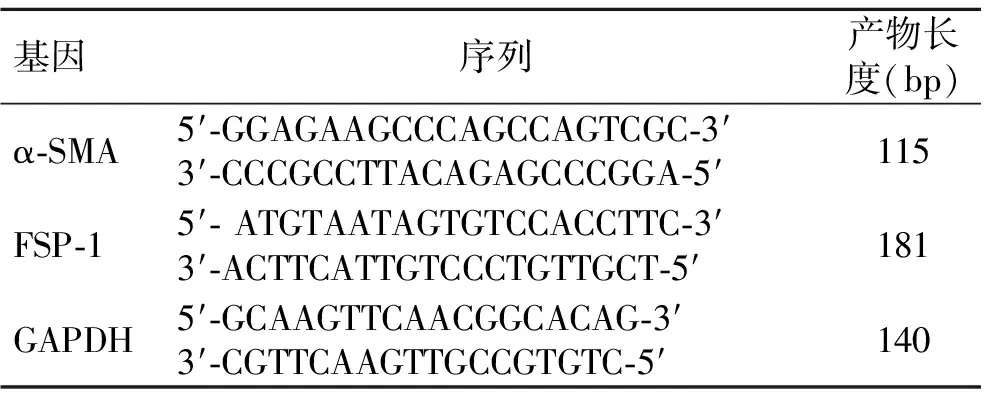
表1 α-SMA和FSP-1的mRNA序列及产物长度
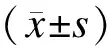
2结果
2.1TRAM-34对细胞周期的影响TGF-β1组(TRAM-34 0 nmol/L)经2 ng/mL TGF-β1刺激系膜细胞24 h,与空白对照组比较,细胞周期G0~G1期细胞百分比明显增高[(48.45±1.89)%、(70.29±1.84)%,P<0.01],而S期细胞百分比相应下降[(38.54±1.13)% 、(19.56±1.67)%,P<0.01];TGF-β1+TRAM-34(8、16、24 nmol/L)组系膜细胞G0~G1期百分比明显减少,S期百分比明显增多。与TGF-β1组比较,24 nmol/L TRAM-34组变化最明显[G0~G1期:(70.29±1.84)%、(61.90±1.88)%;S期:(19.56±1.67)% 、(25.52±1.62)%],差异有统计学意义(P<0.05)。
2.2TRAM-34对细胞增殖的影响各浓度TRAM-34对TGF-β1诱导系膜细胞增生均有抑制作用,其中24 nmol/L组抑制作用最显著,与8 nmol/L和16 nmol/L组比较,差异有统计学意义(P<0.01,图1)。
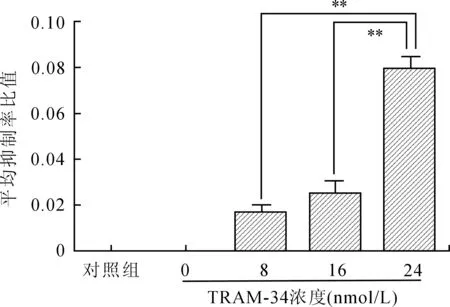
图1 不同浓度TRAM-34对系膜细胞增殖的影响
2.3TRAM-34对α-SMA和FSP-1表达的影响TRAM-34刺激系膜细胞30 min和60 min,与对照组(0 min)和15 min组相比,α-SMA的mRNA的表达水平明显下降;FSP-1的mRNA表达水平在TRAM-34刺激系膜细胞60 min显著下降(图2)。
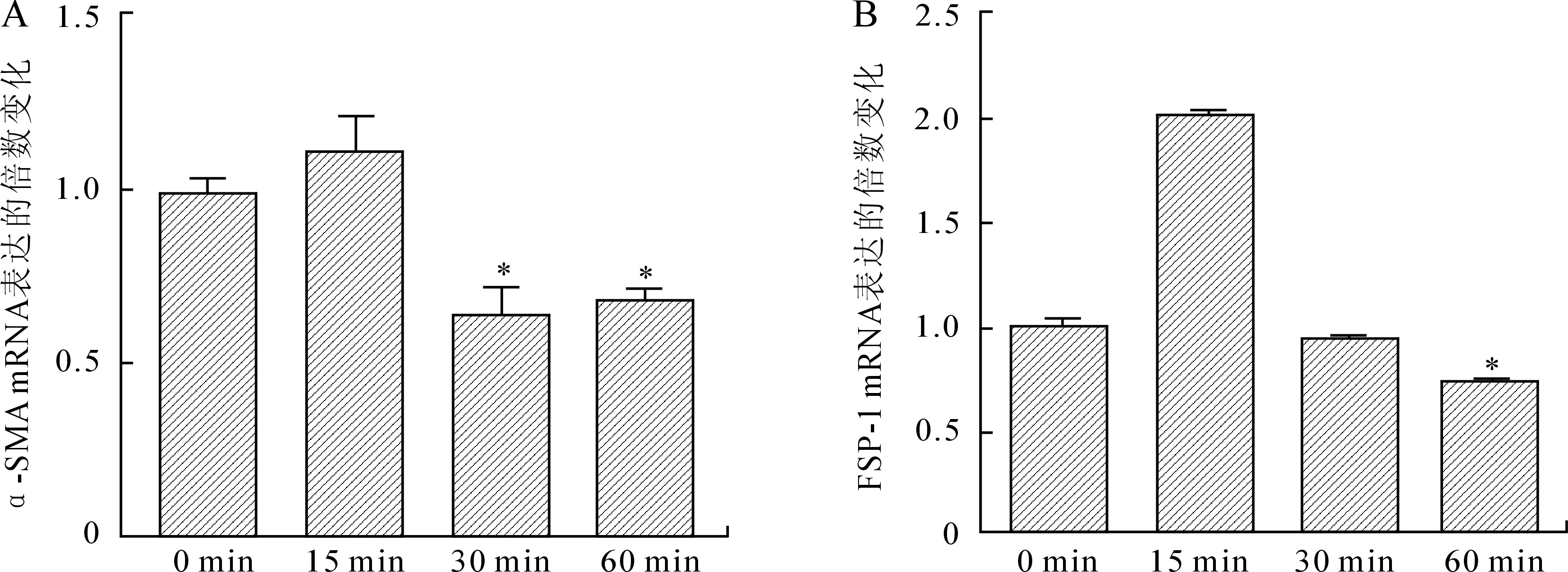
图2 TRAM-34对系膜细胞α-SMA(A)和FSP-1(B)表达的影响
3讨论
最近研究发现,中电导钙激活钾离子通道KCa3.1参与肿瘤细胞收缩迁移和血管平滑肌细胞、肾脏成纤维细胞、肺脏上皮细胞的增生过程,抑制KCa3.1可以抑制肿瘤转移、血管硬化和心肌、肺脏、肾脏的纤维化[5,10-12,14-15]。系膜细胞上也有中电导钙激活钾离子通道[9]。本研究首次发现,KCa3.1通道特异性抑制剂TRAM-34可以明显改善系膜细胞周期,使阻滞于G0~G1期的细胞减少,S期细胞的比例增加,间接提示KCa3.1通道参与了TGF-β1诱导的系膜细胞增生。
TRAM-34是中电导钙激活钾离子通道KCa3.1的特异性抑制剂,是一种高度亲脂性、膜通透的三芳香基甲烷TRAM的类似物。TRAM在KCa3.1通道上的结合位点分别为pore region第250位的苏氨酸(简称Thr250)和S6跨膜域第275位的缬氨酸(简称Val275)。文献报道,TRAM-34在作用后90 min以内就可被胞质膜完全内吞,然后与位于细胞内膜的KCa3.1通道上的Thr250和Val275结合,Thr250和Val275在疏水孔道内沿K+选择“滤过器”“GYG”线性排列,Thr250和Val275侧链上的甲基能与TRAM苯环周围的π-电子云通过疏水键紧密结合,从而锁住TRAM[16]。于是,TRAM芳香环的一半遮盖住了“GYG”,由此阻挡了K+内流的途径[17]。而K+内流的减弱钳制膜电位的去极化,使Ca2+的内流随之减弱,并导致相应的细胞活动受到抑制。本实验采用不同浓度TRAM-34作用于TGF-β1诱导增生的系膜细胞,发现TRAM-34的3个浓度组中阻滞于G0~G1期的系膜细胞周期有明显改善,表现为G0~G1期细胞百分比下降,S期细胞百分比增加,与对照组和TGF-β1组相比,差异有统计学意义,提示TRAM-34对TGF-β1诱导的系膜细胞增生具有抑制作用。细胞增生时细胞体积增大,表型转分化,许多细胞出现早衰并由此进入早期凋亡。TRAM-34改善细胞周期,使阻滞于G0~G1期的增生和转分化的系膜细胞进入S期,有助于改善细胞的增生与表型转分化,减少早衰。在MTT实验中也可以得到类似的结果,不同浓度的TRAM-34对细胞增生具有抑制作用,其中24 nmol/L的TRAM-34抑制作用最大。
系膜细胞是肾脏中数量最多的固有细胞之一,具有吞噬、分泌、收缩和迁移等重要特性。在IgA肾病、狼疮性肾炎、局灶阶段性肾小球硬化、膜增生性肾小球肾炎等肾脏疾病的进展中,产生一系列以系膜病变为主要病理变化的肾小球疾病。任何一种肾小球疾病在不同时期内都可见肾小球系膜病变[18]。α-SMA和FSP-1是细胞表型转分化的标志性抗原[19]。FSP-1是一种钙结合蛋白,又称S100A4,它是S100基因家族成员,也是细胞骨架蛋白之一,与微管动力学、细胞支架、信号传递、细胞周期调节、细胞生长和分化紧密相关。在正常系膜细胞、小管细胞和内皮细胞均不能检测到FSP-1,而在成纤维细胞和纤维化的肾脏能检测到其强烈表达[20]。本实验采用24 nmol/L的TRAM-34可以抑制KCa3.1通道的表达,降低α-SMA和FSP-1表达,并呈时间依赖性。提示TRAM-34可以通过抑制KCa3.1通道,改善细胞表型转分化、减少肾脏系膜细胞早衰的作用。进一步观察TRAM-34对细胞胶原产生及相关信号通路的影响,将对肾小球硬化的防治提供有益帮助。
参考文献:
[1] ISHII TM, SILVIA C, HIRSCHBERG B, et al. A human intermediate conductance calcium-activated potassium channel[J]. Proc Natl Acad Sci USA, 1997, 94(21):11651-11656.
[2] VANDORPE DH, SHMUKLER BE, JIANG L, et al. cDNA cloning and functional characterization of the mouse Ca2+-gated K+Channel, mIK1. Roles in regulatory volume decrease and erythroid differentiation[J]. J Biol Chem, 1998, 273(34):21542-21553.
[3] DYRDA A, CYTLAK U, CIURASZKIEWICZ A, et al. Local membrane deformations activate Ca2+-dependent K+and anionic currents in intact human red blood cells[J]. PLoS One, 2010, 5(2):e9447:1-14.
[4] KURAS Z, YUN YH, CHIMOTE AA, et al. KCa3.1 and TRPM7 channels at the uropod regulate migration of activated human T cells[J]. PLoS One, 2012, 7(8):e43859:1-16.
[5] TRINH NT, PRIVE A, MAILLE E, et al. EGF and K+Channel activity control normal and cystic fibrosis bronchial epithelia repair[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 295(5):866-880.
[6] SHAO Z, MAKINDE TO, AGRAWAL DK. Calcium-activated Potassium Channel KCa3.1 in lung dendritic cell migration[J]. Am J Respir Cell Mol Biol, 2011, 45(5):962-968.
[7] KÖHLER R, RUTH P. Endothelial dysfunction and blood pressure alterations in K+-channel transgenic mice[J]. Pflugers Arch, 2010, 459(6):969-976.
[8] 赵宏贤,郭勇,陈霞. 粉防己碱(Tet)对MDCK细胞钙激活钾通道(KCa)的影响[J]. 四川解剖学杂志,2005,13(4):11-14.
[9] MA R, PLUZNICK JL, SANSOM SC. Ion channels in mesangial cells: function, malfunction, or fiction[J]. Physiology, 2005, 20(2):102-111.
[10] YANG H, LI X, MA J, et al. Blockade of the intermediate-conductance Ca2+-activated K+Channel inhibits the angiogenesis induced by epidermal growth factor in the treatment of corneal alkali burn[J]. Exp Eye Res, 2013, 110: 76-87.
[11] SCHMIDT J, FRIEBEL K, SCHÖNHERR R, et al. Migration-associated secretion of melanoma inhibitory activity at the cell rear is supported by KCa3.1 Potassium channels[J]. Cell Res, 2010, 20(11):1224-1238.
[12] THARP DL, WAMHOFF BR, WULFF H, et al. Local delivery of the KCa3.1 blocker, TRAM-34, prevents acute angioplasty-induced coronary smooth muscle phenotypic modulation and limits stenosis[J]. Arterioscler Thromb Vasc Biol, 2008, 28(6):1084-1089.
[13] ALBAQUMI M, SRIVASTAVA S, LI Z, et al. KCa3.1 Potassium channels are critical for cAMP-dependent chloride secretion and cyst growth in autosomal-dominant polycystic kidney disease[J]. Kidney Int, 2008, 74(6):740-749.
[14] GRGIC I, KISS E, KAISTHA BP, et al. Renal fibrosis is attenuated by targeted disruption of KCa3.1 potassium channels[J]. Proc Natl Acad Sci USA, 2009, 106(34):14518-14523.
[15] ZHAO LM, ZHANG W, WANG LP, et al. Advanced glycation endproducts promote myocardial fibrosis by upregulation of Kca3.1 channel[J]. Pflugers Arch, 2012, 464:613-621.
[16] BALUT CM, GAO Y, LUKE C, et al. Immunofluorescence-based assay to identify modulators of the number of plasma membrane KCa3.1 channels[J]. Future Med Chem, 2010, 2(5):707-713.
[17] WULFF H, GUTMAN GA, CAHALAN MD, et al. Delineation of the clotrimazole/TRAM-34 binding site on the intermediate conductance calcium-activated potassium channel, IKCa1[J]. J Biol Chem, 2001, 276(34):32040-32045.
[18] 黎磊石,刘志红. 中国肾脏病学[M]. 北京:人民军医出版社,2008:321-325.
[19] STEPHENSON LA, HANEY LB, HUSSAINI IM, et al. Regulation of smooth muscle alpha-actin expression and hypertrophy in cultured mesangial cells[J]. Kidney Int, 1998, 54(4):1175-1187.
[20] NISHITANI Y, IWANO M, YAMAGUCHI Y, et al. Fibroblast-specific protein 1 is a specific prognostic marker for renal survival in patients with IgAN[J]. Kidney Int, 2005, 68(3):1078-1085.

