大鼠海马组织RNA、DNA和蛋白质共提取方法的研究
胡丽丽,赵小鸽,倪 磊,王爱英,杨 娟,
(西安交通大学医学院:1. 遗传学与分子生物学系;2.环境与疾病相关基因教育部重点实验室、生物医学基础研究中心, 陕西西安 710061)
各种动物模型建立后,研究人员通常期望能够从DNA、RNA以及蛋白质水平对某一特定的组织或部位进行深入的研究。 但是,所研究的动物具有个体差异性,采用不同的动物分别进行DNA、RNA以及蛋白质3个水平的研究极有可能出现实验结果的不一致性;其次,所研究的特定部位通常具有不可分割性,或者动物的组织材料量较少,不足以分别进行DNA、RNA以及蛋白质3种物质的提取。因此,如果同时从某一特定的组织或部位提取DNA、RNA以及蛋白质这3种物质进行后续检验分析,将提高实验结果的一致性和准确性。
海马区又名海马回、海马体或大脑海马,是位于脑颞叶内的一个部位的名称。人有两个海马,分别位于左右脑半球。海马属于大脑边缘系统的组成部分,与学习记忆密切相关[1-2];其参与调节衰老引起的自主神经系统、免疫系统和神经内分泌系统的活动[3];也是大脑中与抑郁症密切相关的结构之一[4]。此外,在各种应激模型中,海马与HPA轴及糖皮质激素密切关联[5-6]。
本研究以单侧海马组织为材料采用Trizol法,分别从上层水相、中间相和有机相中制备总RNA、基因组DNA 和总蛋白质。通过聚合酶链式反应(PCR)对Trizol法提取海马基因组DNA的效果和试剂盒提取效果进行比较,采用蛋白免疫印迹(Western blot)法将Trizol法对海马蛋白的提取效果和传统的蛋白裂解液裂解法进行比较,分析Trizol法的优势。
1材料与方法
1.1实验动物成年雄性Sprague-Dawley大鼠8只,由西安交通大学医学院实验动物中心提供。
1.2主要试剂及仪器Trizol试剂(Invitrogen公司);RIPA裂解液;逆转录试剂盒Primescript RT reagent kit(TaKaRa公司);SYBR Premix EXTaqⅡ(TaKaRa公司);DNA提取试剂盒(BioTeke 公司);PremixTaqTM(TaKaRa公司);抗β-actin抗体(博奥森);GR抗体(Santa Cruz Biotechnology)。凝胶成像系统(上海培清科技有限公司);PCR热循环仪(Biometra Thermocycler);实时定量PCR仪(Bio-Rad)。引物由上海生工公司合成,β-actin引物[7]:上游:5′-CTATCGGCAATGAGCGGTTC-3′,下游:5′-GATCTTGATCTTCATGGTGCTAGG-3′,PCR产物长242 bp;Nr3c1引物:上游:5′-AGGCAGTGTGAAATTGTATCCCAC-3′,下游:5′-GAGGCTTACAATCCTCATTCGTGT-3′,PCR产物长206 bp。
1.3大鼠海马组织的取材与保存用40 mL/L水合氯醛麻醉SD大鼠,在低温环境下快速断头取脑,冰上分离海马组织。将左右两侧海马均放入冻存管中,液氮速冻后放入-80 ℃低温冰箱备用。
1.4Trizol法同时提取大鼠海马组织RNA、DNA和蛋白质
1.4.1提取大鼠海马组织RNA 将左侧海马从-80 ℃低温冰箱中取出,移入无菌无酶1.5 mL EP管中,加入100 μL Trizol,使用电动研磨器研磨海马组织15~30 s,加入900 μL Trizol。按照Trizol说明书操作步骤,室温放置5 min,冰上放置10 min(期间不时颠倒混匀),加入200 μL氯仿,剧烈震荡15 s,4 ℃ 12 000×g 离心10 min,小心取上层水相于一新的无菌无酶1.5 mL EP管中,中间层白膜和下层粉红色有机相保留。在上层水相中加0.5 mL异丙醇,混匀,室温放置15 min,4 ℃ 12 000×g 离心10 min,小心弃去上清,加入1 mL 750 mL/L无水乙醇,涡旋混匀,4 ℃ 7 500×g离心5 min。用1 mL 750 mL/L无水乙醇再次洗涤沉淀。小心弃去上清,然后室温干燥5 min,用40 μL DEPC水溶解RNA沉淀,用枪头反复吹打助溶。保存于-80 ℃低温冰箱中。
1.4.2提取大鼠海马组织DNA 按照Trizol说明书操作步骤,尽量移去RNA提取步骤中上层残留水相,加入0.3 mL无水乙醇,颠倒混匀,室温放置3 min,4 ℃、2 000×g离心5 min。移上清至一新EP管中(上清用做分离蛋白质,操作见后),加入1 mL 0.1 mol/L 柠檬酸钠洗涤DNA沉淀,室温放置30 min,其间轻轻颠倒混匀。4 ℃、2 000×g 离心5 min,弃上清,重复1次。室温放置5~10 min,用60 μL 8 mmol/L NaOH溶解DNA。保存于-20 ℃冰箱中。
1.4.3提取大鼠海马组织蛋白质 按照Trizol说明书关于蛋白质提取的操作步骤,加入1.5 mL异丙醇至DNA提取步骤中用做分离蛋白质的上清中,混匀,室温放置10 min,4 ℃、12 000×g离心10 min,弃上清。加2 mL 0.3 mol/L盐酸胍洗涤液,室温放置20 min,4 ℃、7 500×g离心5 min,弃上清,重复2次。加入2 mL无水乙醇使用同样方法再洗1次。室温干燥蛋白质沉淀10 min,加入80 μL 10 g/L SDS反复吹打溶解蛋白质。保存于-80 ℃低温冰箱中。
1.5试剂盒提取大鼠海马组织DNA采用细胞/组织DNA提取试剂盒(离心柱型),购自北京BioTeke公司,实验步骤参照试剂盒说明书。
1.6RIPA裂解液提取大鼠海马组织蛋白质将右侧海马从-80 ℃低温冰箱中取出,放入无菌研磨器内。在裂解液中加入适量PMSF(使用前数分钟加入),使PMSF的最终浓度为1 mmol/L。吸取混合液700 μL加入研磨器中,冰上充分研磨组织并静置1 h,4 ℃、14 000×g 离心15 min,取上清置于1.5 mL EP管中。保存于-80 ℃低温冰箱中。
1.7RNA质量的检测
1.7.1RNA的浓度、纯度鉴定 利用NanoDrop2000超微量分光光度计(ND2000)测定RNA在260 nm和280 nm处的吸光值,根据260 nm与280 nm吸光值的比值鉴定RNA纯度。
1.7.2SYBR实时定量RT-PCR法检测大鼠海马中β-actin和GR的表达 按照逆转录试剂盒使用说明配置反应体系,反转录反应条件为37 ℃ 15 min, 85 ℃ 5 s,获得的cDNA置于4 ℃。按照SYBR Premix EXTaqⅡ试剂盒使用说明配置反应体系,应用两步法进行PCR扩增。扩增条件为:预变性,95 ℃ 30 s;扩增反应,95 ℃ 5 s,60 ℃ 20 s,共40个循环;溶解曲线分析,95 ℃ 0 s, 65 ℃ 15 s, 95 ℃ 0 s。每个样品的每个基因设3个重复。
1.8DNA质量的检测
1.8.1DNA的浓度、纯度鉴定 同RNA浓度、纯度的鉴定。此外,同时对总DNA进行琼脂糖凝胶电泳。
1.8.2以Trizol法和试剂盒法提取的大鼠海马DNA为模板的PCR扩增 按照PremixTaqTM说明配置PCR反应体系,模板Trizol法和DNA提取试剂盒提取大鼠海马DNA,引物为β-actin和Nr3c1的上下游引物。扩增条件为:预变性,98 ℃ 5 min;扩增反应,98 ℃ 10 s, 55 ℃ 30 s;后延伸,72 ℃ 50 s;72 ℃ 5 min。
1.9Westernblot法比较Trizol法和RIPA试剂盒提取的大鼠海马蛋白质量蛋白定量后,各取30 μg上样,用SDS-PAGE凝胶进行电泳,具体条件为:80 V电压下电泳30 min,100 V电压下电泳1 h,用PVDF膜半干转膜2 h,50 g/L脱脂奶粉室温封闭2 h,加GR抗体或做内参的β-actin抗体(一抗),4 ℃孵育过夜,PBST洗膜3次,加HRP标记的羊抗兔IgG(二抗),室温下孵育2 h,PBST洗膜3次,加化学发光底物在化学发光系统中显示杂交印迹。
2结果
2.1RNA质量的检测结果
2.1.1RNA的质量浓度和纯度 经超微量分光光度计对RNA的浓度和纯度进行测定,8个样品的浓度、A260/A280和A260/A230的比值见表1。Trizol法提取单侧海马RNA的质量浓度介于1 178.3 ~2 225.8 ng/μL之间,A260/A280介于2.01~2.03,A260/A230介于1.88~2.22。以上结果表明,Trizol法提取单侧海马RNA的浓度和纯度较高且较为稳定。
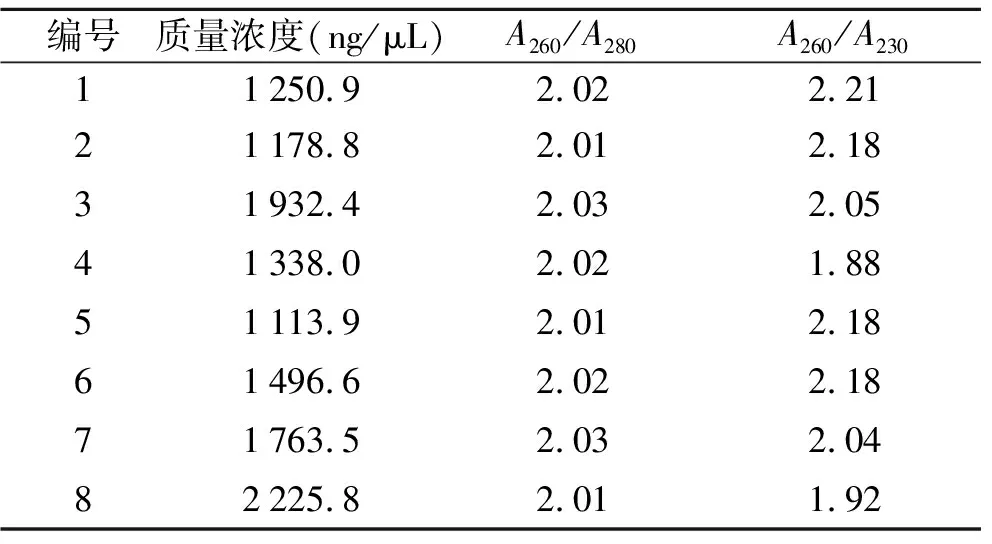
表1 Trizol法提取单侧海马组织RNA的质量浓度和纯度
2.1.2SYBR实时定量 RT-PCR检测海马组织中β-actin和GR mRNA的表达情况 通过荧光实时定量RT-PCR检测,获得了β-actin和GR的循环域值(CT值)(表2)。扩增曲线和溶解曲线提示扩增产物高效且为特异性扩增。
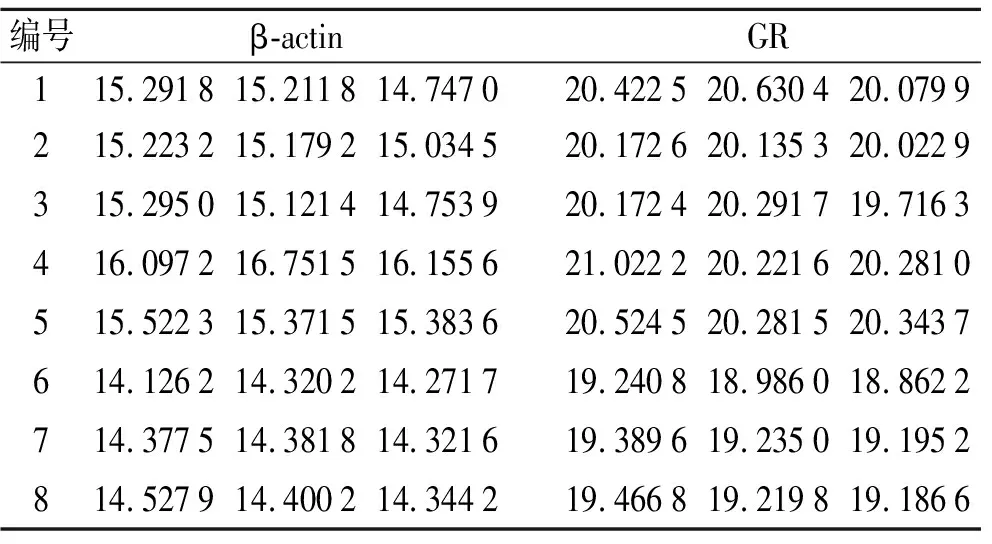
表2 β-actin和GR的循环域值
2.2DNA质量的检测结果
2.2.1DNA的质量浓度和纯度 经超微量分光光度计对Trizol法和试剂盒提取DNA的质量浓度和纯度进行的测定,8个样品的浓度(编号1~4为Trizol法,编号5~8为试剂盒法)、A260/280和A260/230的比值见表3。
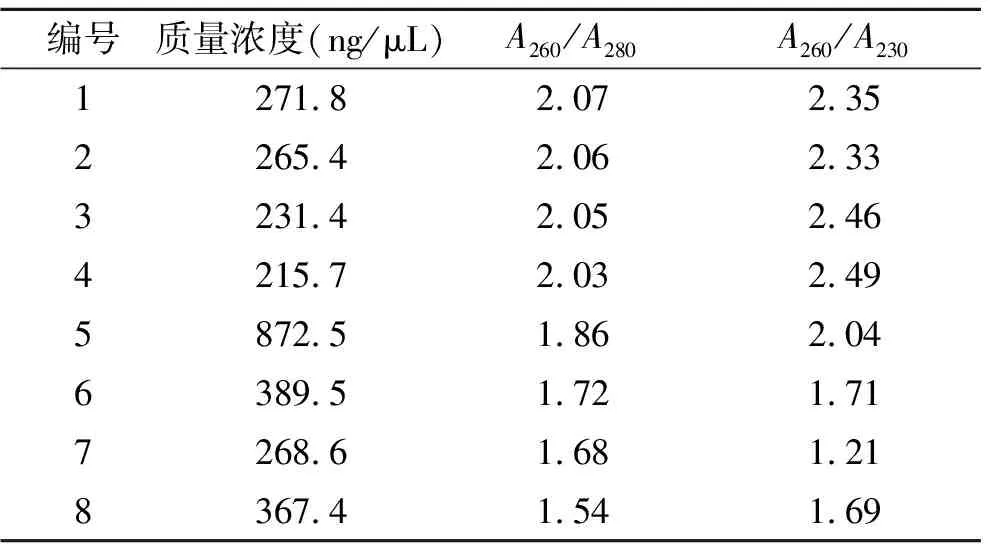
表3 两种方法提取单侧海马组织DNA质量浓度和纯度
1~4:Trizol法;4~8:试剂盒法。
Trizol法提取单侧海马的DNA的质量浓度介于215.7 ~271.8 ng/μL之间,A260/A280介于2.03~2.07,A260/A230介于2.33~2.49。试剂盒提取DNA的浓度和纯度处于268.6 ~872.5 ng/μL之间,A260/A280介于1.54~1.86,A260/A230介于1.21~2.04。对两种方法提取的总DNA各取10 μL进行琼脂糖凝胶电泳,比较结果发现,Trizol法提取的总DNA完整性均较好(图1)。对Trizol法和试剂盒提取DNA的浓度、A260/A280和A260/A230进行统计学分析(SPSS 16.0),结果表明两种方法的浓度不具有统计学差异(P>0.05),A260/A280和A260/A230具有统计学差异(P<0.01)。以上结果表明,Trizol法提取单侧海马DNA的浓度和纯度较高且较为稳定。
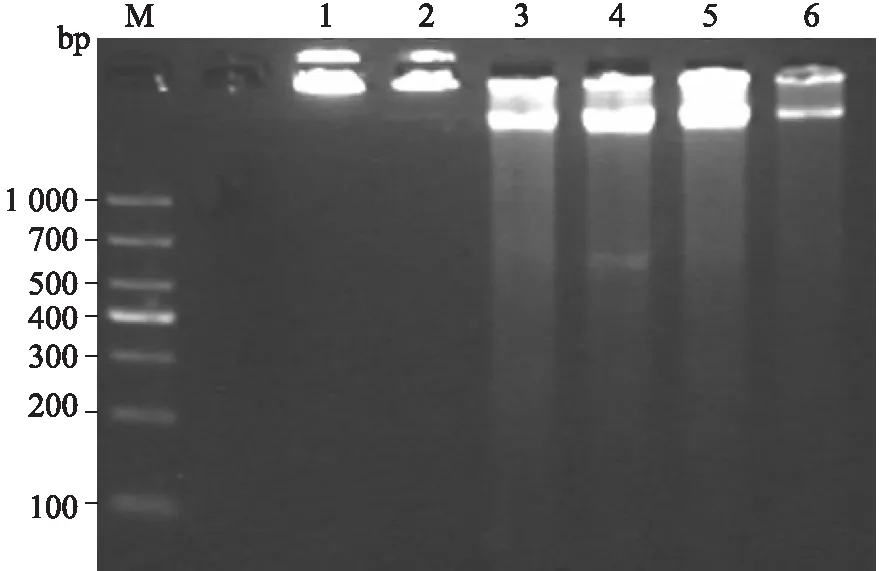
图1 Trizol和试剂盒法提取的总DNA琼脂糖凝胶电泳图
2.2.2Trizol法和试剂盒法所提取的大鼠海马组织DNA的PCR扩增结果 以上两种方法提取的基因组DNA为模板,经特定引物进行PCR扩增后发现,管家基因β-actin(242 bp)和糖皮质激素受体基因Nr3c1(206 bp)均有清晰的条带,未见非特异性扩增(图2、图3)。所以两种方法提取的基因组DNA均适于作为基因扩增的模板。
2.3Trizol法及RIPA试剂盒法提取的大鼠海马蛋白的Westernblot结果Trizol法和RIPA试剂盒提取大鼠海马蛋白在针对特异蛋白的抗体作用下,Western blot结果显示单一清晰的条带(图4)。由此可见,Trizol法和RIPA试剂盒提取大鼠海马蛋白质量差异不大,均适于采用Western blot法对目的蛋白进行检测。
3讨论
Trizol法适用于从细胞和组织中快速分离RNA。Trizol法有多组分分离作用,与其他方法如硫氰酸胍/酚法、酚/SDS法、盐酸胍法、硫氰酸胍法等相比,最大特点是可同时分离一个样品的RNA、DNA及蛋白质。Trizol法不仅可用于小量样品(50~100 mg 组织、5×106个细胞),也适用于大量样品(≥1 g组织、>107个细胞)。对人、动物、植物组织及细菌均适用,可同时处理大量不同样品,整个提取过程在1 h内即可完成。分离的总RNA无蛋白质和DNA污染,可用于 Northern Blot、dot blot、ployA筛选、体外翻译、RNase保护分析和分子克隆。在用于RT-PCR时如果2条引物存在于1个单一外显子内,建议用无RNase的 DNaseⅠ处理RNA样品,避免出现假阳性。共纯化的DNA可用作标准,比较不同样品RNA的得率,也可用于PCR和酶切。蛋白质可用于Western blotting实验[8-9]。

图2 两种方法提取的模板DNA的β-actin PCR扩增琼脂糖凝胶电泳图
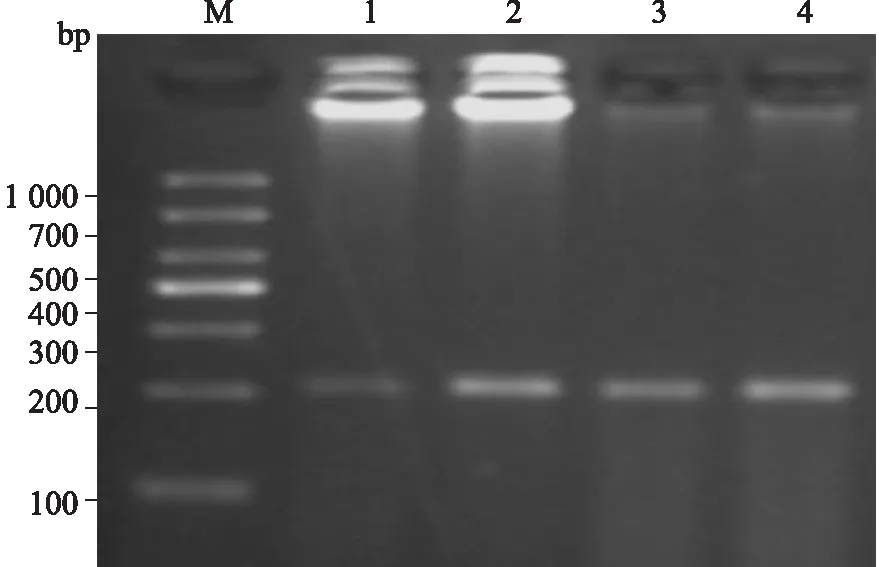
图3 两种方法提取的模板DNA的Nr3c1 PCR扩增结果琼脂糖凝胶电泳图
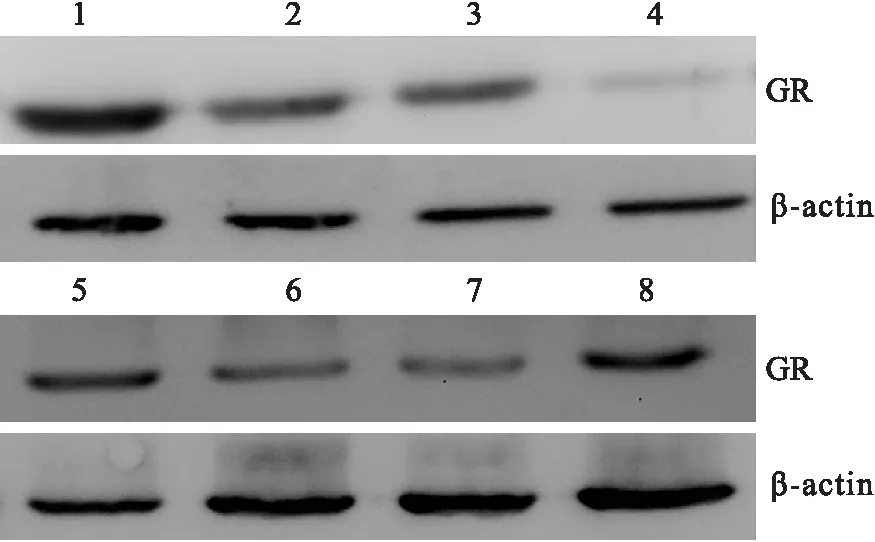
图4 Trizol法(1~4)和RIPA试剂盒(5~8)提取蛋白的Western blot结果
海马是涉及学习记忆能力实验的主要研究对象,且在应激动物模型中具有重要作用。近年来,对模型动物海马区的研究已经从形态学深入到分子、细胞、蛋白水平。因此,越来越多的研究需要从动物海马组织DNA、RNA以及蛋白质3方面来开展实验研究。而迄今为止,使用Trizol法从海马组织同时提取这3种物质的研究未见报道。本研究结果表明,Trizol法同时提取的大鼠单侧海马组织RNA 、DNA和蛋白质,与使用已市场化试剂盒从不同海马组织中分别提取的DNA和蛋白质在质量上无明显差异,并且均适合进行后续的PCR及Western blot实验。从同一单侧海马组织中同时提取得到的较高质量RNA 、DNA和蛋白质,使得RNA 、DNA和蛋白质3个水平的研究可以很好的保持同一性,减少了实验过程中不必要的干扰因素,优化了实验方案;同时减少了实验人员的劳动量,提高了工作效率,使实验动物的使用量减少至最低。目前,同时提取海马组织RNA 、DNA和蛋白质的文献较少,故Trizol法同时提取这3种物质为科研人员对海马组织的研究提供了更为合理和便利的条件。
参考文献:
[1] MILLER CA, SWEATT JD. Covalent modification of DNA regulates memory formation[J]. Neuron, 2007, 53(6):857-869.
[2] BOWMAN RE, BECK KD, LUINE VN. Chronic stress effects on memory: sex differences in performance and monoaminergic activity[J]. Horm Behav, 2003, 43(1):48-59.
[3] MCEWEN BS. Sex, stress and the hippocampus: allostasis, allostatic load and the aging process[J]. Neurobiol Aging, 2002, 23(9):921-939.
[4] QI X, LIN W, WANG D, et al. A role for the extracellular signal-regulated kinase signal pathway in depressive-like behavior[J]. Behav Brain Res, 2009, 199(5):203-209.
[5] ANDRUS BM, BLIZINSKY K, VEDELL PT, et al. Gene expression patterns in the hippocampus and amygdala of endogenous depression and chronic stress models[J]. Mol Psychiatr, 2012, 17(1):49-61.
[6] ROOZENDAAL B, GRIFFITH QK, BURANDAY J, et al. The hippocampus mediates glucocorticoid-induced impairment of spatial memory retrieval: dependence on the basolateral amygdala[J]. P Natl Acad Sci USA, 2003, 100(2): 1328-1333.
[7] XIAO L, CHEN Y. Culture condition and embryonic stage dependent silence of glucocorticoid receptor expression in hippocampal neurons[J]. J Steroid Biochem, 2008, 111(6):147-155.
[8] 汪军,金凯舟,王娟,等. 一种高效同时提取微量组织中总RNA、DNA和蛋白的技术方法的改进[J]. 肝胆胰外科杂志, 2012, 24(4):308-313.
[9] 董华,王军军,应天翼,等. 一种同时提取细胞总RNA和总蛋白的方法[J]. 生物技术通讯, 2005,16(6):649-650.

