乳腺浸润性导管癌微环境中CD4和CD8阳性T细胞表达与血管新生的关联性分析
拉 宗,王建霞,崔 倪,李明月,邢树刚,任 博,张丽红,李 伟,李玉林
(1.吉林大学基础医学院病理学系病理生物学教育部重点实验室,吉林长春 130021;2.西藏大学医学院病理学教研室,西藏拉萨 850000)
乳腺浸润性导管癌微环境中CD4和CD8阳性T细胞表达与血管新生的关联性分析
拉 宗1,2,王建霞1,崔 倪∗,李明月1,邢树刚1,任 博1,张丽红1,李 伟1,李玉林1
(1.吉林大学基础医学院病理学系病理生物学教育部重点实验室,吉林长春 130021;2.西藏大学医学院病理学教研室,西藏拉萨 850000)
目的:检测乳腺浸润性导管癌微环境中CD4及CD8阳性T淋巴细胞的表达,探讨其与乳腺癌间质微血管密度(MVD)的关系。方法:应用免疫组织化学SP法检测37例乳腺浸润性导管癌组织及10例癌旁组织中CD4、CD8及CD34的表达,并对其在癌及癌旁组织中的表达差异进行分析。采用Spearman相关性分析方法分析CD4、CD8及CD4与CD8阳性表达率的比值(CD4/CD8比值)与MVD的相关性。结果:CD4在乳腺浸润性导管癌组织中的阳性表达率为(22.63±11.53)%,低于癌旁组织[(34.09±10.41)%](P<0.05),随着乳腺癌组织学级别的升高,CD4阳性表达率逐渐降低(P<0.05)。CD8在乳腺浸润性导管癌组织中的阳性表达率为(14.27± 9.03)%,高于癌旁组织[(10.51±1.88)%],但差异无统计学意义(P>0.05),随着乳腺癌组织学级别的升高, CD8阳性表达率逐渐升高(P<0.01)。在癌旁组织及乳腺浸润性导管癌组织中CD4/CD8比值分别为3.24±1.02 和2.16±2.17,两者比较差异无统计学意义(P>0.05);随着乳腺癌组织学级别的升高CD4/CD8比值降低(P<0.01)。乳腺浸润性导管癌组织中的MVD值明显高于癌旁组织(P<0.05),并且随乳腺癌组织学级别的升高, MVD值呈递增趋势。相关性分析,MVD与CD4阳性表达率呈负相关关系(r=-1.000,P<0.001),与CD8阳性表达率呈正相关关系(r=0.984,P<0.001),与CD4/CD8比值呈负相关关系(r=-0.984,P<0.001)。结论:乳腺浸润性导管癌间质CD4阳性T淋巴细胞减少,CD8阳性T淋巴细胞增多,CD4/CD8比值下降,提示在乳腺癌微环境中T细胞处于免疫抑制状态。
乳腺肿瘤;T淋巴细胞;肿瘤血管新生;CD4;CD8
肿瘤微环境由肿瘤实质和间质两部分构成,肿瘤间质包括免疫细胞、炎症细胞、成纤维细胞和微血管等。肿瘤微环境中的组成成分在肿瘤的生长、浸润和转移等破坏机体正常组织过程中起着不可忽视的作用[1]。肿瘤从发生到转移的整个过程是肿瘤细胞与间质相互作用的结果。微环境中的免疫状态尤其是细胞介导的免疫反应能直接反应机体局部对肿瘤的反应状况[2-3]。有文献[4]报道:一些恶性肿瘤微环境中免疫细胞及其分泌的相关因子参与肿瘤生长侵袭的调节,恶性肿瘤微环境中的免疫细胞与肿瘤间质血管新生也存在相互作用关系。综合分析肿瘤微环境中肿瘤细胞、肿瘤浸润淋巴细胞以及肿瘤间质新生血管之间相互作用的研究尚未见文献报道。本实验应用人乳腺癌组织标本,通过免疫组织化学方法检测乳腺癌组织微环境中免疫细胞的类型及数量,并分析其与肿瘤血管新生之间的关系。
1 材料与方法
1.1 组织标本收集吉林大学第一医院2010年9月—2011年11月行外科手术且经临床病理医生确诊的乳腺浸润性导管癌组织标本37例,其中Ⅰ级8例、Ⅱ级25例、Ⅲ级4例。37例标本均包括癌组织以及癌旁组织,取材时,癌旁组织为距癌结节2 cm以内的带乳腺腺体的正常组织,且避开坏死区。所有研究对象术前均未接受任何治疗,均无糖尿病、类风湿和甲状腺功能亢进等自身免疫性疾病史及免疫治疗史,年龄35~70岁,平均年龄48岁。所采集的标本均经患者知情同意且经吉林大学第一医院伦理委员会的同意。
1.2 免疫组织化学染色采用免疫组织化学染色SP法,CD4多克隆抗体购自美国Bioworld技术公司,CD8单克隆抗体购自美国Epitomics公司, CD34单克隆抗体购自北京中山技术公司,SP免疫组织化学试剂盒和DAB显色剂均购自福州迈新生物技术有限公司。石蜡切片脱蜡至水化,用枸橼酸盐修复液进行抗原修复,冷却至室温后水洗,CD4抗体1∶200倍稀释,CD8抗体1∶800倍稀释, CD34抗体为即用型,4℃孵育过夜,其他实验步骤按SP试剂盒说明书进行。以已知阳性组织作为阳性对照,以PBS为一抗作为阴性对照。
1.3 结果判定标准CD4及CD8阳性表达颗粒定位于淋巴细胞膜,结果判断标准参照文献[5],淋巴细胞膜中出现棕黄色为阳性表达,对阳性细胞所占百分率进行评分:1分为≤10%,2分为11%~30%,3分为31%~50%,4分为>50%;<3分为阴性,≥3分为阳性。
MVD结果的判定:以CD34表达阳性作为微血管的标志,CD34阳性染色颗粒定位于血管内皮细胞胞膜和胞浆中。内皮细胞形成条状或隙状等孤立或簇状结构,棕染。按Weinder法并稍加改进, 在100倍显微镜下,确定5个观察微血管的密集区,然后在200倍显微镜下计数每个密度区中1个视野的微血管数量,无论有无管腔,凡是单个孤立内皮细胞或多个内皮细胞紧密排列计数为1个微血管,凡是管腔的面积大于8个红细胞的直径并带有较厚肌层的微血管均不计数在内。以5个视野区域微血管数的均值表示肿瘤的MVD。
1.4 统计学分析采用SPSS 17.0软件进行统计学处理。CD4及CD8阳性表达率、CD4与CD8阳性表达率的比值(CD4/CD8比值)和MVD以±s表示,组间比较采用t检验;CD4阳性表达率、CD8阳性表达率和CD4/CD8比值与乳腺癌间质MVD的相关性分析采用Spearman等级相关检验。
2 结果
2.1 CD4及CD8在乳腺浸润性导管癌和癌旁组织淋巴细胞中的表达CD4及CD8均表达于肿瘤间质T淋巴细胞的胞膜上,并且呈现在肿瘤间质微血管周围分布较集中的特点。见图1和2(插页五和六)。
CD4在乳腺浸润性导管癌间质淋巴细胞中阳性表达率为(22.63±11.53)%,与癌旁组织阳性表达率[(34.09±10.41)%]比较明显降低(P<0.05);并且随着乳腺癌组织学级别的升高,CD4阳性表达率逐渐降低(P<0.05)。CD8在乳腺浸润性导管癌间质淋巴细胞中阳性表达率为(14.27± 9.03)%,与癌旁组织阳性表达率[(10.51± 1.88)%]比较差异无统计学意义(P>0.05);随着乳腺癌组织学级别的升高,CD8阳性表达率逐渐升高(P<0.01)。在癌旁组织及浸润性导管癌中CD4/CD8比值分别为3.24±1.02及2.16±2.17,二者比较差异无统计学意义(P>0.05);随着乳腺癌组织学级别的升高,其比值降低,差异有统计学意义(P<0.01)。见表1。
2.2 CD34在乳腺浸润性导管癌和癌旁组织间质血管内皮细胞中表达应用抗CD34单克隆抗体,标记肿瘤间质中微血管内皮细胞(图3,见插页六),计数MVD。在癌旁组织中MVD为38.47± 5.32,在乳腺浸润性导管癌Ⅰ、Ⅱ和Ⅲ级中MVD分别为41.99±8.05、64.04±10.14和79.61± 4.66。乳腺浸润性导管癌组织中的MVD值明显高于癌旁组织(P<0.05),并且随乳腺癌组织学级别的升高,MVD呈递增趋势。
表1 CD4及CD8在乳腺浸润性导管癌及癌旁组织间质淋巴细胞中的表达Tab.1 Expressions of CD4 and CD8 in breast invasive ductal carcinoma and adjacent tissues(±s)
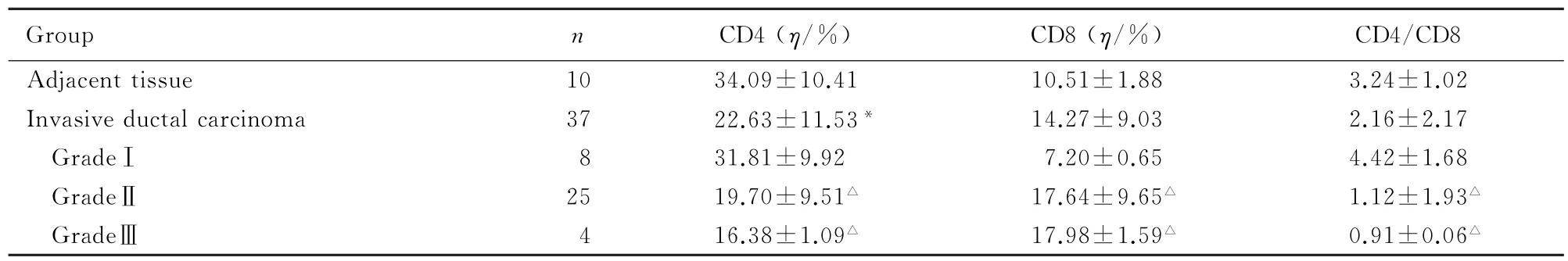
表1 CD4及CD8在乳腺浸润性导管癌及癌旁组织间质淋巴细胞中的表达Tab.1 Expressions of CD4 and CD8 in breast invasive ductal carcinoma and adjacent tissues(±s)
∗P<0.05 compared with adjacent tissue group;△P<0.01 compared with gradeⅠgroup.
Group n CD4(η/%)CD8(η/%)CD4/CD8 Adjacent tissue 10 34.09±10.41 10.51±1.88 3.24±1.02 Invasive ductal carcinoma 37 22.63±11.53∗14.27±9.03 2.16±2.17 GradeⅠ8 31.81±9.92 7.20±0.65 4.42±1.68 GradeⅡ25 19.70±9.51△17.64±9.65△1.12±1.93△GradeⅢ4 16.38±1.09△17.98±1.59△0.91±0.06△
2.3 CD4阳性表达率、CD8阳性表达率及CD4/ CD8比值与乳腺癌组织间质MVD的相关性分析CD4和CD8阳性表达率、CD4/CD8比值及MVD值均呈非正态分布。CD4阳性表达率与MVD呈负相关关系(r=-1.000,P<0.001);CD8阳性表达率与MVD呈正相关关系(r=0.984,P<0.001);CD4/CD8比值与MVD呈负相关关系(r=-0.984,P<0.001)。
3 讨论
肿瘤细胞间质中聚集的淋巴细胞被称为肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes, TIL),主要包括辅助性T淋巴细胞(CD4阳性T细胞)和细胞毒性T淋巴细胞(CD8阳性T细胞)。因其与肿瘤细胞密切接触,被认为是机体免疫系统对肿瘤的直接而又特异的识别者[6-8]。CD4阳性T细胞是抗原提呈细胞,其通过直接或者间接的作用,协调B细胞分化成浆细胞产生抗体,并且可以激活CD8阳性T细胞。CD8阳性T细胞不仅可以通过分泌细胞因子以提高免疫效应,也能直接杀伤肿瘤细胞。CD4和CD8阳性T细胞共同构成免疫调节的中心枢纽,二者的平衡承担着维持机体正常免疫应答的作用[9-11]。因此在肿瘤微环境中,浸润的免疫细胞的数量改变及功能变化,在一定程度上反映了机体抗肿瘤反应的状态[12-16]。
为了验证CD4和CD8在乳腺癌组织间质淋巴细胞中表达的变化规律,本文作者检测了37例乳腺癌及癌旁乳腺组织间质中CD4和CD8的表达,结果显示:CD4在乳腺浸润性导管癌间质淋巴细胞中的表达水平明显低于癌旁组织;并且随着乳腺癌组织学级别的升高,CD4阳性表达率降低;CD8在乳腺浸润性导管癌间质淋巴细胞中的表达率则明显高于癌旁组织,并随着乳腺癌组织学级别的升高,CD8阳性表达率升高;分析CD4/CD8比值,结果显示:乳腺癌组织CD4/CD8比值低于癌旁组织,但二者比较差异无统计学意义,在浸润性导管癌各级别之间CD4/CD8比值比较差异有统计学意义;Spearman相关性分析结果显示:CD4阳性表达率与MVD呈负相关关系,而CD8阳性表达率与MVD呈正相关关系,CD4/CD8比值与MVD呈负相关关系。以上研究结果证实:在乳腺癌恶性进展的过程中,CD4阳性T细胞进行性减少,而CD8阳性T细胞增多,二者的比值明显下降。CD4/CD8比值能反映机体的免疫状态和抗肿瘤能力[17-18]。然而目前国际上对于淋巴细胞亚群以及CD4/CD8比值并未建立统一数值,尤其肿瘤间质浸润淋巴细胞中CD4/CD8比值的提示意义尚有待进一步研究证实。有研究[19-20]表明:在恶性肿瘤的演进过程中,肿瘤细胞产生一些免疫抑制因子(IL-10、TGF-β等),抑制淋巴细胞分化增殖,淋巴细胞表面CD4细胞抗原减少,对CD4阳性T细胞产生抑制作用,而CD8阳性T细胞反应性增多,通过抑制抗体的合成、分泌,抑制T细胞的自我增殖。因此,CD4/CD8比值下降使机体免疫水平处于抑制状态,容易导致肿瘤转移。本研究中相关性分析结果显示:CD4/CD8比值与MVD呈负相关关系,进一步验证肿瘤微环境中免疫抑制状态越明显,肿瘤间质血管新生能力越强,但二者之间的潜在调控关系有待进一步研究证实。
[1]Smith HA,Kang Y.The metastasis-promoting roles of tumor-associated immune cells[J].J Mol Med,2013, 91(4):411-329.
[2]Starska K,Glowacka E,Kulig A,et al.Prognostic value of the immunological phenomena and relationship with clinicopathological characteristics of the tumor-the expression of the early CD69+,CD71+and the late CD25+,CD26+, HLA/DR+activation markers on T CD4+and CD8+lymphocytes in squamous cell laryngeal carcinoma.PartⅡ[J].Folia Histochem Cytobiol,2011,49(4):593-603.
[3]Jonuleit H,Schmitt E,Stassen M,et al.Identification and functional characterization of human CD4+CD25+T cells with regulatory properties isolated from peripheral blood[J].J Exp Med,2001,193(11):1285-1294.
[4]Eric Tartour H,Pere B,Maillere M,et al.Angiogenesis and immunity:a bidirectional link potentially relevant for the monitoring of antiangiogenic therapy and the development of novel therapeutic combination with immunotherapy[J].Cancer Metastasis Rev,2011,30(1):83-95.
[5]West NR,Milne K,Truong PT,et al.Tumor-infiltrating lymphocytes predict response to anthracycline-based chemotherapy in estrogen receptor-negative breast cancer[J].Breast Cancer Res,2011,13(6):R126.
[6]Chen Z,Chen X,Zhou E,et al.Intratumoral CD8+cytotoxic lymphocyte is a favorable prognostic marker in nodenegative breast cancer[J].PLoS One,2014,9(4): e95475.
[7]Yi JS,Cox MA,Zajac AJ.T-cell exhaustion: characteristics,causes and conversion[J].Immunology, 2010,129(4):474-481.
[8]Schreiber RD,Old LJ,Smyth MJ.Cancer immunoediting: integrating immunity’s role in cancer suppression and promotion[J].Science,2011,331(6024):1565-1570.
[9]Yasuda K.Density of CD4+and CD8+T lymphocytes in biopsy samples can be a predictor of pathological response to chemoradiotherapy(CRT)for rectal cancer[J].Radiat Oncol,2011,6(49):1-6.
[10]Mahmoud SM,Paish EC,Powe DG,et al.Tumorinfiltrating CD8+lymphocytes predict clinical outcome in breast cancer[J].J Clin Oncol,2011,29(15):1949-1955.
[11]Liu F,Lang R,Zhao J,et al.CD8+cytotoxic T celland FOXP3+regulatory T cell infiltration in relation to breast cancer survivaland molecular subtypes[J].Breast Cancer Res Treat,2011,130(2):645-655.
[12]Ino Y,Yamazaki-Itoh R,Shimada K,et al.Immune cell infiltration as an indicator of the immune microenvironment of pancreatic cancer[J].Br J Cancer,2013,108(4):914-923.
[13]Mazzolini G,Murillo O,Atorrasagasti C,et al.Immunotherapy and immunoescape in colorectal cancer[J].World J Gastroenterol,2007,13(44):5822-5831.
[14]Oh E,Choi Y,Park T,et al.A prognostic model for lymphnode-negative breast cancer patients based on the integration of proliferation and immunity[J].Breast Cancer Res Treat, 2012,132(2):499-509.
[15]杜宏道,盛 薇,高希涛,等.VEGF-C、CXCR4在乳腺浸润性导管癌组织中的表达及意义[J].西安交通大学学报:医学版,2012,33(1):75-78.
[16]张桂香,刘新兰,李金平.MDR1、BCRP和LRP基因在乳腺癌组织中的表达及其意义[J].西安交通大学学报:医学版,2012,33(1):79-83.
[17]陈 海,毛建平.肿瘤免疫逃逸与T淋巴细胞关系的研究进展[J].中国生物工程杂志,2012,32(10):86-92.
[18]Perret R,Sierro SR,Botelho NK,et al.Adjuvants that improve the ratio of antigen-specific effector to regulatory T cells enhance tumor immunity[J].Cancer Res,2013, 73(22):6597-6608.
[19]Hald SM,Bremnes RM,Al-Shibli K,et al.CD4/CD8 co-expression shows independent prognostic impact in resected non-small cell lung cancer patients treated with adjuvant radiotherapy[J].Lung Cancer,2013,80(2):209-215.
[20]Pober JS,Tellides G.Participation of blood vessel cells in human adaptive immune responses[J].Trends Immunol, 2012,33(1):49-57.
∗吉林大学临床医学专业5年制2011级
Correlation of CD4 and CD8 positive lymphocytes with tumor angiogenesis in microenvironment of breast invasive ductal carcinoma
LA Zong1,2,WANG Jian-xia1,CUI Ni∗,LI Ming-yue1,XING Shu-gang1,REN Bo1, ZHANG Li-hong1,LI Wei1,LI Yu-lin1
(1.Department of Pathology,School of Basic Medical Sciences,Key Laboratory of Pathobiology, Ministry of Education,Jilin University,Changchun 130021,China;2.Department of Pathology, School of Medical Sciences,University of Tibet,Lasa 850000,China)
breast neoplasms;T lymphocytes;tumor angiogenesis;CD4;CD8
R737.9
A
2014-02-24
吉林省科技厅自然科学基金资助课题(20130102084JC);吉林大学白求恩医学科研支持计划资助课题(2013101005);吉林大学“大学生创新创业训练计划”国家级项目资助课题(2013A71249)
拉 宗(1975-),女,西藏自治区拉萨市人,讲师,医学硕士,主要从事肿瘤间质病理生物学方面的研究。
李玉林(Tel:0431-85619481,E-mail:ylli@jlu.edu.cn);
李 伟(Tel:0431-85619481,E-mail:liwei2006@jlu.edu.cn)
时间: 2014-08-27 14:41
网络出版地址: http://www.cnki.net/kcms/detail/22.1342.R.20140827.1441.002.html
1671-587Ⅹ(2014)05-1069-05
10.13481/j.1671-587x.20140531
Abstract:Objective To detect the percentages of CD4+,CD8+T lymphocytes in the breast invasive ductal carcinoma microenvironment,and to analyze their correlation with breast carcinoma microvessel density(MVD).MethodsThe expressions of CD4,CD8 and CD34 were detected in 10 cases of adjacent normal breast tissue and 37 cases of breast invasive ductal carcinoma tissue by immunohistochemistry.The correlations between CD4,CD8, CD4/CD8 and MVD were analyzed by Spearman correlation analysis.ResultsThe CD4 expression level (22.63%±11.53%)in breast invasive ductal carcinoma tissue was lower than that in adjacent tissue(34.09%± 10.41%),and there was statistically significant difference(P<0.05).With the increasing of the histological grade of breast cancer,grade,the expression level of CD4 was gradually decreased(P<0.05).The CD8 expression level (14.27%±9.03%)in breast invasive ductal carcinoma tissue was higher than that in adjacent tissue(10.51%± 1.88%),but there was no statistically significant difference(P>0.05).With the increasing of the histological grade of breast cancer,the expression level of CD8 was gradually increased(P<0.01).The CD4/CD8 ratios in adjacent tissue group and breast invasive ductal carcinoma tissue group were 3.24±1.02 and 2.16±2.17,and there was no statistically significant difference between them(P>0.05).With the increasing of histological grade of breast invasive ductal carcinoma,the CD4/CD8 ratios were decreased(P<0.01).The MVD in breast invasive ductal carcinoma tissue was obviously higher than that in adjacent tissue,and it showed an increasing trend with the increasing of the histological grade of breast invasive ductal carcinoma(P<0.05).The correlation analysis showed that the MVD was negatively correlated with the CD4 expression(r=-1.000,P<0.001)as well as CD4/CD8 ratio(r=-0.984,P<0.001),and was positively correlated with the CD8 expression level(r=0.984,P<0.001).ConclusionThe expression of CD4 is decreased in breast cancer tissue,the expression of CD8 is elevated, and the CD4/CD8 ratio is decreased,which suggests that T cells in the breast cancer microenvironment are immunosuppressed.

