低分子壳聚糖的抗肝纤维化作用及其对TLR4表达的影响
马佳男,敬海峰,张春梅,董友杰,何海涛,韩 旭,费 瑞
(1.吉林大学基础医学院细胞生物学系,吉林长春 130021; 2.吉林大学基础医学院基础医学实验教学中心,吉林长春 130021)
低分子壳聚糖的抗肝纤维化作用及其对TLR4表达的影响
马佳男1,敬海峰2,张春梅1,董友杰1,何海涛1,韩 旭1,费 瑞1
(1.吉林大学基础医学院细胞生物学系,吉林长春 130021; 2.吉林大学基础医学院基础医学实验教学中心,吉林长春 130021)
目的:阐明低分子壳聚糖(LMCTS)对四氯化碳(CCl4)诱导大鼠肝纤维化的抑制作用,探讨其对Toll样受体4(TLR4)表达的影响,为开发临床治疗肝纤维化的天然候选药物奠定基础。方法:将72只雄性Wistar大鼠随机均分空白对照组、CCl4组(模型组)、甘利欣(DG)组和50、100及150 mg·kg-1LMCTS组(低、中和高剂量组)。除空白对照组外,其余5组大鼠腹腔注射40%CCl4植物油(1.75 m L·kg-1),每周2次,共8周;空白对照组大鼠腹腔注射等量100%植物油。从第9周起,DG组及LMCTS组大鼠分别灌胃给予DG和LMCTS(每天1次,共4周)。实验结束后检测各组大鼠血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和碱性磷酸酶(ALP)的活性,光镜下观察肝组织病理学改变,并采用RT-PCR和Western blotting法检测TLR4表达情况。结果:血清学指标,中和高剂量LMCTS组大鼠血清ALT、AST和ALP活性均低于模型组(P<0.05);与低剂量LMCTS组比较,中剂量LMCTS组ALP活性明显降低(P<0.05),而ALT和AST活性降低不明显(P>0.05);高剂量LMCTS组ALT、AST和ALP活性与中剂量LMCTS组比较差异有统计学意义(P<0.05)。HE染色,模型组大鼠部分肝细胞脂肪变性,有明显的炎性细胞浸润和胶原纤维增生,肝小叶破坏明显,而LMCTS组大鼠肝组织的变化有所减轻。RT-PCR和Western blotting法,与模型组比较,LMCTS组大鼠肝组织中TLR4表达水平降低(P<0.05或P<0.01),以高剂量LMCTS组最为明显,不同剂量组之间比较差异均有统计学意义(P<0.05)。结论:高剂量LMCTS具有良好的降低肝纤维化大鼠血清转氨酶活性和改善肝纤维化大鼠肝功能的作用,且此过程与TLR4表达水平降低有关。
低分子壳聚糖;四氯化碳;肝纤维化;Toll样受体4
肝纤维化是慢性肝脏疾病进程中可变的中间状态,如给予有效干预和治疗,其肝病进程可延缓甚至逆转[1-2]。Toll样受体4(Toll-like receptor 4, TLR4)是细胞表面识别病原相关分子的一个重要模式识别受体,可接受脂多糖(lipopolysaccharide, LPS)的刺激作用,诱导炎症等多种疾病的发生[4-5]。研究[6]发现:在活化的肝星状细胞中存在完整的TLR4信号转导通路,而肝星状细胞的活化又是肝纤维化形成的中心环节。低分子壳聚糖(low molecular weight chitosan,LMCTS)是自然界中唯一带正电荷的碱性氨基多糖。与壳聚糖相比,LMCTS有较高溶解度,易被机体吸收和利用,且具有提高人体免疫力、延缓衰老、抑制癌细胞转移和强化肝功能等作用[7-8]。目前,采用LMCTS干预肝纤维化的研究较少,而其是否可通过TLR4信号转导通路抑制肝纤维化进程尚不十分清楚,国内外也未见相关报道。本实验通过研究LMCTS对大鼠肝纤维化的干预作用,探讨TLR4在该过程中作用,旨在为进一步研究LMCTS干预肝纤维化的作用机制和开发临床治疗肝纤维化的天然候选药物奠定基础。
1 材料与方法
1.1 实验动物和主要试剂Wistar雄性清洁级大鼠,体质量180~200 g,由吉林大学实验动物中心提供(动物合格证号:吉2000-042)。正常光照,室温饲养,自由摄食饮水。LMCTS(Mr=5 000)购于济南海得贝海洋生物工程有限公司;甘利欣(diammonium glycyrrhizinate,DG)(H10940191)由江苏正大天晴药业有限公司生产。四氯化碳(CCl4)由北京化工厂生产;丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和碱性磷酸酶(ALP)试剂盒购于南京建成生物工程研究所; TLR4多克隆抗体购于Abcam公司;羊抗兔IgG购于天津三箭生物技术有限公司;RIPA裂解液、Trizol购于北京鼎国昌盛生物技术有限公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;第1链cDNA合成试剂盒购于北京全式金生物技术有限公司。
1.2 动物分组和大鼠肝纤维化模型制备72只雄性Wistar大鼠随机分6组:空白对照组、CCl4组(模型组)、甘利欣(DG)组和50、100、150 mg·kg-1LMCTS组(低、中、高剂量组),每组12只。参照邝胜利等[9]利用CCl4诱导大鼠肝纤维化模型的方法,空白对照组大鼠以1.75 m L·kg-1腹腔注射植物油,其他各组大鼠按1.75 m L·kg-1腹腔注射40%CCl4植物油混合液(CCl4∶植物油=4∶6),每周2次,共8周,以血清学指标增加及解剖观察肝组织损伤程度判定模型成功。模型复制完成后,从第9周起,各实验组灌胃给药,剂量和药物如下:空白对照组和模型组每日按5 m L·kg-1给予生理盐水灌胃;DG组每日按50 mg·kg-1剂量给予甘利欣;参照Santhosh等[10]方法并结合本文作者的前期实验[11],低、中和高剂量LMCTS组大鼠每日分别按50、100和150 mg·kg-1给予LMCTS。每日1次,共28 d。
1.3 血清学指标检测连续灌胃28 d后,各组大鼠禁食不禁水12 h,用25%乌拉坦麻醉,腹主动脉取血,静止1 h,3 000 r·min-1离心15 min,取血清检测肝功能指标ALT、AST和ALP,测定方法参照试剂盒说明书。
1.4 肝组织病理学检查取各组大鼠肝脏部分左叶,10%甲醛中固定,常规脱水,经石蜡包埋后切片,HE染色,光学显微镜下观察肝组织的形态学变化,并结合血清学指标判断纤维化程度。
1.5 TLR4m RNA表达检测采用Trizol法提取肝脏组织总RNA。利用1%琼脂糖凝胶电泳检测RNA完整性,利用260和280 nm处的吸光度(A)值计算RNA水平。将1μg RNA反转录成cDNA,以sence 5′-CCAGAGCCGTTGGTGTATC-3′和antisence 5′-GCCCTGTGAGGTCGTTGA-3′为TLR4引物,以sence 5′-CACCCTGTGCTGCTCACCGAGGCC-3′和antisence 5′-CCACACAGATGACTTGCGCTCAGG-3′为β-actin引物进行扩增。反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,主循环30个;72℃终延伸5 min。取10μL PCR产物, 经1%琼脂糖电泳,以各自TLR4与β-actin A值比值作为TLR4m RNA的相对表达水平。
1.6 TLR4蛋白表达检测选取约100 mg肝脏组织放于无菌EP管中,加入100μL RIPA裂解液,用组织破碎仪粉碎3次,冰上放置1 h,4℃、12 000 r·min-1离心5 min,提取上清液。利用BCA蛋白浓度测定试剂盒测定蛋白质浓度。灌胶上样进行聚丙烯酰胺凝胶电泳,上层胶80 V恒压、下层胶160 V恒压电泳,根据标准Marker移动情况适时终止电泳。300 m A、湿转2 h将蛋白转移至醋酸纤维素膜上。转膜结束后,TBST洗膜3次,每次10 min,5%脱脂牛奶封闭2 h。洗膜,加入TLR4多克隆抗体(1∶800)孵育,室温杂交2 h(或4℃过夜),洗膜。加羊抗兔IgG(1∶3 000)孵育,室温杂交2 h。洗膜,然后加ECL显色液,上机检测。以各自TLR4与β-actin A值比值作为TLR4蛋白的相对表达水平。
1.7 统计学分析采用SPSS 11.0软件进行统计学处理。各组大鼠血清ALT、AST和ALP活性以及TLR4m RNA和蛋白表达水平以±s表示,各检测指标的组间比较采用t检验。
2 结果
2.1 各组大鼠肝功能变化本实验依据课题组前期的研究结果,检测给药28 d后各组大鼠的肝功能指标,结果显示:中和高剂量LMCTS组大鼠血清中ALT、AST和ALP活性均低于模型组(P<0.05或P<0.01)。与低剂量LMCTS组比较,中剂量LMCTS组ALP活性降低明显(P<0.05),而ALT和AST活性降低不明显(P>0.05)。与中剂量LMCTS组比较,高剂量LMCTS组ALT、AST和ALP活性均明显降低(P<0.05)。见表1。
表1 各组大鼠血清ALT、AST和ALP活性Tab.1 Activities of serum ALT,AST and ALP of rats in various groups [n=12,±s,λB/(U·L-1)]

表1 各组大鼠血清ALT、AST和ALP活性Tab.1 Activities of serum ALT,AST and ALP of rats in various groups [n=12,±s,λB/(U·L-1)]
∗P<0.01 vs blank control group;△P<0.05,△△P<0.01 vs model group;#P<0.05 vs 50 mg·kg-1LMCTS group;▲P<0.05 vs 100 mg·kg-1LMCTS group.
Group ALT AST ALP Blank control 19.67±3.13 39.24±2.74 18.69±1.53 Model 62.62±2.65∗68.66±4.73∗44.87±2.59∗DG 34.47±4.51△△47.14±2.55△△25.62±2.51△LMCTS(mg·kg-1) 50 53.53±4.16△62.68±2.52 38.45±1.88△100 46.21±5.69△56.81±3.61△30.32±2.32△△#150 25.34±3.07△△#▲45.58±4.93△△#▲24.77±2.68△△#▲
2.2 各组大鼠肝脏组织病理学改变空白对照组大鼠肝组织中肝小叶结构完整,肝细胞排列整齐,肝板呈条索状,且以中央静脉为中心呈放射状排列。模型组大鼠肝组织中炎症细胞浸润明显,并伴有大量的肝细胞水样变、气球样变和脂肪样变性;汇管区纤维组织明显增生,并伸入小叶将肝小叶分割。DG组大鼠肝组织炎性浸润不明显,肝小叶完整,肝细胞排列趋于整齐;细胞未见水样变或脂肪样变;细胞核大而清晰。低剂量LMCTS组大鼠肝组织炎症明显,肝小叶结构相对完整,但肝细胞排列紊乱;部分肝细胞呈水样变或脂肪样变性;细胞核大小不一。中剂量LMCTS组大鼠肝组织局部有炎症浸润,但肝小叶结构破坏不明显,肝细胞排列不整齐,偶见肝细胞水样变或脂肪样变性。高剂量LMCTS组大鼠肝组织炎性浸润不明显,肝小叶结构正常,肝细胞排列整齐、肝细胞水样变少见。与模型组大鼠比较,不同剂量LMCTS组和DG组大鼠肝组织中炎性细胞浸润及胶原纤维增生较少,肝小叶破坏明显减轻,其中以高剂量LMCTS组大鼠效果最好。见图1(插页五)。
2.3 各组大鼠肝组织中TLR4mRNA表达RT-PCR法检测结果显示:与空白对照组比较,模型组大鼠肝组织中TLR4mRNA表达水平明显升高(P<0.01);与模型组比较,中和高剂量LMCTS组TLR4m RNA表达水平明显降低(P<0.05或P<0.01),其中高剂量LMCTS组降低最为明显;不同剂量LMCTS组之间比较差异也有统计学意义(P<0.05)。见表2和图2。
表2 各组大鼠肝组织中TLR4mRNA表达水平Tab.2 Expression levels of TLR4m RNA in liver tissue of rats in various groups(n=12,±s)

表2 各组大鼠肝组织中TLR4mRNA表达水平Tab.2 Expression levels of TLR4m RNA in liver tissue of rats in various groups(n=12,±s)
∗P<0.01 vs blank control group;△P<0.05,△△P<0.01 vs model group;#P<0.05 vs 50 mg·kg-1LMCTS group;▲P<0.05 vs 100 mg·kg-1LMCTS group.
Group TLR4m RNA Blank control 0.22±0.03 Model 1.13±0.14∗DG 0.32±0.04△△#LMCTS(mg·kg-1) 50 1.09±0.09 100 0.67±0.11△#150 0.34±0.06△△#▲
2.4 各组大鼠肝组织中TLR4蛋白表达Western blotting结果显示:与空白对照组比较,模型组大鼠肝组织中TLR4蛋白表达水平明显升高(P<0.01);与模型组比较,中和高剂量LMCTS组大鼠肝组织中TLR4蛋白表达水平均降低(P<0.05 或P<0.01),其中高剂量LMCTS组降低最为明显。不同剂量LMCTS组之间比较差异也有统计学意义(P<0.05)。见表3和图3。
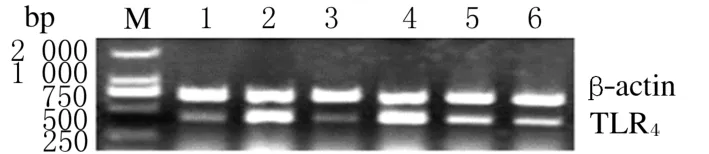
图2 各组大鼠肝组织中TLR4m RNA表达电泳图Fig.2 Electrophoregram of expressions of TLR4m RNA in liver tissue of rats in various groupsM:Marker;Lane 1:Blank control group;Lane 2:Model group; Lane 3:DG group;Lane 4-6:50,100,and 150 mg·kg-1LMCTS groups.
表3 各组大鼠肝组织中TLR4蛋白表达水平Tab.3 Expression levels of TLR4protein in liver tissue of rats in various groups(n=12,±s)

表3 各组大鼠肝组织中TLR4蛋白表达水平Tab.3 Expression levels of TLR4protein in liver tissue of rats in various groups(n=12,±s)
∗P<0.01 vs blank control group;△P<0.05,△△P<0.01 vs model group;#P<0.05 vs 50 mg·kg-1LMCTS group;▲P<0.05 vs 100 mg·kg-1LMCTS group.
Group TLR4protein Blank control 0.13±0.01 Model 1.67±0.12∗DG 0.31±0.05△△LMCTS(mg·kg-1) 50 1.52±0.07 100 1.00±0.24△#150 0.28±0.05△△#▲
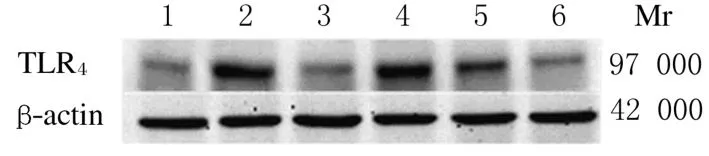
图3 各组大鼠肝组织中TLR4蛋白表达电泳图Fig.3 Electrophoregram of expressions of TLR4protein in liver tissue of rats in various groupsLane 1:Blank control group;Lane 2:Model group:Lane 3:DG group;Lane 4-6:50,100,and 150 mg·kg-1LMCTS group.
3 讨论
肝纤维化是指由各种致病因子所致肝内结缔组织的异常增生,是各种慢性肝病的共同病理表现。肝纤维化和肝硬化是连续的发展过程,其早期诊断及治疗对肝硬化的防治和逆转均具有重要意义[12]。血清学指标是反映肝实质损害及病变的最敏感指标,而肝脏组织学检查可以直观和准确地判断肝病严重程度[13-14]。本实验利用CCl4制备大鼠肝纤维化模型,通过血清学和组织病理学检测证明了LMCTS可不同程度地改善肝脏功能,修复大鼠的肝纤维化,其作用效果与DG相当,这为开发新型高效无不良反应的修复肝损伤的天然候选药物提供了实验依据。
LPS也称内毒素(endotoxin),是肝损伤中的一个重要因子,能刺激机体产生强烈的炎症反应[15]。作为LPS的模式识别受体TLR4可表达在机体多种细胞,如单核细胞、内皮细胞等细胞表面,LPS与TLR4结合后可激活核转录因子-κB,导致许多促炎因子的产生[16-18]。因此,LPS与TLR4的相互作用在肝纤维化的发病机制中起到了关键性作用。王登妮等[19]研究发现:在肝纤维化过程中,TLR4表达水平明显升高;而Bai等[20]研究发现:百里香醌可通过抑制TLR4信号通路介导的炎性反应发挥抗肝纤维化作用。本研究发现:肝纤维化大鼠肝组织中的TLR4mRNA和蛋白表达水平明显升高,与上述报道结果一致;而中和高剂量LMCTS可不同程度地降低肝组织中TLR4表达水平,其中以高剂量LMCTS组的效果最为明显,这与LMCTS改善肝脏功能和修复大鼠的肝纤维化的结果相一致。提示LMCTS对大鼠肝纤维化的抑制作用很可能与TLR4表达有关,其具体的信号传导过程有待进一步证实。
综上所述,本研究不仅发现了LMCTS具有修复肝损伤作用,而且还初步证明了一个相关作用的靶点,这为充分利用壳聚糖资源、研究其修复肝损伤的机制、开发无不良反应的天然抑制肝纤维化的候选药物奠定了基础。
[注:本文由第一、第二作者共同完成]
[1]Radbill BD,Gupta R,Ramirez MC,et al.Loss of matrix metalloproteinase-2 amplifies murine toxin-induced liver fibrosis by upregulating collagen I expression[J].Dig Dis Sic, 2011,56(2):406-416.
[2]Huang Y,Huang C,Li J.Effect of cytokines secreted from Kupffer cell on HSC proliferation,apoptosis in hepatic fibrosis process[J].China Pharmacol Bull,2010,26(1):9-13.
[3]陆伦根,李郑红.肝纤维化及肝硬化研究近况[J].临床肝胆病杂志,2013,29(5):321-323.
[4]Akira S,Uematsu S,Takeuchi O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783-780.
[5]Beutler BA.TLRs and innate immunity[J].Blood,2009, 113(7):1399-1407.
[6]Seki E,De Minicis S,Osterreicher CH,et al.TLR4enhances TGF-beta signaling and hepatic fibrosis[J].Nature Med,2007,13(11):1324-1332.
[7]陈 伟,陈惠英,张 彦.壳聚糖在医药领域的应用[J].医学信息,2007,20(3):507-508.
[8]蒋挺大.壳聚糖[M].北京:化学工业出版社,2007:1-15.
[9]邝胜利,胡 兵.肝纤维化大鼠模型研究进展[J].实验动物与比较医学,2008,28(1):62-66.
[10]Santhosh S,Sini TK,Anandan R,et al.Hepatoprotective activity of chitosan against isoniazid and rifampicin-induced toxicity in experimental rats[J].Eur J Pharmacol,2007, 572(1):69-73.
[11]敬海峰.低分子壳聚糖对四氯化碳诱导的大鼠肝纤维化干预作用[D].长春:吉林大学,2013.
[12]李 娜.现代医学对肝纤维化防治的研究进展[J].西南军医,2013,15(2):154-156.
[13]朱明慧,刘旭华,韩际奥,等.人脐带间充质干细胞治疗失代偿期肝硬化的疗效观察[J].郑州大学学报:医学版, 2013,48(1):117-120.
[14]张 丽.无创性肝纤维化诊断和评估的文献综述[J].中国医药指南,2010,8(13):40.
[15]Zou Y,Yang Y,Li J,et al.Prevention of hepatic injury by a traditional Chinese formulation,BJ-JN,in mice treated with Bacille-Calmette-Guérin and lipopolysaccharide[J].J Ethnopharmacol,2006,107(3):442-448.
[16]殷小磊,卢伟娜.LPS/TLR4信号途径在非酒精性脂肪性肝病中的作用[J].世界华人消化杂志,2013,21(28): 2957-2962.
[17]潘 澎,刘绍能.PI3K/Akt信号通路与肝纤维化[J].临床肝胆病杂志,2013,29(5):389-392,396.
[18]Akira S,Takeda K.Toll-like receptor signalling[J].Nat Rev Immunol,2004,4(7):499-51.
[19]王登妮,徐军全.肝纤维化过程中Toll样受体4在肝脏的表达分布及意义[J].中国比较医学杂志,2010,20(6):17-20.
[20]Bai T,Yang Y,Wu YL,et al.Thymoquinone alleviates inflammation-associated liver fibrosis via TLR4signaling pathway[J].Chin J Tradition Chin Med,2013,28(5): 1541-1547.
Anti-hepatic fibrosis effect of low molecular weight chitosan and its influence in TLR4expression
MA Jia-nan1,JING Hai-feng2,ZHANG Chun-mei1,DONG You-jie1,HE Hai-tao1,HAN Xu1,FEI Rui1
(1.Department of Cell Biology,School of Basic Medical Sciences,Jilin University,Changchun 130021, China;2.Experimental Teaching Center of Basic Medicine,School of Basic Medical Sciences, Jilin University,Changchun 130021,China)
ObjectiveTo clarify the inhibitory effect of low molecular weight chitosan(LMCTS)on hepatic fibrosis induced by carbon tetrachloride(CCl4)in the rats,and to investigate its effect on the expression of Toll-like receptor-4(TLR4)and to lay the foundation for the development of the clinical candidate drug of liver fibrosis.Methods72 male Wistar rats were randomly divided into blank control group,CCl4group(model group), glycyrrhizinate(DG)group,50,100 and 150 mg·kg-1LMCTS groups(low,middle and high doses of LMCTS groups).In addition to blank control group,the rats in the remaining groups were given 40%CCl4-vegetable oil (1.75 m L·kg-1),2 times per week for 8 weeks,by intraperitoneal injection to establish the model of rat hepaticfibrosis.And the rats in blank control group were injected with the same amount of 100%vegetable oil agent.From the ninth week,the rats in DG and LMCTS groups were given DG and LMCTS by intragastric administration,1 time/week for 4 weeks.Then all rats were sacrificed,the activities of serum glutamic acid aminotransferase (ALT),aspartate aminotransferase(AST)and alkaline phosphatase(ALP)were detected with ELISA kit;the pathological changes in liver tissue were observed under light microscope,and the TLR4expressions were detected by RT-PCR and Western blotting method.ResultsThe serum ALT,AST and ALP activities in middle and high doses of LMCTS groups were lower than those in model group(P<0.05).The serum ALT activity in middle dose of LMCTS group was lower than that in low dose of LMCTS group(P<0.05),but the activities of AST and ALP had no statistically significant change(P>0.05).There were statistically significant differences in the serum ALT, AST and ALP activities between high dose of LMCTS group and middle dose of LMCTS group(P<0.05).There were obvious hepatocyte steatosis,inflammatory cell infiltration,collagen fiber hyperplasia and hepatic lobule damage in the rats in model group.However,all the changes in liver tissue of the rats in LMCTS group were significantly reduced,especially in high dose group.The results of RT-PCR and Western blotting method showed that the expression of TLR4was declined in LMCTS groups compared with model group(P<0.05,P<0.01), especially in high dose of LMCTS group,and there were statistically significant differences between different doses of LMCTS groups(P<0.05).ConclusionHigh dose of LMCTS can decrease the serum transaminase activity of liver fibrosis rats and improve liver function,and this process may be related to declining the expression of TLR4.
low molecular weight chitosan;carbon tetrachloride;hepatic fibrosis;Toll-like receptor 4
R575.2
A
2014-02-25
吉林省科技厅科技发展计划项目资助课题(20100920)
马佳男(1992-),女,黑龙江哈尔滨市人,在读医学硕士,主要从事细胞生物学研究。
费 瑞(Tel:0431-85619473,E-mail:feirui@jlu.edu.cn)
1671-587Ⅹ(2014)05-1013-05
10.13481/j.1671-587x.20140521

