单宁酸对高糖和糖化终末产物培养条件下肾小球系膜细胞氧化应激及微炎症状态的改善作用
魏海峰,李 才,方艳秋,魏雁虹,谭 岩
(1.吉林省人民医院中心实验室,吉林长春 130021;2.吉林大学转化医学院,吉林长春 130021; 3.吉林省人民医院检验科,吉林长春 130021)
单宁酸对高糖和糖化终末产物培养条件下肾小球系膜细胞氧化应激及微炎症状态的改善作用
魏海峰1,李 才2,方艳秋1,魏雁虹3,谭 岩1
(1.吉林省人民医院中心实验室,吉林长春 130021;2.吉林大学转化医学院,吉林长春 130021; 3.吉林省人民医院检验科,吉林长春 130021)
目的:探讨单宁酸对肾小球系膜细胞(GMC)的作用,从氧化应激及微炎症角度阐明单宁酸改善糖尿病肾病(DN)的作用机制。方法:体外培养GMC,分别用高浓度葡萄糖(30 mmol·L-1)及糖化终末产物(AGEs)牛血清白蛋白(BSA,250 mg·L-1)处理,正常糖培养及不含糖的BSA处理的细胞作为相应对照组,在高糖或AGEs处理的同时采用不同浓度单宁酸(10、20、40和80μmol·L-1)进行干预,培养48 h后检测细胞培养上清中丙二醛(MDA)水平及谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性, ELISA法检测细胞培养上清中8-羟基脱氧鸟苷(8-OHd G)水平,免疫组织化学法检测GMC中细胞间黏附分子1 (ICAM-1)蛋白表达,RT-PCR法检测GMC中单核细胞趋化蛋白1(MCP-1)和ICAM-1 mRNA的表达水平。结果:与高糖组和AGEs组比较,单宁酸处理组MDA水平明显降低(P<0.05),GSH-Px、SOD及CAT活性明显升高(P<0.05或P<0.01),GMC培养上清中8-OHd G水平明显降低(P<0.05)。与高糖组和AGEs组比较, 40和80μmol·L-1单宁酸组ICAM-1蛋白表达水平明显降低(P<0.05)。与高糖组比较,单宁酸组MCP-1和ICAM-1 m RNA表达水平明显降低(P<0.01)。结论:单宁酸可保护GMC免受氧化及炎症介质的损伤,从而延缓和改善DN的肾小球病变。
单宁酸;糖尿病肾病;氧化应激;微炎症;8-羟基脱氧鸟苷
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)最常见和最严重的慢性并发症之一。DM可通过多种途径损害肾脏,并累及肾脏的所有结构,包括肾小球、肾小管、肾血管及间质等,但DN的发病机制尚未完全阐明,也缺乏有效的治疗方法。单宁酸(tannic acid,TA)具有止血愈伤、抑菌、抗病毒、抗炎、抗氧化和延缓衰老等功效[1]。我国拥有丰富的提取制备单宁酸的天然资源,约70%以上的中草药、多种树木及果实中均含有此类鞣质化合物。但目前国内外关于单宁酸对DN防治作用的研究少有报道。本文作者前期动物实验[9]结果表明:单宁酸可以降低DM大鼠血清肌酐和尿素氮,减少DM大鼠尿蛋白排泄率,减轻肾小球系膜基质增生和基底膜增厚,对肾脏功能具有一定保护作用[2]。本研究通过体外培养大鼠肾小球系膜细胞(glomerular mesangial cells,GMC),观察单宁酸对高糖和糖化终末产物(advanced glycosylation end-products,AGEs)培养条件下GMC氧化应激水平及炎症因子表达的影响,在细胞水平探讨单宁酸改善肾脏病变的作用机制,为单宁酸防治DN提供实验依据。
1 材料与方法
1.1 细胞与主要试剂大鼠GMC(吉林省人民医院中心实验室保存),单宁酸和牛血清白蛋白(BSA组分Ⅴ)和盐酸氨基胍(美国Sigma公司),DMEM培养基和胰蛋白酶(美国Gibco公司),小牛血清(FBS,天津灏洋公司),丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)及过氧化氢酶(CAT)试剂盒(南京建成公司),大鼠8-羟基脱氧鸟苷(8-OHd G)试剂盒(美国R&D公司),兔抗大鼠细胞间黏附分子1(ICAM-1)多克隆抗体(北京博奥森公司),过氧化物酶标记的羊抗兔IgG(武汉博士德公司)。
1.2 AGEs-BSA的制备 将10 g·L-1BSA、0.5 mol·L-1葡萄糖、1 mmol·L-1EDTA、100 IU·m L-1青霉素和100 mg·L-1链霉素溶于0.1 mol·L-1PBS(p H 7.2),过滤除菌,37℃恒温避光孵育2个月,以相对分子质量为10 000的透析袋对PBS溶液充分透析,以除去未结合的葡萄糖。同样条件下用不含葡萄糖BSA孵育的细胞作为阴性对照。
1.3 细胞培养及实验分组大鼠GMC在低糖条件下培养后分为以下各组:正常糖(normal glucose,NG)组,含5.6 mmol·L-1D-葡萄糖;高糖(high glucose,HG)组,含30 mmol·L-1D-葡萄糖;甘露醇组,含25 mmol·L-1甘露醇; AGEs及BSA组:将AGEs或BSA加入低糖DMEM培养液中,使AGEs及BSA终浓度为250 mg·L-1;药物处理组:在高糖或AGEs处理的同时加入药物,单宁酸分为10、20、40和80μmol·L-14个浓度组;氨基胍(AG)作为阳性对照药,终浓度为250μmol·L-1。
1.4 细胞培养上清中MDA、8-OHdG水平及GSH-Px、SOD和CAT活性检测细胞给药后继续培养48 h,吸取细胞培养上清,采用比色法及酶法检测MDA水平及GSH-Px、SOD和CAT活性。采用ELISA法检测8-OHd G水平,严格按照试剂盒说明书进行操作。
1.5 免疫组织化学法检测ICAM-1蛋白表达细胞爬片,培养48 h后用PBS(0.1 mol·L-1, p H 7.4)洗板3次,将玻片用10%甲醛固定30 min。免疫组织化学染色采用SABC法,应用病理图像分析系统分析蛋白表达阳性率。
1.6 RT-PCR法检测单核细胞趋化蛋白1 (MCP-1)和ICAM-1 m RNA表达水平按照Trizol说明书,提取细胞总RNA。参照AMV Reverse transcriptase说明方法,取总RNA 2μg, Oligo(d T)为引物,合成cDNA第1条链。设计引物由上海生工合成完成。扩增GAPDH (BC004109):5′-GGGTGATGCTGGTGCTGAGTATGT-3′,5′-AAGAATGGGAGTTGCTGTTGAAGTC-3′,扩增片段617 bp;MCP-1 (M57441.1):5′-CAATGAGTCGGCTGGAGA-3′,5′-GCTTGAGGTGGTTGTGGA-3′,扩增片段281 bp;ICAM-1(NM_010493.2):5′-CGTGCTGTATGGTCCTCG-3′,5′-GGGCTTGTCCCTTGAGTT-3′,扩增片段423 bp。反应条件: 94℃变性5 min;94℃变性45 s,58℃退火45 s, 72℃延伸45 s,共30个循环;72℃充分延伸10 min。PCR产物经2%琼脂糖凝胶电泳分析,紫外线透射反射分析仪上拍照,应用计算机图像分析系统计算待检基因与GAPDH的灰度比值。
1.7 统计学分析采用SPSS 13.0软件进行统计学处理。培养上清中MDA和8-OHdG水平, GSH-Px、SOD和CAT活性,细胞中ICAM-1蛋白、MCP-1和ICAM-1 mRNA表达水平以±s表示,多组间样本均数比较用方差分析,两组间样本均数比较采用t检验。
2 结果
2.1 高糖培养的GMC培养上清中MDA水平和GSH-Px、SOD及CAT活性高糖条件培养GMC 48 h,与正常糖组比较,高糖组细胞培养上清中MDA水平明显升高(P<0.05),GSH-Px、SOD 和CAT活性明显降低(P<0.05或P<0.01)。与高糖组比较,40和80μmol·L-1单宁酸处理组MDA水平明显降低(P<0.05),不同浓度单宁酸处理组GSH-Px、SOD和CAT活性明显升高(P<0.05)。见表1。
表1 高糖培养的GMC培养上清中MDA水平和GSH-Px、SOD及CAT活性Tab.1 Levels of MDA and activities of GSH-Px,SOD and CAT in GMC supernatant cultured with high glucose (n=5,±s)
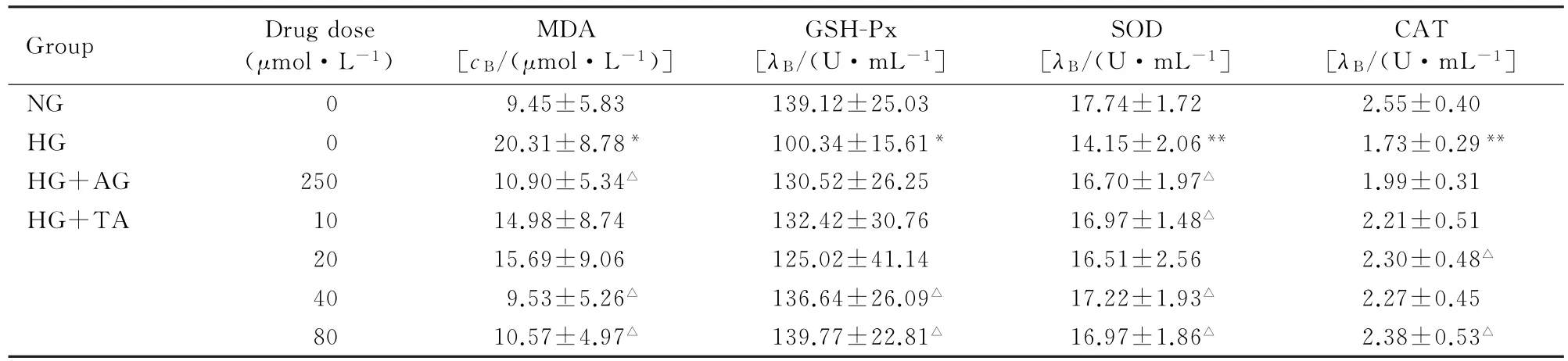
表1 高糖培养的GMC培养上清中MDA水平和GSH-Px、SOD及CAT活性Tab.1 Levels of MDA and activities of GSH-Px,SOD and CAT in GMC supernatant cultured with high glucose (n=5,±s)
∗P<0.05,∗∗P<0.01 vs NG group;△P<0.05 vs HG group.
Group Drug dose (μmol·L-1) MDA [cB/(μmol·L-1)] GSH-Px [λB/(U·m L-1] SOD [λB/(U·m L-1] CAT [λB/(U·m L-1] NG 0 9.45±5.83 139.12±25.03 17.74±1.72 2.55±0.40 HG 0 20.31±8.78∗100.34±15.61∗14.15±2.06∗∗1.73±0.29∗∗HG+AG 250 10.90±5.34△130.52±26.25 16.70±1.97△1.99±0.31 HG+TA 10 14.98±8.74 132.42±30.76 16.97±1.48△2.21±0.51 20 15.69±9.06 125.02±41.14 16.51±2.56 2.30±0.48△40 9.53±5.26△136.64±26.09△17.22±1.93△2.27±0.45 80 10.57±4.97△139.77±22.81△16.97±1.86△2.38±0.53△
2.2 AGEs处理的GMC培养上清中MDA水平和GSH-Px、SOD及CAT活性与BSA组比较, AGEs组GSH-Px、SOD和CAT活性显著降低(P<0.05或P<0.01),MDA水平明显升高(P<0.01)。与AGEs组比较,单宁酸处理组GSH-Px、SOD和CAT活性明显升高(P<0.05或P<0.01),MDA水平明显降低(P<0.05或P<0.01),且呈浓度依赖效应,以80μmol·L-1单宁酸效果最为显著。见表2。
2.3 高糖培养的GMC培养上清中8-OHdG水平正常糖组8-OHdG水平较低,高糖组8-OHdG水平较正常糖组明显升高(P<0.01);氨基胍及单宁酸组8-OHd G水平较高糖组有所降低,其中80μmol·L-1单宁酸组8-OHdG水平明显降低,与高糖组比较差异有统计学意义(P<0.05)。见表3。
2.4 AGEs处理的GMC培养上清中8-OHd G水平BSA组8-OHdG水平较低,AGEs组8-OHdG水平较BAS组明显升高(P<0.01);与AGEs组比较,氨基胍及40、80μmol·L-1单宁酸组8-OHdG水平均明显降低(P<0.05或P<0.01),见表4。单宁酸可减少AGEs引起的细胞氧化应激增加,且这种作用呈一定浓度依赖性。
表2 AGEs处理的GMC培养上清中MDA水平和GSH-Px、SOD及CAT活性Tab.2 Levels of MDA and activities of GSH-Px,SOD and CAT in GMC supernatant treated with AGEs (n=5,±s)

表2 AGEs处理的GMC培养上清中MDA水平和GSH-Px、SOD及CAT活性Tab.2 Levels of MDA and activities of GSH-Px,SOD and CAT in GMC supernatant treated with AGEs (n=5,±s)
∗P<0.05,∗∗P<0.01 vs BSA group;△P<0.05,△△P<0.01 vs AGEs group.
Group Drug dose (μmol·L-1) MDA [λB/(U·m L-1)] GSH-Px [λB/(U·m L-1)] SOD [λB/(U·m L-1)] CAT [λB/(U·m L-1)] BSA 0 11.60±4.62 115.53±19.84 25.43±6.87 2.39±0.32 AGEs 0 25.13±11.06∗∗85.93±8.82∗15.39±3.77∗1.54±0.44∗∗AGEs+AG 250 12.93±5.66△109.33±20.63 23.84±7.18△2.05±0.37△AGEs+TA 10 15.22±9.08△107.55±20.75 21.23±6.03 1.97±0.30 20 13.13±6.22△111.73±30.30 23.00±5.37 2.11±0.34△40 12.67±5.95△△115.93±21.40△24.11±6.20△2.16±0.50△80 11.97±5.36△△114.29±23.44△27.69±6.96△△2.20±0.24△△
表3 高糖培养的GMC培养上清中8-OHdG水平Tab.3 Levels of 8-OHdG in GMC supernatant cultured with high glucose[n=3,±s,ρB/(ng·L-1)]

表3 高糖培养的GMC培养上清中8-OHdG水平Tab.3 Levels of 8-OHdG in GMC supernatant cultured with high glucose[n=3,±s,ρB/(ng·L-1)]
∗P<0.05,∗∗P<0.01 vs NG group;△P<0.05 vs HG group.
?
表4 AGEs处理的GMC培养上清中8-OHd G水平Tab.4 Levels of 8-OHd G in GMC supernatant treated with AGEs[n=3,±s,ρB/(ng·L-1)]
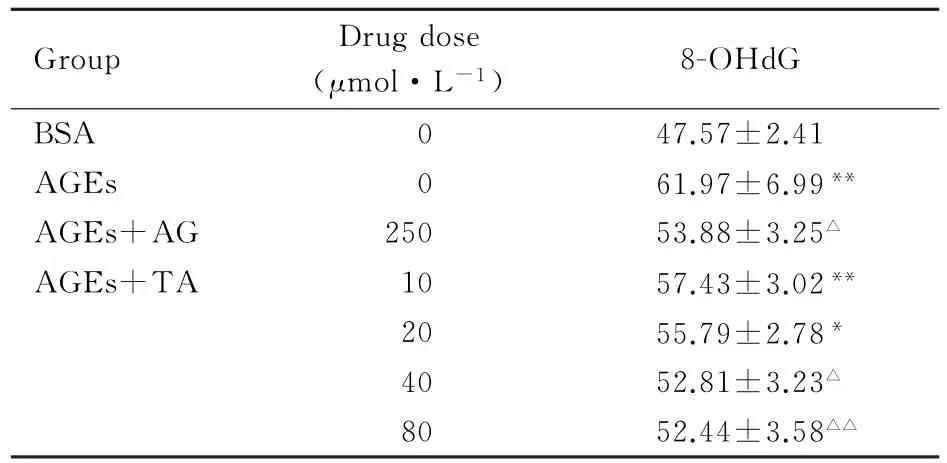
表4 AGEs处理的GMC培养上清中8-OHd G水平Tab.4 Levels of 8-OHd G in GMC supernatant treated with AGEs[n=3,±s,ρB/(ng·L-1)]
∗P<0.05,∗∗P<0.01 vs BSA group;△P<0.05,△△P<0.01 vs AGEs group.
Group Drug dose (μmol·L-1)8-OHdG BSA 0 47.57±2.41 AGEs 0 61.97±6.99∗∗AGEs+AG 250 53.88±3.25△AGEs+TA 10 57.43±3.02∗∗20 55.79±2.78∗40 52.81±3.23△80 52.44±3.58△△
2.5 高糖培养的GMC中ICAM-1蛋白表达水平高糖可明显刺激GMC中ICAM-1蛋白表达,单宁酸可降低GMC中ICAM-1蛋白表达。采用病理图像分析系统进行蛋白阳性表达率统计,结果显示:40和80μmol·L-1单宁酸组ICAM-1表达水平(38.47%±10.13%和29.11%±8.74%)较高糖组(82.14%±14.43%)明显减少(P<0.05)。见图1(插页四)。
2.6 AGEs处理的GMC中ICAM-1蛋白表达水平AGEs可刺激GMC中ICAM-1蛋白表达,40和80μmol·L-1单宁酸组ICAM-1表达水平(43.47%±12.56%和32.28%±10.17%)较AGEs组(79.62%±15.43%)明显减少(P<0.05)。见图2(插页四)。
2.7 高糖培养的GMC中MCP-1和ICAM-1 m RNA表达水平高糖刺激GMC 48 h,MCP-1 和ICAM-1 m RNA表达水平均明显高于正常糖组(P<0.01)。40和80μmol·L-1单宁酸组MCP-1 m RNA表达水平明显低于高糖组(P<0.05或P<0.01);单宁酸组ICAM-1 mRNA表达水平低于高糖组(P<0.01)。单宁酸以剂量依赖方式降低高糖诱导的GMC中MCP-1及ICAM-1基因转录水平。见表5和图3。
表5 各组GMC中MCP-1和ICAM-1 m RNA表达水平Tab.5 Expression levels of MCP-1 and ICAM-1 m RNA in GMC in various groups(n=3,±s)

表5 各组GMC中MCP-1和ICAM-1 m RNA表达水平Tab.5 Expression levels of MCP-1 and ICAM-1 m RNA in GMC in various groups(n=3,±s)
∗P<0.05,∗∗P<0.01 vs NG group;△P<0.05,△△P<0.01 vs HG group.
Group Drug dose (μmol·L-1)MCP-1/GAPDH ICAM-1/GAPDH NG 0 0.27±0.03 0.72±0.07 HG 0 0.47±0.04∗∗1.16±0.12∗∗HG+AG 250 0.36±0.09△0.97±0.07∗∗△HG+TA 10 0.39±0.06∗0.96±0.13∗∗△△20 0.40±0.08∗0.87±0.05∗△△40 0.35±0.05△0.86±0.02△△80 0.32±0.03△△0.84±0.03△△
3 讨论

图3 各组GMC中MCP-1和ICAM-1 m RNA表达电泳图Fig.3 Electrophoregram of expressions of MCP-1 and ICAM-1 mRNA in GMC in various groupsM:DNA marker DL 2000;Lane 1:NG group;Lane 2:HG group; Lane 3:HG+AG group;Lane 4-7:HG+TA groups(10,20,40, and 80μmol·L-1).
GMC是肾小球中功能最活跃的固有细胞,功能极其复杂,在DN的发生发展中起重要作用[3-4]。在多种因素作用下,GMC可发生异常增殖,同时伴有细胞外基质(extracellular matrix,ECM)的增多、细胞因子分泌及各种炎症因子受体的表达,最终导致肾小球硬化,GMC是研究肾小球疾病发病机制的一种重要靶细胞。高血糖是引起DN的始动因素,持续高血糖状态下体内蛋白质发生非酶促糖基化反应和最后形成AGEs是DN的重要发病机制[5-6]。此外,DM时高糖诱导或通过非酶糖基化及脂质过氧化等过程可导致活性氧(reactive oxygen species,ROS)产生增加,抗氧化防御体系减弱也会使ROS大量生成。ROS可干扰正常葡萄糖代谢、参与DM肾小球血流动力学变化,使肾组织内ECM代谢紊乱,并参与ECM降解酶系统的调节[7]。此外,ROS与细胞跨膜信号通路、肾组织炎症和足细胞损伤密切相关[8-9]。
本研究前期动物实验[10]结果表明:单宁酸处理的DM大鼠较模型组大鼠肾组织及血清抗氧化酶活性显著升高,MDA水平下降,提示单宁酸能提高DM大鼠体内抗氧化能力,抑制脂质过氧化反应,调整体内氧自由基代谢紊乱状态。在体外实验中,用高糖及AGEs刺激培养GMC发现:单宁酸可抑制高糖及AGEs刺激引起的GMC增殖及Ⅳ型胶原生成[11]。为了进一步探讨其作用机制,本实验检测了细胞培养上清中MDA水平和抗氧化酶(SOD、GSH-px及CAT)的活力,并检测细胞培养上清中8-OHdG水平,用以衡量细胞的氧化应激状态。本实验结果表明:高糖及AGEs刺激GMC 48 h后,培养上清中MDA水平增加,抗氧化酶活力明显降低,提示高糖及AGEs均可以使细胞处于氧化应激状态。同时,在培养上中清检测到较高水平8-OHdG,提示在高糖及AGEs刺激作用下,GMC存在细胞核DNA或线粒体DNA的氧化损伤。在上述2种条件下,单宁酸均可有效提升抗氧化酶活力,减少MDA生成,单宁酸处理组细胞培养上清8-OHdG水平也有所减少。本研究结果进一步证实单宁酸可减少由高糖及AGEs引起的细胞内氧化应激增加,表明单宁酸具有明显的抗氧化活性。分析原因可能是因为单宁酸是一种多元酚结构化合物,其特点是含有较多的苯羟基,具有很强的供氢能力,能清除氧自由基达到抗氧化作用。Quagliaro等[12]研究提示:8-OHdG可以改变丝裂原活化蛋白激酶通路,促进细胞凋亡及DNA氧化应激损伤,这些效应促进DM并发症的发生与发展。单宁酸可以减少8-OHd G生成,防止细胞DNA损伤,进而延缓DN的进程及改善肾脏免受氧化损伤。
一般认为:DN是由于长期代谢异常引起的继发性疾病,并非一种免疫性疾病,故很少从炎症角度对其发病机制进行研究。然而炎症介质在DN的发病中可能起重要的作用[13]。ICAM-1是由细胞产生的介导细胞与细胞之间或细胞与基质之间相互作用的一类膜表面糖蛋白分子。在正常情况下,肾小球内不表达或低表达ICAM-1。ICAM-1高表达可促使单核巨噬细胞在肾脏浸润,其表达增加的水平与巨噬细胞浸润程度相平行。浸润的巨噬细胞释放各种炎性因子如IL-1和TGF-β等,进一步促进炎性细胞的浸润,导致ECM产生增多和降解减少,参与肾小球硬化的发生过程[14]。MCP-1是一种对单核细胞有特异趋化作用的炎症细胞因子,能特异性地趋化激活单核巨噬细胞,是炎症趋化因子超家族中的成员之一,而炎症趋化因子超家族在炎症中发挥中心作用[15]。本研究结果显示:高糖及AGEs可诱导GMC表达过量ICAM-1,并增加GMC中MCP-1及ICAM-1基因转录水平,进一步提示炎症介质表达增加在促进GMC活化、增殖及ECM积聚,进而引起肾小球硬化方面可能起重要作用。单宁酸是从多种树木、果实及中药中提取的一种具有广泛药理活性的化合物,具有抗氧化、抗肿瘤、抗炎和调节糖脂代谢等作用[16-17]。单宁酸能减少GMC中ICAM-1蛋白表达并下调MCP-1和ICAM-1基因转录水平,减少炎症介质对GMC的损伤,从而起到保护GMC的作用。
综上所述,单宁酸可改变GMC的生物学行为,保护GMC免受氧化应激及炎症介质的损伤,减少ECM合成,促使系膜基质代谢处于稳态,这可能是单宁酸改善DN肾小球病变所起的关键作用。本研究在细胞水平为单宁酸有效防治DN提供了进一步的理论依据。
[1]Bucan K,Ivanisevic M,Zemunik T,et al.Retinopathy and nephropathy in type 1 diabetic patients-association with polymorphysms of vitamin D-receptor,TNF,Neuro-D and IL-1 receptor 1 genes[J].Coll Antropol,2009,33(2):99-105.
[2]魏海峰,李 才,魏雁虹,等.鞣酸对糖尿病大鼠肾脏功能和形态改变的影响[J].中国老年学杂志,2010,30(6):754-757.
[3]Schocklmann HO,Lang S,Sterzel RB.Regulation of mesangial cell proliferation[J].Kidney Int,1999,56(4): 1199-1207.
[4]Tang DQ,Wei YQ,Yin XX,et al.In vitro suppression of quercetin on hypertrophy and extracellular matrix accumulation in rat glomerular mesangial cells cultured by high glucose[J].Fitoterapia,2011,82(6):920-926.
[5]Sourris KC,Forbes JM.Interactions between advanced glycation end-products(AGE)and their receptors in the development and progression of diabetic nephropathy-are these receptors valid therapeutic targets[J].Curr Drug Targets,2009,10(1):42-50.
[6]路 艳,张春艳,王聪霞,等.高糖对MMP-2与TIMP-2的表达及血管平滑肌细胞增殖的影响[J].西安交通大学学报:医学版,2012,33(3):312-315.
[7]Li J,Bai X,Cui S,et al.Effect of rapamycin on high glucoseinduced autophagy impairment,oxidative stress and premature senescence in rat mesangial cells in vitro[J].Nan Fang Yi Ke Da Xue Xue Bao,2012,32(4):467-471.
[8]Eid AA,Koubeissi A,Bou-Mjahed R,et al.Novel carbocyclic nucleoside analogs suppress glomerular mesangial cells proliferation and matrix protein accumulation through ROS-dependent mechanism in the diabetic milieu[J].Bioorg Med Chem Lett,2013,23(1):174-178.
[9]Xie X,Peng J,Chang X,et al.Activation of Rho A/ROCK regulates NF-κB signaling pathway in experimental diabetic nephropathy[J].Mol Cell Endocrinol,2013,369(1/2):86-97.
[10]魏海峰,魏雁虹,李 才,等.单宁酸对糖尿病大鼠抗氧化能力及体外蛋白质非酶糖基化作用的影响[J].中国实验诊断学,2011,15(6):977-979.
[11]魏海峰,李 才,魏雁虹,等.单宁酸对高糖及AGEs引起肾小球系膜细胞增殖和Ⅳ型胶原生成的影响[J].中国实验诊断学,2010,14(4):496-498.
[12]Quagliaro L,Piconi L,Assaloni R,et al.Intermittent high glucose enhances apoptosis related to oxidative stress in human umbilical vein endothelial cells:the role of protein kinase C and NAD(P)H oxidase activation[J].Diabetes,2003, 52(11):2795-2804.
[13]Turtle KR.Linking metabolism and immunology:diabetic nephropathy is an inflammatory disease[J].J Am Soc Nephro1,2005,16(6):1537-1538.
[14]Rister BL,Cortes P,Zhao X,et al.Intraglomerular pressure and mesangial stretching stimulate extracellular matrix formation in the rat[J].J Clin Invest,1992,90(5):1932-1943.
[15]Liu J,Li Y,Liu MD,et al.Effects of megsin gene transfection on the expressions of MCP-1 and ICAM-1 in mouse glomerular mesangial cells[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2012,28(7):702-705.
[16]周本宏,王慧媛,郭志磊,等.石榴皮鞣质对羟自由基和超氧阴离子自由基的清除作用[J].中国医院药学杂志,2008, 28(17):1442-1445.
[17]王 川.葡萄籽单宁的抗氧化性研究[J].食品科技,2009, 34(2):184-187.
[18]赵焕焕,贾 陆,裴迎新.黄秋葵粗多糖体外抗氧化活性测定[J].郑州大学学报:医学版,2012,47(1):40-43.
Ameliorating effect of tannic acid on high glucose or AGEs induced oxidative stress and micro-inflammatory state in glomerular mesangial cells
WEI Hai-feng1,LI Cai2,FANG Yan-qiu1,WEI Yan-hong3,TAN Yan1
(1.Central Laboratory,People’s Hospital,Jilin Province,Changchun 130021,China; 2.Institute for Translational Medicine,Jilin University,Changchun 130021,China; 3.Department of Laboratory,People’s Hospital,Jilin Province,Changchun 130021,China)
ObjectiveTo investigate the effect of tannic acid on glomerular mesangial cells(GMC),and to clarify the mechanism of tannic acid in improving the pathological changes of diabetic nephropathy(DN)from the aspect of oxidative stress and micro-inflammation.Methods The glomerular mesangial cells were treated with glucose (30 mmol·L-1)or advanced glycosylation end-products(AGEs)bovine serum albumin(BSA)(250 mg·L-1)and then different concentrations of tannic acid(10,20,40 and 80μmol·L-1)were added into the GMC.The cellscultured by normal glucose or treated with BSA were used as control groups and then the level of malonic dialdehyde (MDA),glutathione peroxidase(GSH-Px),superoxide Dismutase(SOD),CAT(Catalase)activities and 8-hydroxy-2′-deoxyguanosine(8-OHd G)levels in the culture supernatant 48 h after culture were determined by colorimetry and ELISA method.The expressions of intercellular cell adhesion molecule-1(ICAM-1)protein, monocyte chemotactic protein 1(MCP-1)and ICAM-1 m RNA in GMC were detected by immunohistochemical staining and RT-PCR method.ResultsCompared with high glucose and AGEs groups,the MDA levels in tannic acid groups were reduced significantly(P<0.05);the activities of GSH-Px,SOD and CAT were increased significantly(P<0.05 or P<0.01);the 8-OHd G levels in annic acid groups were significantly reduced(P<0.05).Compared with high glucose and AGEs groups,the expressions levels of ICAM-1 protein in 40 and 80μmol·L-1tannic acid groups were decreased(P<0.05).The m RNA expressions levels of MCP-1 and ICAM-1 were significantly lower than those in high glucose group(P<0.01).ConclusionTannic acid could protect GMC against the damage of oxidative and inflammatory mediators,thereby delaying and improving the glomerular lesions of DN.
tannic acid;diabetic nephropathy;oxidative stress;micro-inflammation;8-hydroxy-2'-deoxyguanosine
R-332;R587.1
A
2013-11-14
吉林省科技厅重点实验室项目资助课题(20122113)
魏海峰(1978-),男,吉林省长春市人,医学博士,主要从事糖尿病及肿瘤分子病理学基础与临床研究。
谭 岩(Tel:0431-85595141,E-mail:tanyan49@hotmail.com)
1671-587Ⅹ(2014)05-1007-06
10.13481/j.1671-587x.20140520

