登革病毒包膜蛋白的原核表达及免疫原性研究
房树玉,吴艳花,崔晓云,范东瀛,安静
首都医科大学基础医学院病原生物学系微生物学教研室,北京 100069
登革病毒(dengue virus)是登革热(dengue fever,DF)、登革出血热(dengue hemorrhagic fever,DHF)/登革休克综合征(dengue shock syndrome,DSS)的病原体,主要传播媒介为埃及伊蚊和白纹伊蚊,人类和灵长类动物是登革病毒的自然宿主。自1780年美国费城首次报道登革热流行以来,登革热和登革出血热在世界各地的流行暴发不断被报道。我国登革热的主要流行地区是广东、云南、台湾等地区,近年来其发病率呈显著上升趋势,流行范围也不断扩大。根据世界卫生组织(World Health Organization,WHO)报道,全球每年有5 000万~1 亿例登革热患者,死亡2.5 万例,其中90%发生在15岁以下儿童中,由此可见登革热已成为热带和亚热带地区严重的公共卫生问题[1]。
登革病毒属于黄病毒科黄病毒属,为有包膜的单股正链RNA病毒。基因组长约11 kb,病毒RNA的5′端有一个Ⅰ型帽子结构,3′端不含多聚腺嘌呤(poly A)尾,其余核苷酸形成单一开放读码框架,编码至少3种结构蛋白:衣壳蛋白(capsid protein,C蛋白)、膜蛋白(membrane protein,M蛋白)、包膜蛋白(envelope protein,E蛋白),以及7种非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b和NS5)[2]。 E蛋白是登革病毒中颗粒最大的结构蛋白和主要包膜糖蛋白,相对分子质量为51 000~60 000,含489~495个氨基酸,其中N端约80%为胞外结构域,C端约20%为疏水跨膜区[3]。E蛋白在病毒吸附、与宿主细胞膜融合及病毒组装过程中具有重要作用[4]。它既有黄病毒亚群和登革病毒血清型特异的抗原表位,又有与中和抗体及血凝素抑制抗体反应的抗原决定簇,故在病毒的致病和免疫过程中起十分重要的作用[5,6]。因此,研究E蛋白的功能及其在疾病诊断和防治中的应用价值目前备受关注。本研究对登革病毒E蛋白的原核表达条件进行优化,探索可溶性E蛋白表达量较高的表达条件;在此基础上进一步纯化蛋白,获得浓度和纯度较高的目的蛋白,再用其免疫小鼠可诱发较强的体液免疫应答,初步表明了其在诊断和预防登革病毒感染中的潜在价值,为进一步研究奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1病毒株、菌株和质粒登革病毒2型(TR1751株)分离自登革热患者血清,重组pReceiver-E质粒为本实验室构建,pGEX-6P-1为本实验室保存,表达菌BL21(DE3)购自北京鼎国昌盛生物技术有限责任公司。
1.1.2主要试剂树脂型质粒DNA小量提取试剂盒购自北京赛百盛基因技术有限公司,谷胱甘肽琼脂糖凝胶4B亲和层析柱购自GE Healthcare,EcoR Ⅰ和XhoⅠ限制性内切酶购自Fermentas公司,聚偏氟乙烯(polyvinylidene difluoride,PVDF)膜购自Millipore公司,低相对分子质量蛋白标准购自Fermentas公司,异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)购自Genview公司,E蛋白的单克隆抗体购自北京华大蛋白质研发中心有限公司。
1.2 方法
1.2.1登革病毒2型E蛋白基因的扩增及重组质粒E/pGEX-6P-1的构建与鉴定以pReceiver-E重组质粒为模板,扩增目的基因E蛋白基因胞外区片段,用EcoRⅠ和XhoⅠ酶切,与同样酶切的pGEX-6P-1连接,构建重组质粒E/pGEX-6P-1,通过聚合酶链反应(polymerase chain reaction,PCR)和测序进行鉴定。
1.2.2登革病毒2型E蛋白的表达将鉴定正确的重组质粒E/pGEX-6P-1及质粒pGEX-6P-1转化至BL21感受态细胞,37 ℃恒温孵育过夜。分别挑取单菌落在含终浓度为50 μg/ml氨苄西林的LB培养基中扩大培养,按1∶100接种至3 ml 新鲜LB培养基中,37 ℃振荡培养至600 nm处的光密度(optical density,OD)值约0.6,加入IPTG(工作浓度为0.5 mmol/L),分别在37 ℃(5 h)、30 ℃(5 h)、26 ℃(5 h)、20 ℃(15 h)和16 ℃(15 h)诱导表达,并设未诱导对照、空菌对照和空载体对照。然后离心收集菌液,同时每个温度取2份等量菌液,一份用于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),分析菌体中目的蛋白的表达总量;另一份超声裂解后,离心取上清液,用SDS-PAGE分析目的蛋白的可溶性表达情况。冰浴超声裂解的条件为:功率400 kW,工作时间5 s,间隔时间12 s,工作次数99次,循环3次。破碎后的菌体在4 ℃、16 000 r/min离心10 min。利用Image J 软件分析电泳条带灰度值,确定表达最佳条件。
1.2.3重组蛋白的纯化将鉴定正确的重组菌液按1∶100转接至4 L含氨苄西林的LB培养基中,37 ℃振荡培养至OD600约0.6,加入IPTG至终浓度0.5 mmol/L,20 ℃诱导15 h后离心收集菌体;用60 ml Tris缓冲液 (20 mmol/L Tris-HCl pH 8.0、50 mmol/L NaCl) 重悬,洗1次,13 000 r/min离心收集菌体;再用60 ml裂解缓冲液悬起,置冰上用超声破碎仪裂解细菌,破碎后的菌体在4 ℃、 16 000 r/min离心10 min。用磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.3)平衡谷胱甘肽琼脂糖凝胶4B亲和层析柱。将上清液缓慢加入亲和层析柱,用至少10倍柱体积的PBS冲洗未吸附的杂蛋白,用还原型谷胱甘肽溶液(10 mmol/L 还原型谷胱甘肽、50 mmol/L Tris-HCl pH 8.0)洗脱,收集洗脱液即获得纯化的重组蛋白。测定蛋白浓度后,抽滤分装,贮存于-80 ℃。
1.2.4蛋白免疫印迹法鉴定重组蛋白纯化后的重组蛋白经12%分离胶SDS-PAGE后,一块胶用于考马斯亮蓝染色,另一块胶半干转印于PVDF膜上。与5%牛血清白蛋白(bovine serum albumin,BSA)过夜后,加入1∶500稀释的抗登革病毒2型E蛋白的单克隆抗体,37 ℃孵育1 h;用含吐温20的PBS(PBST)洗膜3次,加入1∶5 000稀释的辣根过氧化物酶(horseradish peroxidase,HRP)羊抗鼠IgG,于37 ℃孵育1 h;PBST充分洗膜3次,暗室曝光。同时设谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)作为对照(本实验室制备),以排除非特异性干扰。
1.2.5免疫小鼠并进行抗体效价测定将6周龄雌性BALB/c小鼠随机分成3组:实验组、GST对照组和空白组,每组6只。实验组注射纯化的重组E蛋白,对照组注射GST,空白组注射等量生理盐水。实验组与GST对照组注射量均为每只小鼠100 μg/次(100 μl),免疫途径为腿部肌肉和双侧后脚掌注射各50 μl。分别于第1、14、28天进行免疫。第3次免疫后2周断尾取血,离心取血清,测抗体效价。将纯化E蛋白稀释至50 μg/ml,每孔100 μl,包被96孔板,4 ℃过夜;次日PBST洗板,封闭;PBST洗板,血清以1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800梯度稀释,并加入96孔板,设置复孔、阳性对照和阴性对照,37 ℃孵育2 h;PBST洗板,加入1∶2 000 HRP标记羊抗小鼠IgG,37 ℃孵育1 h;洗板并显色,加入终止液后置酶标仪中测OD490值。
2 结果
2.1 重组质粒E/pGEX-6P-1的构建与鉴定
以pReceiver-E重组质粒为模板,扩增目的基因E蛋白基因的胞外区片段,用限制性内切酶EcoRⅠ和XhoⅠ酶切,并连接pGEX-6P-1,构建重组质粒E/pGEX-6P-1。通过PCR鉴定到1条约1 185 bp的条带,与预期大小一致(图1)。测序结果显示,重组质粒的序列与预期的序列完全一致。
2.2 登革病毒2型E蛋白的表达
将鉴定正确的含有重组质粒E/pGEX-6P-1的BL21菌液分别在37 ℃(5 h)、30 ℃(5 h)、26 ℃(5 h)、20 ℃(15 h)和16 ℃(15 h)条件下表达,并设未诱导、空菌对照和空载体对照。然后取2份等量菌液,超声裂解后,一份用SDS-PAGE分析菌体中目的蛋白的表达总量;另一份离心后取上清液,用SDS-PAGE分析目的蛋白的可溶性表达量。结果发现,除空菌对照和空载体对照外,其余各组在71 000左右均有特异表达条带。 Image J 软件分析发现,在20 ℃诱导15 h时灰度值最大,表明此条件下总目的蛋白表达量最高(图2)。离心等量破碎后的菌体,对上清液进行SDS-PAGE和蛋白灰度分析,发现可溶性蛋白表达量最大的诱导条件仍是20 ℃诱导15 h(图3)。
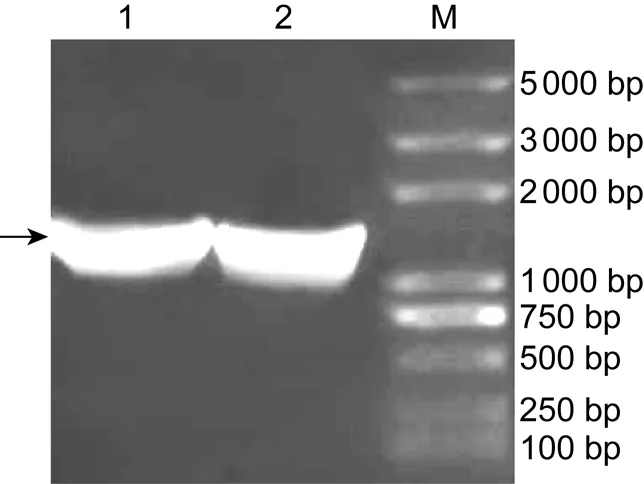
1 and 2, PCR products (recombinant E/pGEX-6P-1 as the template); M, DNA marker.

M, protein marker; 1, empty BL21 control; 2, empty plasmid pGEX-6P-1 control; 3, BL21(DE3)/pGEX-6P-1-E without induction; 4, BL21(DE3)/pGEX-6P-1-E after induction at 16 ℃ for 15 h; 5, BL21(DE3)/pGEX-6P-1-E after induction at 20 ℃ for 15 h; 6, BL21(DE3)/pGEX-6P-1-E after induction at 26 ℃ for 5 h; 7, BL21(DE3)/pGEX-6P-1-E after induction at 30 ℃ for 5 h; 8, BL21(DE3)/pGEX-6P-1-E after induction at 37 ℃ for 5 h.
图2重组质粒E/pGEX-6P-1在BL21菌中表达的SDS-PAGE分析
Fig.2SDS-PAGEanalysisoftheexpressionofrecombinantplasmidE/pGEX-6P-1inBL21

M, protein marker; 1, supernatant of BL21; 2, supernatant of empty plasmid pGEX-6P-1 control; 3, supernatant of BL21 (DE3)/pGEX-6P-1-E without induction; 4, supernatant of BL21/pGEX-6P-1-E after induction at 16 ℃ for 15 h; 5, supernatant of BL21(DE3)/pGEX-6P-1-E after induction at 20 ℃ for 15 h; 6, supernatant of BL21(DE3)/pGEX-6P-1-E after induction at 26 ℃ for 5 h; 7, supernatant of BL21(DE3)/pGEX-6P-1-E after induction at 30 ℃ for 5 h; 8, supernatant of BL21(DE3)/pGEX-6P-1-E after induction at 37 ℃ for 5 h.
2.3 登革病毒2型重组蛋白E的纯化
将含正确表达质粒的菌液扩大培养至3L培养基中,大量表达后用谷胱甘肽琼脂糖凝胶4B亲和层析柱纯化。结果显示,在71 000左右得到一条特异条带,纯度达99%以上(图4)。
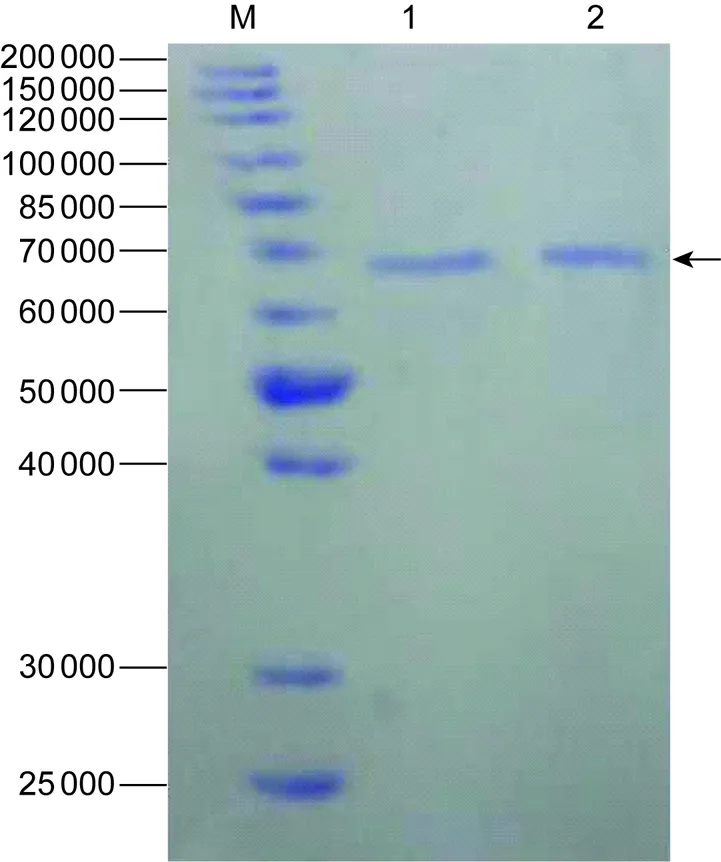
M, protein marker; 1 and 2, recombinant E protein after purification.
2.4 重组蛋白E的蛋白免疫印迹鉴定
纯化后的重组蛋白经12%分离胶SDS-PAGE后,转印于PVDF膜上。蛋白免疫印迹结果显示,纯化得到的E蛋白与登革病毒E蛋白抗体有特异印迹反应,GST对照组与抗体没有非特异性结合(图5)。

1, GST protein; 2, recombinant E protein.
2.5 免疫小鼠血清特异性抗体效价的测定
将纯化的重组蛋白E免疫BALB/c小鼠,第3次免疫后2周取血清进行酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)。结果显示,抗体效价为1∶3 200,明显高于GST和生理盐水对照组,表明纯化的重组蛋白E有较好的免疫原性。
3 讨论
登革病毒表面的E蛋白是登革病毒颗粒中最大的结构蛋白和主要包膜糖蛋白,在病毒致病过程中发挥重要作用[3,7]。E蛋白上有与宿主细胞结合的位点及4个血清型的抗原决定簇[1,8]。其特异抗体可阻止病毒的吸附和感染。Reyes-del Valle等研究发现,用纯化的登革病毒E蛋白预处理幼仓鼠肾(baby hamster kidney, BHK)细胞,可阻止病毒对细胞的吸附,是研制登革病毒疫苗的靶分子[7]。另外,E蛋白可作为一个重要成分用于病毒感染的快速诊断。因此,众多学者通过表达E蛋白而进一步研究登革病毒的致病机制及其诊断试剂和疫苗。有关登革病毒E蛋白表达及纯化的报道很多。Sugrue等利用pGEX-KG载体表达登革病毒1型E蛋白,发现E蛋白以包涵体的形式存在[9];Mason等也发现E蛋白以包涵体形式存在,且难以复性[10]。San-Miguel等研究发现,低温并延长诱导时间可增加重组蛋白在大肠埃希菌中的可溶性表达[11];Vasina等也发现,将诱导温度从37 ℃降至25 ℃,可增加原核表达系统中可溶性蛋白的量[12];本团队前期研究也曾发现目的蛋白主要以包涵体的形式存在。综合以上文献报道,本研究尝试了在低温延长诱导时间的方法,以增加可溶性蛋白的表达。在综合考虑时间和温度对目的蛋白可溶性表达的影响后,本研究设计了5个不同诱导条件。结果显示,对于登革病毒2型E蛋白,20 ℃诱导15 h条件下菌体中目的蛋白表达量及可溶性蛋白表达量相对较高。由于E蛋白C端有约100个氨基酸构成的疏水跨膜区[3],不利于可溶性蛋白表达,因此为提高目的蛋白E蛋白的表达效率,本研究去除了E 蛋白编码序列C端约300 bp的跨膜区,并以GST融合蛋白表达载体pGEX-6P-1为载体构建重组质粒,实现了温和的纯化过程。这样不但不影响蛋白的天然结构和功能,而且表达产物纯化方便,纯化蛋白的纯度较高。本实验利用纯化的E蛋白免疫BALB/c小鼠,可诱导产生1∶3 200的特异性抗体,表明所表达的蛋白具有较好的免疫原性,可用于后续相关实验研究。
本研究通过构建载体并优化表达条件获得了登革病毒E蛋白的高效可溶性表达,用谷胱甘肽琼脂糖凝胶4B亲和层析柱纯化可获得纯度较高的蛋白,ELISA结果显示该蛋白具有良好的免疫活性,这为进一步研究登革病毒的致病机制及其诊断试剂和疫苗奠定了基础。
[1] Guzman MG1, Halstead SB, Artsob H, Buchy P, Farrar J, Gubler DJ, Hunsperger E, Kroeger A, Margolis HS, Martínez E, Nathan MB, Pelegrino JL, Simmons C, Yoksan S, Peeling RW. Dengue: A continuing global threat [J]. Nat Rev Microbiol, 2010, 8(12 Suppl): S7-S16.
[2] Perera R, Kuhn RJ. Structural proteomics of dengue virus [J]. Curr Opin Microbiol, 2008, 11(4): 369-377.
[3] Jaiswal S, Khanna N, Swaminathan S. High-level expression and one-step purification of recombinant dengue virus type 2 envelope domain Ⅲ protein in Escherichia coli [J]. Protein Expr Purif, 2004, 33(1): 80-91.
[4] Crill WD, Roehrig JT. Monoclonal antibodies that bind to domain Ⅲ of dengue virus E glycoprotein are the most efficient blockers of virus adsorption to Vero cells [J]. J Virol, 2001, 75(16): 7769-7773.
[5] Chin JF, Chu JJ, Ng ML. The envelope glycoprotein domain Ⅲ of dengue virus serotypes 1 and 2 inhibit virus entry [J]. Microbes Infect, 2007, 9(1): 1-6.
[6] Modis Y, Ogata S, Clements D, Harrison SC. A ligand-binding pocket in the dengue virus envelope glycoprotein [J]. Proc Natl Acad Sci USA, 2003, 100(12): 6986-6991.
[7] Reyes-del Valle J, del Angel RM. Isolation of putative dengue virus receptor molecules by affinity chromatography using a recombinant E protein ligand [J]. J Virol Methods, 2004, 116(1): 95-102.
[8] Gromowski GD, Barrett ND, Barrett AD. Characterization of dengue virus complex-specific neutralizing epitopes on envelope protein domain Ⅲ of dengue 2 virus [J]. J Virol, 2008, 82(17): 8828-8837.
[9] Sugrue RJ, Cui T, Xu Q, Fu J, Chan YC. The production of recombinant dengue virus E protein using Escherichia coli and Pichia pastoris [J]. J Virol Methods, 1997, 69(1-2): 159-169.
[10] Mason PW, Zugel MU, Semproni AR, Fournier MJ, Mason TL. The antigenic structure of dengue type 1 virus envelope and NS1 proteins expressed in Escherichia coli [J]. J Gen Virol, 1990, 71 (Pt 9): 2107-2114.
[11] San-Miguel T, Pérez-Bermúdez P, Gavidia I. Production of soluble eukaryotic recombinant proteins in E. coli is favoured in early log-phase cultures induced at low temperature [J]. Springerplus, 2013, 2(1): 89.
[12] Vasina JA, Baneyx F. Expression of aggregation-prone recombinant proteins at low temperatures: a comparative study of the Escherichia coli cspA and tac promoter systems [J]. Protein Expr Purif, 1997, 9(2):211-218.

