子宫内膜癌组织内淋巴管的生成及其 与临床病理和预后的关系
孟晓瑜,田美丽,高 莹
(1.西安交通大学医学院第一附属医院肿瘤放疗科,陕西西安 710061; 2. 榆林市第二医院妇产科,陕西榆林 719000)
子宫内膜癌是妇科生殖系统3大恶性肿瘤之一,占女性生殖道恶性肿瘤20%~30%。Ⅰ~Ⅱ期及Ⅲ期5年总生存率为分别为92%及65%[1],肿瘤淋巴转移是子宫内膜癌预后较差的重要因素之一。淋巴管内皮细胞透明质酸受体 (lymphatic vessel endothelial hyaluronan receptor-1, LYVE-1) 是淋巴管内皮细胞标志物。本研究通过检测LYVE-1在子宫内膜癌组织中的表达情况,探讨子宫内膜癌组织内淋巴管的生成及其预后影响因素。
1 资料与方法
1.1一般资料选取2006~2011年间在西安交通大学医学院第一附属医院收治手术的子宫内膜癌患者112例,平均年龄53.2岁(42~63岁),其中年龄>55岁者58例,≤55岁者54例。手术-病理分期按照FIGO(1988年)标准进行,其中I期48例(42.9%),Ⅱ期31例(27.7%),Ⅲ期33例(29.4%)。组织学类型:子宫内膜样腺癌99例(91.9%),透明细胞癌3例(1.8%),腺鳞癌10例(6.3%);肿瘤细胞分级采用WHO的分级标准,病理分级:G1级46例(41.1%),G2级34例(30.4%),G3级32例(28.5%)。肌层浸润≤1/2者50例(44.6%),肌层浸润>1/2者62例(55.4%),伴淋巴结转移者27例(24.1%)。其中雌、孕激素受体(ER、PR)表达情况:ER和/或PR(+)者64例(57.1%),ER、PR均为(-)者48例(42.9%)。
1.2治疗情况所有患者术前均未接受放疗、化疗或激素治疗,术后41例(36.6%)患者接受了放疗,放疗采用直线加速器10 MV-X线体外照射,剂量50 Gy/25 f,其中8例(7.1 %)放疗同期加用化疗;36例(32.1%)患者接受了激素治疗。
1.3试剂及检测方法鼠抗人LYVE-1单克隆抗体购自美国R&D公司,DAB 显色剂及SP(Streptavidin/Peroxidas)免疫组化试剂盒购自北京中杉生物工程有限公司。组织中LYVE-1的表达采用免疫组化SP法检测。LYVE-1标记淋巴管内皮细胞,微淋巴管密度(lymphatic vessel density, LVD)计数参照OHNO、WEIDNER等[2-3]的方法进行,低倍镜下分别对子宫内膜癌组织肿瘤边缘(肿瘤浸润边缘区)和肿瘤中心区阳性淋巴管密集区域即“hot spot”区(即P-LVD、I-LVD)进行观察,在高倍视野200×(0.74 mm2)和400×(0.16 mm2)视野下计数LVD,每张切片随机观察3个视野,以其平均值表示。
1.4随访采用门诊、信函和电话方式随访,随访时间为4~79个月,平均53.1个月,末次随访时间为2012-08-21。
1.5统计学方法采用SPSS 13.0系统软件包进行数据处理,LVD与临床病理参数关系采用t检验及单因素分析(One-way ANOVA test),Kaplan-Meier法和Log-rank检验进行生存分析,并用Cox模型进行多因素预后分析。P<0.05为差异有统计学意义。
2 结 果
2.1子宫内膜癌中LVD与临床病理参数的关系112例子宫内膜癌组织中,发现101例肿瘤边缘区有LYVE-1+微淋巴管的表达(文献已发表),68例肿瘤中心区有LYVE-1+微淋巴管的表达,总平均P-LVD为(20.15±4.70)个/高倍视野及I-LVD为(4.34±1.17)个/高倍视野。分析子宫内膜癌组织不同区域的LYVE-1+的微淋巴管密度与临床病理参数的关系,显示P-LVD与I-LVD同肿瘤分化程度、病理类型、肌层侵袭、激素受体及年龄无相关性(P>0.05);而P-LVD与临床分期、淋巴结转移有关(P=0.04及P=0.033,表1)。
表1子宫内膜癌周边区和中心区微淋巴管计数(个/高倍视野)LVD与临床病理参数的关系
Tab.1 Relationship of P-LVD or I-LVD with clinicopathological variables in endometrial carcinoma
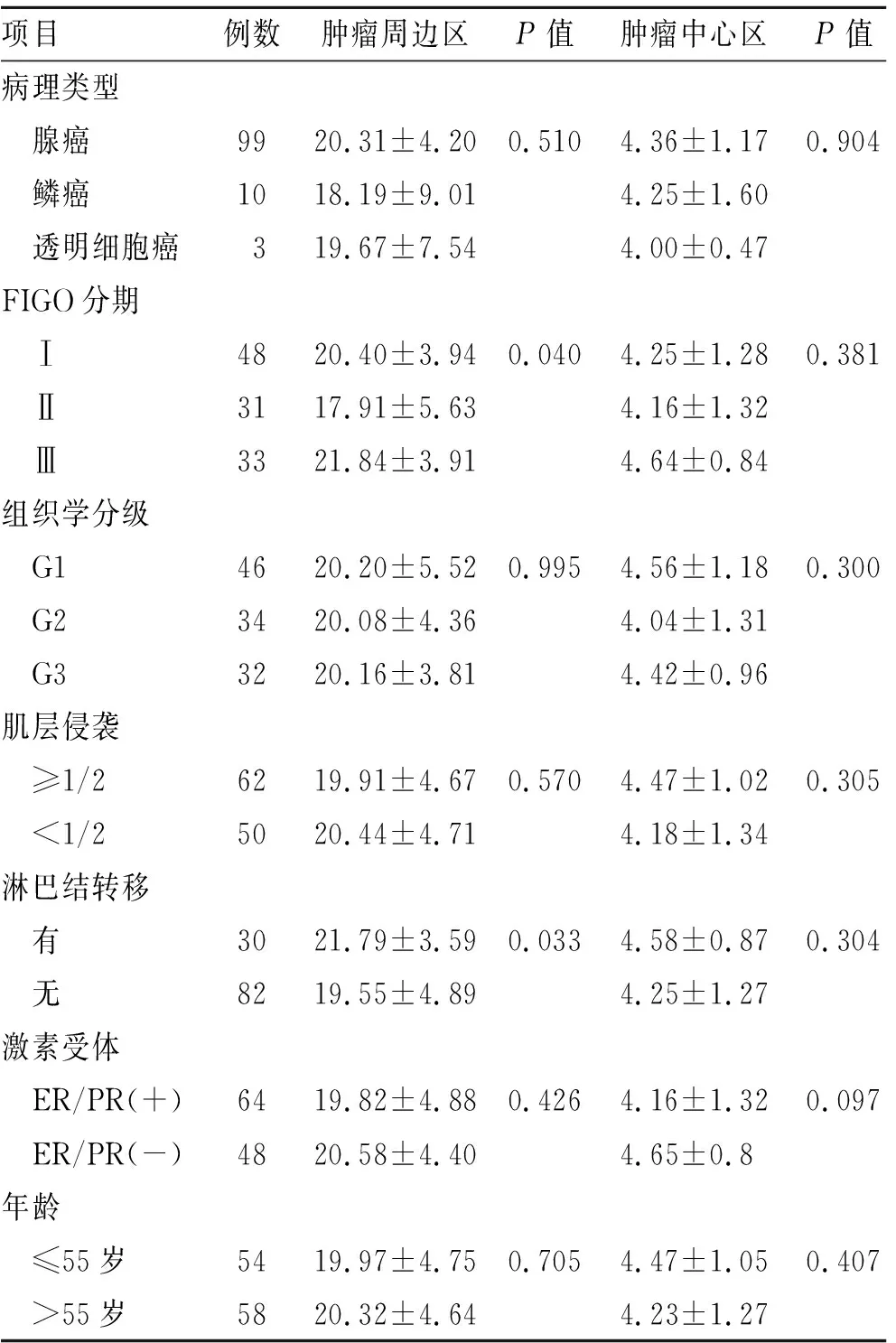
项目例数肿瘤周边区P值肿瘤中心区P值病理类型 腺癌9920.31±4.200.5104.36±1.170.904 鳞癌1018.19±9.014.25±1.60 透明细胞癌319.67±7.544.00±0.47FIGO分期 Ⅰ4820.40±3.940.0404.25±1.280.381 Ⅱ3117.91±5.634.16±1.32 Ⅲ3321.84±3.914.64±0.84组织学分级 G14620.20±5.520.9954.56±1.180.300 G23420.08±4.364.04±1.31 G33220.16±3.814.42±0.96肌层侵袭 ≥1/26219.91±4.670.5704.47±1.020.305 <1/25020.44±4.714.18±1.34淋巴结转移 有3021.79±3.590.0334.58±0.870.304 无8219.55±4.894.25±1.27激素受体 ER/PR(+)6419.82±4.880.4264.16±1.320.097 ER/PR(-)4820.58±4.404.65±0.8年龄 ≤55岁5419.97±4.750.7054.47±1.050.407 >55岁5820.32±4.644.23±1.27
2.2预后的单因素分析112例子宫内膜癌患者中死亡30例,5年总生存率为73.2%,5年无瘤生存率为67.9%。本研究将P-LVD及I-LVD根据其与总平均值相比高低各分为两组(高、低P-LVD组;高、低I-LVD组),并对P-LVD及I-LVD等10个可能与子宫内膜癌预后相关的危险因素进行了单因素Log-rank回归分析。显示P-LVD(P=0.001)、肿瘤分期(P=0.003)、肿瘤病理类型(P=0.000)、淋巴结转移(P=0.01)可显著影响子宫内膜癌患者的总生存率及无瘤生存率;高P-LVD组其总生存率及无瘤生存率明显低于低P-LVD组(P<0.01,图1);而I-LVD、患者年龄、肿瘤组织学分级程度、肌层侵袭程度、激素受体表达及术后辅助治疗方式对子宫内膜癌患者的生存均无影响(P>0.05)。
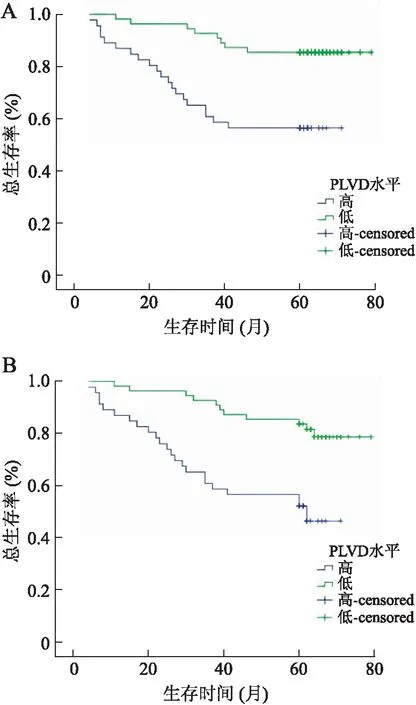
图1各组生存曲线图
Fig.1 Curve of survival in each group
A:总生存率曲线;B:无瘤生存率曲线。
2.3预后的多因素分析对生存率有影响的因素P-LVD、肿瘤分期、肿瘤病理类型及淋巴结转移进行多因素分析,结果显示,P-LVD(P=0.001),FIGO分期(P=0.004)及病理类型(P=0.001)是子宫内膜癌预后的3个独立影响因素,而淋巴结转移则是其预后的非独立影响因素(P=0.341,表2)。
表2子宫内膜癌预后多因素Cox分析
Tab.2 Cox regression analysis determining the independent effect of prognostic variables on survival
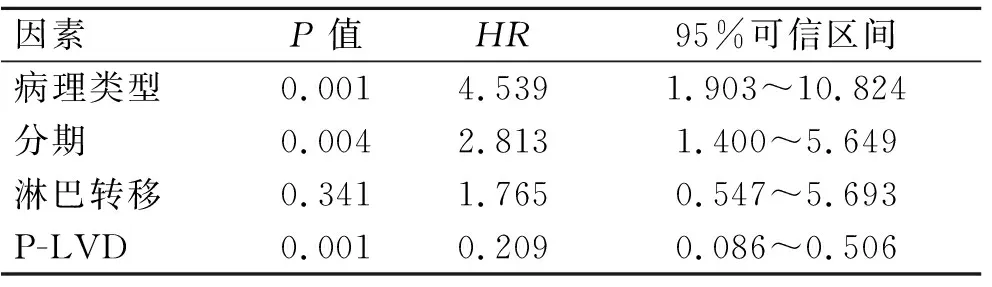
因素P值HR95%可信区间病理类型0.0014.5391.903~10.824分期0.0042.8131.400~5.649淋巴转移0.3411.7650.547~5.693P-LVD0.0010.2090.086~0.506
3 讨 论
近年来,随着大量淋巴管内皮标志物的发现,淋巴转移越来越受重视。大量研究也表明,淋巴转移在肿瘤转移过程中有重要作用,肿瘤淋巴管浸润的发生是淋巴结转移的前提。但国内外少有文献报道采用淋巴管标记物LYVE-1检测子宫内膜癌组织中微淋巴管的生成及研究LVD与其预后关系。本研究通过LYVE-1检测肿瘤组织内LVD,发现肿瘤组织内有新生淋巴管生成,且淋巴管主要位于肿瘤周边区,P-LVD明显高于I-LVD,其机制可能是肿瘤中心高的组织间隙压力导致淋巴管塌陷萎缩、闭合以及肿瘤细胞侵袭生长也可能会对新生的淋巴管产生破坏作用[4]。相反,肿瘤组织周围增多、管腔扩大的淋巴管则为肿瘤细胞扩散提供了更多的转移途径。另外LYVE-1分子还可能通过黏附作用,进一步促进肿瘤细胞淋巴管浸润和淋巴结转移[5-7],因此淋巴管主要位于瘤周将增加肿瘤淋巴转移的机会。
目前对肿瘤组织内部淋巴管在肿瘤细胞淋巴管浸润和淋巴结转移过程中是否发挥重要作用尚有争议。NATHALIE及STRAUME[8-9]对恶性黑色素瘤及喉癌采用LYVE-1标记淋巴管的研究结果,认为I-LVD在淋巴转移中有重要意义,而多数学者[5,10-11]则认为P-LVD是肿瘤预后差的指标,并未发现I-LVD在淋巴转移中的作用。本研究结果显示,Ⅲ期癌组织中的P-LVD明显高于Ⅰ~Ⅱ期的 ,有淋巴结转移子宫内膜癌中的P-LVD明显高于无淋巴结转移的,而在本研究中尚未发现与I-LVD临床病理参数有关,由此可以进一步证实P-LVD在肿瘤转移中有更重要的临床意义。这与多数研究结果[5,10-12]一致,即肿瘤组织周围的淋巴管在肿瘤细胞转移过程中可能发挥了更为重要的作用。
此外,通过对子宫内膜癌生存曲线及预后分析,本研究显示低P-LVD的患者其总生存率及无瘤生存率明显高于高P-LVD组,且P-LVD是子宫内膜癌预后的独立影响因素,提示P-LVD是判断有无远处转移及预后的重要指标。这与GAO及ZHANG[10,12]研究报道一致。另外PADERA[13]认为,血管内皮细胞生长因子(VEGF)-C的过度表达增加了肿瘤内部及肿瘤边缘淋巴管的表面积,肿瘤内部为无功能的淋巴管,肿瘤周边存在有功能的淋巴管,并足以致瘤细胞发生转移,这部分淋巴管应成为治疗的靶点。因此,检测LYVE-1+的P-LVD有望成为判断子宫内膜癌的恶性程度及生物学行为有意义的指标,用以指导对子宫内膜癌患者的临床治疗。若患者P-LVD高,可提示临床需密切随访及是否加术后放疗、化疗及生物免疫等辅助治疗;针对肿瘤周边区淋巴管的抗淋巴管生成因子也有望成为抗内膜癌治疗的靶点。但本研究结果显示P-LVD仅与FIGO分期及淋巴结转移有关,与细胞学分级、肌层浸润及病理类型等临床病理参数无关,故LYVE1目前尚不能成为子宫内膜癌的诊断指标,仅可作为一种有效的子宫内膜癌预后指标。
参考文献:
[1] KYO S, HASHIMOTO M, MAIDA Y, et al. Analysis of outcome of Stage Ⅰ-Ⅲ endometrial Cancer treated with systematic operation omitting paraaortic lymphadenectomy[J]. Eur J Gynaecol Oncol, 2007, 28(3):170-173.
[2] OHNO M, NAKAMURA T, KUNIMOTO Y, et al. Lymphagenesis correlates with expression of vascular endothelial growth factor-C in colorectal Cancer[J]. Oncol Rep, 2003, 10(4):939-943.
[3] WEIDNER N. Tumor angiogenesis: review of current applications in tumor prognostication[J]. Semin Diagn Pathol, 1993, 10(4):302-313.
[4] KATO S, SHIMODA H, JI RC, et al. Lymphangiogenesis and expression of specific molecules as lymphatic endothelial cell markers[J]. Anat Sci Int, 2006, 81(2):71-83.
[5] GAO Y, LIU Z, GAO F, et al. High density of peritumoral lymphatic vessels is a potential prognostic marker of endometrial carcinoma: a clinical immunohistochemical method study[J]. BMC Cancer, 2010: 131.
[6] JACKSON DG, PREVO K, CLASPER S, et al. LYVE-1 the lymphatic system and tumor lymphangiogenesis[J]. Trends Humanal, 2001, 22(6):317-321.
[7] PREVO R, BANERJI S, FERGUSON DJ, et al. Mouse LYVE-1 is an endocytic receptor for hyaluronan in lymphatic endothelium[J]. J Biol Chem, 2001, 276(22):19420-19430.
[8] STRAUME O, JACKSON DG, AKSLEN LA. Independent prognostic impact of lymphatic vessel density and presence of low-grade lymphangiogenesis in cutaneous melanoma[J]. Clin Cancer Res, 2003, 9(1):250-256.
[9] AUDET N, BEASLEY NJ, MACMILLAN C, et al. Lymphatic vessel density, nodal metastases, and prognosis in patients with head and neck cancer[J]. Arch Otolaryngol Head Neck Surg, 2005, 131(12):1065-1070.
[10] GAO P, ZHOU GY, ZHANG QH, et al. Clinicopathological significance of peritumoral lymphatic vessel density in gastric carcinoma[J]. Cancer Lett, 2008, 263(2):223-230.
[11] KIM HS, SUNG W, LEE S, et al. Lymphatic vessel densities of lymph node-negative prostate adenocarcinoma in Korea[J]. Pathol Res Pract, 2009, 205(4):249-254.
[12] ZHANG SQ, YU H, ZHANG LL. Clinical implications of increased lymph vessel density in the lymphatic metastasis of early-stage invasive cervical carcinoma: a clinical immunohistochemical method study[J]. BMC Cancer, 2009: 64.
[13] PADERA TP, KADAMBI A, DI TOMASO E, et al. Lymphatic metastasis in the absence of functional intratumor lymphatics[J]. Science, 2002, 296(5574):1883-1886.

