半乳糖凝集素-3和黏蛋白-1在大肠癌中的表达及意义
张心武,马双余,张 焱
(西安交通大学医学院第二附属医院普外科,陕西西安 710004)
大肠癌是常见的恶性肿瘤之一,近年来其发病率呈上升趋势,研究大肠癌发生、转移的相关因子,有助于了解其内在的机制,对探索大肠癌发生发展以及对大肠癌的诊断预后具有十分重要的意义。半乳糖凝集素-3(galectin-3, Gal-3)是一种半乳糖凝集素,黏蛋白-1(mucin-1, MUC1)是黏蛋白家族的成员之一。体外细胞培养实验研究表明,MUC1是Gal-3的一种配体,重组的Gal-3能增加表达MUC1的人乳腺癌和结肠癌细胞对人脐静脉内皮细胞的黏附性[1]。目前,国内外尚未见在结肠癌中联合检测Gal-3和MUC1的研究报道。本实验应用免疫组织化学SP法检测大肠癌组织中Gal-3和MUC1蛋白的表达,分析其与淋巴结转移之间的关系,探讨Gal-3和MUC1在大肠癌组织发生、发展过程中的调控机制,以期为大肠癌的诊断、预后判断寻找新的思路。
1 材料与方法
1.1病例选择收集2009年12月至2010年6月在西安交通大学医学院第二附属医院普通外科手术治疗的大肠癌标本45例,其中男性26例,女性19例;年龄范围39~84岁;结肠癌24例(其中盲肠4例、升结肠8例、横结肠3例、降结肠4例、乙状结肠5例),直肠癌21例;有淋巴结转移者19例,无淋巴结转移者26例;另取癌旁非肿瘤组织20例为对照组。所有患者术前均未接受放疗或化疗,术后病理证实为结肠癌或直肠癌,癌旁非肿瘤组织取自距肿瘤边缘3 cm以上正常黏膜组织。
1.2主要试剂鼠抗人Gal-3单克隆抗体(福州迈新生物技术开发有限公司,编号MAB-0572);鼠抗人MUC1单克隆抗体(北京中杉金桥生物技术有限公司,编号:ZM-0391);UltraSensitiveTM S-P 试剂盒(A试剂生物素标记的羊抗鼠lgG、B试剂链霉菌抗生物素蛋白-过氧化酶,福州迈新生物技术开发有限公司,编号:KIT-9701)。
1.3免疫组织化学SP法检测Gal-3和MUC1的表达所有标本经100 mL/L甲醛固定,常规石蜡包埋,切片,分别行免疫组化染色,具体操作步骤按试剂说明书进行。抗原修复采用EDTA加热抗原修复,取EDTA抗原修复液10 mL,按1∶50的比例稀释。双氧水阻断内源性过氧化物酶,山羊血清封闭,滴加适当稀释浓度(MUC1为1∶100,Gal-3为即用型)的第一抗体, 滴加UltraSensitiveTM S-P试剂盒A试剂生物素标记的羊抗鼠lgG,滴加UltraSensitiveTM S-P试剂盒B试剂链霉菌抗生物素蛋白-过氧化酶,DAB显色,苏木精复染,中性塑胶封固。
Gal-3以甲状腺乳头状瘤作为阳性对照,MUC1以乳腺癌作为阳性对照。两者均以PBS代替一抗作阴性空白对照。
1.4阳性结果判定Gal-3主要表达于胞质内,也可在胞核表达;MUC1主要表达于胞质内,也可表达于胞膜,染色呈淡黄色、棕黄色及棕褐色;在400倍视野下每张切片随机观察4个视野,对着色细胞进行计数,计算阳性细胞所占百分比。以定位明确、染色明显者为阳性,而染色弱或完全不染色者为阴性,阳性细胞≤25%为(-),26%~50%为(+),51%~75%为(),>75%为(),将(-)记为阴性标本,(+)、()及()定为阳性标本。
1.5统计学方法应用SPSS 13.0统计软件,对于计数资料采用χ2检验、连续校正的χ2检验、确切概率法,P<0.05为差异有统计学意义。
2 结 果
2.1Gal-3在各组的表达结果Gal-3在癌旁组织、大肠癌组织的阳性表达率分别为15.0%(3/20)和73.3%(33/45)。大肠癌组明显高于癌旁组织组,表达差异有统计学意义(P<0.01,图1、表1)。
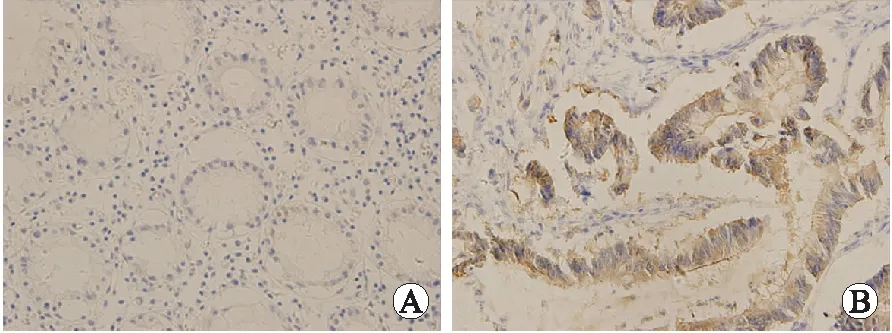
图1Gal-3在癌旁非肿瘤组织(A)及大肠癌(B)中的表达
Fig.1 Expression of Gal-3 in normal tissue adjacent carcinoma (A) and colorectal cancer (B) (×400)
表1Gal-3在大肠癌及癌旁组织的表达结果比较
Tab.1 Expression of Gal-3 in colorectal cancer and normal tissue adjacent carcinoma

组 别Gal-3阳性阴性阳性率(%)χ2P大肠癌癌旁组织333121773.315.019.07<0.01
2.2MUC1在各组的表达结果MUC1在癌旁组织和大肠癌组织中的阳性表达率分别为0.0%(0/20)、55.6%(25/45),大肠癌中的表达明显高于癌旁组织,差异有统计学意义(P<0.005,图2、表2)
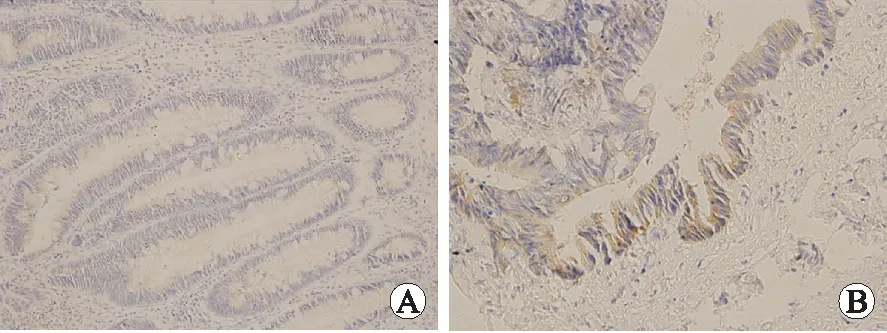
图2MUC1在癌旁非肿瘤组织(A,×200)及大肠癌中(B,×400)的表达
Fig.2 Expression of MUC1 innormal tissue adjacent carcinoma (A, ×200) and colorectal cancer (B, ×400)
表2MUC1在各组中的表达结果比较
Tab.2 Expression ofMUC1 in colorectal cancer and normal tissue adjacent carcinoma

组 别MUC1阳性阴性阳性率(%)χ2P大肠癌癌旁组织250202055.60.018.06<0.01
2.3Gal-3、MUC1与淋巴结转移的关系Gal-3的阳性表达率在无淋巴结转移组为61.5%(16/26),在淋巴结转移组为89.5%(17/19),表达差异有统计学意义(P=0.0363)。MUC1的阳性表达率在无淋巴结转移组为34.6%(9/26),在淋巴结转移组为84.2%(16/19),表达差异有统计学意义(P=0.0009,表3)。
表3Gal-3,MUC1与大肠癌淋巴转移的关系
Tab.3 Relationship of Gal-3 and MUC1 expressions with lymphatic metastasis in colorectal cancer
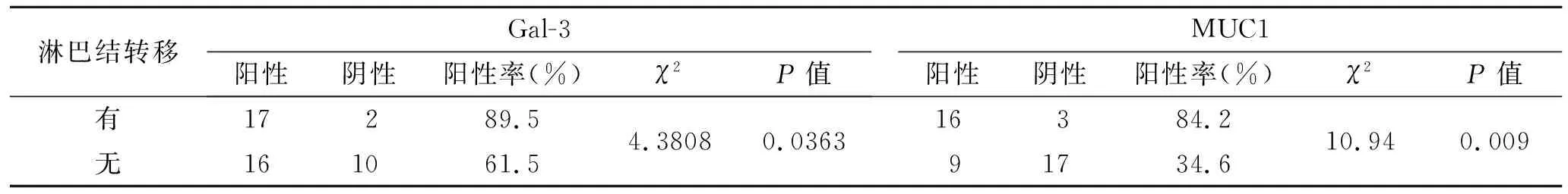
淋巴结转移Gal-3阳性阴性阳性率(%)χ2P值MUC1阳性阴性阳性率(%)χ2P值有无171621089.561.54.38080.036316931784.234.610.940.009
3 讨 论
研究表明,Gal-3参与了细胞恶变、新生血管形成、免疫逃避、肿瘤栓塞等多种病理过程,其在甲状腺癌、膀胱癌、喉鳞癌、肾癌等肿瘤中均过表达[2-6]。其参与肿瘤发生发展的作用机制可能有以下方面: Gal-3的糖亲和性促进血管内皮细胞和平滑肌细胞的有丝分裂,参与肿瘤形成过程中的血管生成[7];Gal-3是MMP-2/-9的裂解底物,目前已经明确MMP-2/-9的高表达与肿瘤的演进相关,故Gal-3可能也在肿瘤的侵袭转移中发挥作用[8];Gal-3与Bcl-2有相似的抗凋亡功能的结构序列,即羧基端包含一个NWGR四级结构,因此Gal-3抗凋亡机制可能与Bcl-2有关[9]。Gal-3诱导肿瘤细胞的聚集导致肿瘤栓塞机体微血管,有利于肿瘤细胞与血管内皮细胞结合,从而使肿瘤细胞溢出而增加转移潜能[10]。
MUC1具有调节细胞间相互作用,介导细胞间信号转导并参与机体免疫调节等功能。近年来MUC1在肿瘤进展和转移中的作用较受重视。研究发现,肿瘤细胞上MUC1的糖基化不全,可作为半抗原而诱发抗肿瘤CTL免疫应答;同时还能抑制免疫活性细胞对肿瘤细胞的杀伤作用,MUC1高表达的肿瘤患者预后差,表明MUC1参与了机体免疫调节[11]。MUC1有黏附及抗黏附的双重作用,其可下调E-钙黏蛋白的表达[12],而E-钙黏蛋白是一种钙离子依赖的细胞黏附分子,介导细胞间的粘附,故认为MUC1可参与抗黏附作用。还有研究认为,MUC1在癌细胞表面形成高密度的丝状分子,且MUC1糖链中含有唾液酸而使细胞带有负电荷,使癌细胞从原发灶脱落,从而利于瘤细胞的转移[13]。还有研究表明,MUC1激活TNF受体相关因子等抗凋亡基因的表达,抑制细胞凋亡;还可诱导血管内皮生长因子等的生成,促进肿瘤转移和血管形成[14]。
RAMASAMY等[15]研究认为,MUC1是Gal-3的配体,Gal-3为MUC1和表皮生长因子受体(EGFR)之间形成一个桥梁,并且Gal-3在EGF介导的MUC1和EGFR之间相互作用中是不可或缺的,认为MUC1-C-Gal-3作为依赖MiR-322的调控环的一部分而发挥作用,而EGFR在调节肿瘤细胞的生长、修复和生存、新生血管生成、侵袭和转移中具有重要作用,故认为Gal-3与MUC1在肿瘤的进展过程中起作用。
目前,国内外尚未见在大肠癌中联合检测Gal-3与MUC1的研究报道。本实验应用免疫组织化学SP法检测45例大肠癌中Gal-3与MUC1表达,结果表明大肠癌中Gal-3的表达明显高于癌旁非肿瘤组织,差异具有统计学意义,且伴淋巴结转移者Gal-3的阳性表达率明显高于无淋巴结转移者。MUC1在癌旁组织及大肠癌中的表达分别为0.0%(0/20)和55.6%(25/45),伴淋巴结转移者MUC1的阳性表达率为84.2%(16/19),高于无淋巴结转移者的34.6%(9/26),差异均具有统计学意义。研究结果表明,Gal-3和MUC1在大肠癌的发生及转移中均具有重要作用。
因此,Gal-3和MUC1与大肠癌发生、转移均有着密切的关系,共同检测这两个指标有望用于大肠癌的诊断及作为大肠癌预后的判断指标。此外,Gal-3与MUC1在免疫及基因治疗方面已有研究,这为大肠癌的基因和免疫治疗也提供了一个新的思路。
参考文献:
[1] YU LG, ANDREWS N, ZHAO Q, et al. Galectin-3 interaction with Thomsen-Friedenreich disaccharide on cancer-associated MUC1 causes increased cancer cell endothelial adhesion[J]. J Biol Chem, 2007, 282(1):773-781.
[2] BARTOLAZZI A, BELLOTTI C, SCIACCHITANO S. Methodology and technical requirements of the galectin-3 test for the preoperative characterization of thyroid nodules[J]. Appl Immunohistochem Mol Morphol, 2012, 11(7):111-112.
[3] MATOS LL, DEL GIGLIO AB, MATSUBAYASHI CO, et al. Expression of ck-19, galectin-3 and hbme-1 in the differentiation of thyroid lesions: systematic review and diagnostic meta-analysis[J]. Diagn Pathol, 2012, 34(7):144-147.
[4] SAKAKI M, FUKUMORI T, FUKAWA T, et al. Clinical significance of Galectin-3 in clear cell renal cell carcinoma[J]. J Med Invest, 2010, 57(1-2):152-157.
[5] CANESIN G, GONZALEZ-PERAMATO P, PALOU J, et al. Galectin-3 expression is associated with bladder Cancer progression and clinical outcome[J]. Tumour Biol, 2010, 31(4):277-285.
[6] 马丽华,刘萱,刘华,等. 喉鳞癌中Galectin-3蛋白的表达及意义[J]. 中国实验诊断学,2011, 15(9):1485-1487.
[7] NANGIA-MAKKER P, BACCARINI S, RAZ A. Carbohydrate-recognition and angiogenesis[J]. Cancer Metastasis Rev, 2000, 19(1-2):51-57.
[8] FUKUMORI T, TAKENAKA Y, YOSHII T, et al. CD29 and CD7 mediate galectin-3-induced type Ⅱ T-cell apoptosis[J]. Cancer Res, 2003, 63(23):8302-8311.
[9] ZUCKER S, CAO J, CHEN WT. Critical appraisal of the use of matrix metalloproteinase inhibitors in cancer treatment[J]. Oncogene, 2000, 19(56):6642-6650.
[10] INOHARA H, AKAHANI S, KOTHS K, et al. Interactions between galectin-3 and Mac-2-binding protein mediate cell-cell adhesion[J]. Cancer Res, 1996, 56(19):4530-4534.
[11] 张立新,李春海,陆雅芬,等. MUC1黏蛋白的免疫生物学作用及其在肿瘤生物治疗中的应用[J]. 中国肿瘤生物治疗杂志, 2000, 7(3):165-170.
[12] WESSELING J, VANDERVALK SW, HILKENS J. A mechanism for inhibition of E-cadherin-mediated cell-cell adhesion by the membrane-associated mucin episialin/MUC1[J]. Mol Biol Cell, 1996, 7(4):565-577.
[13] WESSELING J, VANDERVALK SW, VOS HL, et al. Episialin (MUC1) overexpression inhibits integrin-mediated cell adhesion to extra-cellular matrix comporin-mediated cell adhesion to extracellular matrix components[J]. Cell Biol, 1995, 129(1):255-265.
[14] NICKEL W. The mystery of nonclassical protein secretion. A current view on cargo proteins and potential export routes[J].Eur J Biochem, 2003, 270(10):2109-2119.
[15] RAMASAMY S, DURAISAMY S, BARBASHOV S, et al. The MUC1 and galectin-3 oncoproteins function in a microRNA-dependent regulatory loop[J]. Mol Cell, 2007, 27(6):992-1004.

