雷帕霉素对大鼠肝脏缺血再灌注损伤的保护作用
陈广顺,司中洲,李杰群,李 亭,齐海智
(中南大学湘雅第二医院普外科,湖南长沙 410011)
肝脏移植术和肝脏部分切除术通常需要阻断肝门而发生肝脏缺血再灌注损伤,加重其功能代谢障碍及组织结构破坏,合适的免疫抑制方案可有效降低排斥反应的发生[1-2]。雷帕霉素(rapamycin, RAPA)是一种新型大环内酯类免疫抑制剂,具有抗增殖、抗肿瘤及无肾毒性等特性,近年来逐渐应用于肝移植患者或其他器官移植的患者,获得了防治肝移植术后肾功能不全、慢性排斥反应和提高移植物长期存活的新途径[3-4]。本实验采用肝脏缺血再灌注模型,研究雷帕霉素对大鼠肝脏缺血再灌注损伤肝脏功能的影响和肝组织的病理学变化, 探讨雷帕霉素对肝脏缺血再灌注损伤的减轻作用及对肝细胞的保护功能。
1 材料与方法
1.1实验动物健康清洁型SD雄性大鼠54只,体质量200~250 g,购于湖南农业大学实验动物中心,适应性喂养5 d后用于试验。实验动物随机分3组:假手术组、手术组和雷帕霉素组,再灌注后以2、6、24 h为观察时相,每个观察时相6只。
1.2动物模型的建立[5-6]术前12 h禁食,自由饮水,腹腔注射30 mg/kg戊巴比妥麻醉后打开腹腔,暴露肝脏,分离显露肝门部,剪左中肝叶各韧带,游离左、中肝叶的胆管及门静脉、肝动脉分支。用血管夹钳夹后造成左、中叶肝脏缺血, 麻醉后用无损伤小血管夹阻断大鼠左半肝血供90 min,阻断后可见被阻断区肝叶颜色由鲜红色变为暗红色表明肝脏缺血成功,恢复血流进行再灌注60 min,形成肝缺血再灌注模型。假手术组仅行麻醉剖腹,解剖肝门,不行血供阻断;雷帕霉素组在肝脏缺血前5 min经肠系膜上静脉缓注5 mg/kg雷帕霉素,假手术组和手术组用同等剂量生理盐水。各组均于再灌注2、6、24 h后,取大鼠外周血血清检测肝脏功能的变化,并取缺血肝叶标本,固定于甲醛溶液用于病理学检测。
1.3检测指标及方法血清丙氨酸转氨酶(ALT),天门冬氨酸转氨酶(AST)的含量用常规生化方法测定;采用黄嘌呤氧化酶法测定血浆SOD超氧化物歧化酶(SOD)活力;硫代巴比妥酸显色法检测丙二醛(MDA);ELISA 检测血浆TNF-α和IL-1;SOD、MDA测试盒由南京建成生物工程研究所出品。肝组织病理学处理和观察:用1∶10的甲醛溶液固定新鲜肝组织, 按病理学常规制片,HE染色,光学显微镜观察。
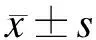
2 结 果
2.1血清ALT和AST水平的比较手术组和雷帕霉素组不同时段ALT和AST均高于假手术组,差异具有显著性(P<0.05);手术组24 h的ALT和AST分别为(377.48±35.65)IU/L和(1 106.74±102.57)IU/L,高于2 h和6 h(P<0.05);6 h的ALT和AST分别为(258.47±25.61)IU/L和(936.58±87.60)IU/L,均高于2 h(P<0.05);雷帕霉素组不同时段的ALT和AST均低于手术组,差异具有显著性(P<0.05);雷帕霉素组6 h和24 h的ALT和AST分别为(194.18±18.53)IU/L、(185.36±17.98)IU/L和(827.39±79.82)IU/L、(790.48±80.16)IU/L,均高于2 h(P<0.05)(表1)。
表1各组大鼠再灌注2、6、24h血清ALT和AST水平的比较


组 别ALT(IU/L)2h6h24hAST(IU/L)2h6h24h假手术组54.23±6.1951.68±6.2453.50±7.11132.83±14.52145.16±15.32 140.28± 13.96手术组215.16±22.46*258.47±25.61*▲377.48±35.65*▲★851.49±79.83*936.58±87.60*▲1106.74±102.57*▲★雷帕霉素组158.35±14.73*△194.18±18.53*△▲185.36±17.98*△▲716.35±70.06*△827.39±79.82*△▲790.48± 80.16*△▲
与假手术组比较,*P<0.05;与手术组比较,△P<0.05;与2 h比较,▲P<0.05;与6 h比较,★P<0.05。
2.2各组血清MDA、SOD活性的变化手术组和雷帕霉素组的MDA均高于假手术组,雷帕霉素组的MDA均低于手术组;手术组和雷帕霉素组的SOD活性均低于假手术组,雷帕霉素组的SOD均高于手术组,差异具有显著性(P<0.05);手术组24 h的MDA为(1.59±0.21)μmol/L,高于6 h(1.34±0.15)μmol/L和2 h(1.10±0.13)μmol/L,差异具有显著性(P<0.05);6 h的MDA浓度高于2 h(P<0.05);手术组和雷帕霉素组的6 h和24 h的SOD为分别为(51.42±5.19)IU/L、(49.11±5.07)IU/L和(59.17±5.62)IU/L、(58.34±5.20)IU/L,均高于2 h(P<0.05);手术组和雷帕霉素组6 h和24 h的SOD比较差异无显著性(表2)。
2.3各组血清TNF-α和IL-1活性的变化手术组和雷帕霉素组不同时段TNF-α和IL-1均高于假手术组,差异具有显著性(P<0.05);雷帕霉素组不同时段的TNF-α和IL-1均低于手术组,差异具有显著性(P<0.05);手术组24 h的TNF-α和IL-1分别为(70.47±6.92)pg/mL和(192.16±20.11)pg/mL,高于2 h和6 h(P<0.05);6 h的TNF-α和IL-1均高于2 h(P<0.05);雷帕霉素组6 h和24 h的TNF-α和IL-1分别为(39.38±4.19)pg/mL、(38.76±3.80)pg/mL和(123.61±13.08)pg/mL、(130.21±13.25)pg/mL,均高于2 h(P<0.05)(表3)。
表2各组大鼠再灌注2、6、24h血清MDA和SOD水平的比较
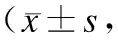

与假手术组比较,*P<0.05;与手术组比较,△P<0.05;与2 h比较,▲P<0.05;与6 h比较,★P<0.05。
表3各组大鼠再灌注2、6、24h血清TNF-α和IL-1水平的比较
Tab.3 The serum TNF-α and IL-1 levels at 2, 6 and 24 h after reperfusion in different groups of rats
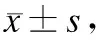
(pg/mL, n=6)
与假手术组比较,*P<0.05;与手术组比较,△P<0.05;与2 h比较,▲P<0.05;与6 h比较,★P<0.05。
2.4病理组织学观察结果光学显微镜下观察,假手术组肝细胞形态正常,肝血窦无充血、肿胀,门管区未见炎性细胞浸润;手术组随着再灌注时间的延长能见到肝窦充血、肝细胞肿胀、汇管区炎症细胞浸润、还能见到灶状坏死和点片状坏死灶,以上改变在再灌注6 h最为明显。雷帕霉素组肝小叶结构尚存,肝细胞轻度水肿,个别肝细胞胞核深染,部分肝血窦狭窄,门管区少量炎性细胞浸润(图1)。
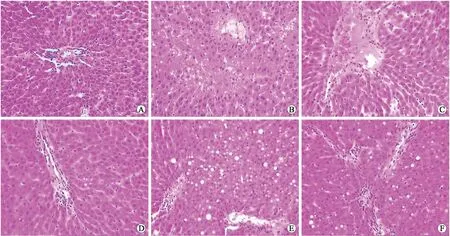
图1各组大鼠再灌注2、6、24h病理组织学观察结果
Fig.1 The histopathologic results at 2, 6 and 24 h after reperfusion in different groups of rats (×200)
A:2 h手术组病理学改变;B:6 h手术组病理学改变;C:24 h手术组病理学改变;D:2 h雷帕霉素组病理学改变;E:6 h雷帕霉素组病理学改变;F:24 h雷帕霉素组病理学改变。
3 讨 论
RAPA是放线菌培养液中分离的大环内酯类抗生素,是一种强有力的免疫抑制剂[7],通过不同的细胞因子受体阻断信号传导,阻断T淋巴细胞及其他细胞由G1期至S期的进程,从而发挥免疫抑制效应[8-9]。缺血再灌注损伤是缺血的组织器官重新获得血液供应后,并没有使组织、器官功能得以恢复,反而加重的现象,常出现在处理严重肝脏创伤、治疗肝脏肿瘤及肝脏移植手术过程中。因此,肝脏缺血再灌注损伤的研究是肝脏外科的研究热点之一[10]。
ALT和AST是人体内糖和蛋白质互相转变所需的酶,ALT的分布以肝中最高,其次是肾、心、骨骼肌,血清ALT 、AST水平是反映肝损伤程度的灵敏指标, 检测血清ALT、AST水平的变化可以反映肝损伤程度[11]。本次研究结果显示,手术组和雷帕霉素组不同时段ALT和AST均高于假手术组(P<0.05),说明肝脏缺血再灌注对肝脏造成损伤,雷帕霉素组不同时段的ALT和AST均低于手术组,差异具有显著性(P<0.05);而随着时间的延长,手术组逐渐加重,而雷帕霉素组6 h和24 h差异无显著性(P>0.05),提示RAPA对肝脏缺血再灌注损伤具有保护作用,本次研究与郑传东等研究结果相吻合[12]。
研究证实,在血液供应阻断30 min以上就会引起各细胞器超微结构的改变和功能障碍,及时恢复血液供应可挽救这部分组织,然而大量的动物实验和临床观察发现,在成功恢复血流后,部分情况下反而使组织损伤加重,可能与氧自由基等相关[13]。本研究结果显示,缺血再灌注组血清SOD 活性显著减弱,同时伴随MDA水平升高。雷帕霉素组6 h和24 h差异无显著性,提示缺血再灌注时产生大量的因SOD活性降低导致氧自由基清除不足并引发脂质过氧化反应,而RAPA可提高肝脏细胞SOD活性,减轻肝脏损伤。
RAPA抑制细胞周期G0期和G1期,阻断G1进入S期而发挥作用,其效应之一为抑制IL-1、IL-2、IL-6和IFN-α诱导的淋巴细胞增殖;研究表明,IL-1和TNF-α均是重要的促炎细胞因子,介导组织缺血再灌注损伤并发挥重要的作用[14]。TNF-α主要由单核巨噬细胞所产生,参与肝病的免疫病理反应及炎症反应导致肝病发展。IL-1含量升高,表明机体内有组织损伤或者感染产生。本次研究结果显示,雷帕霉素组IL-1和TNF-A明显减轻,与ALT和AST有相同的趋势,结合MDA和SOD 可以看出,RAPA可以清除肝脏缺血再灌注过程中生成的MDA,提高SOD活性,抑制IL-1 和TNF-α的释放,从而减少对肝脏缺血再灌注损伤发挥保护作用。本次研究几项指标和病理切片结果相一致。
综上所述,RAPA可以有效地改善肝缺血再灌注损伤,对缺血再灌注损伤肝脏具有明显的保护作用,本次研究为进一步认识RAPA控制肝脏损伤、增强肝脏缺血再灌注功能的作用提供了一定的实验依据。
参考文献:
[1] 李斌,钱海鑫. 肝脏缺血再灌注损伤保护机制的研究进展[J]. 中国现代医生,2011, 49(25):28-31.
[2]元文勇, 余伟平, 叶启发,等.大鼠肝脏缺血再灌注损伤程度判定指标的选择[J].中国普通外科杂志,2008, 17(7):650-653.
[3] 张宁,吕慧怡,邓卅,等. 西罗莫司血药浓度测定方法的建立及在肝移植患者中的应用[J]. 实用药物与临床, 2011, 14(1):28-30.
[4] 尹建亚,汤石林,彭登高,等.雷帕霉素对脓毒症大鼠肝损害的保护作用[J]. 当代医学, 2012, 18(28):1-2.
[5] CEKIN AH, GÜR G, TÜRKODLU S, et al. The protective effect of L-carnitine on hepatic ischemia-reperfusion injury in rats[J]. Turk J Gastroenterol, 2013, 24(1):51-56.
[6] 郑传东,苟欣,张力. 雷帕霉素对大鼠缺血再灌注肾细胞凋亡和P53蛋白表达的影响[J]. 中国医药科学,2012, 2(2):29-31.
[7] HOFFMAN JW JR, GILBERT TB, POSTON RS, et al. Myocardial reperfusion injury: etiology, mechanisms, and therapies [J]. Extra Corpora Techno, 2007, 36(4):391-411.
[8] 仵正,吕毅,刘原兴,等. 雷帕霉素对小鼠H22肝癌细胞生长增殖的影响[J]. 西安交通大学学报:医学版,2009,30(6):672-676
[9] WOOLBRIGHT BL, JAESCHKE H. Heme oxygenase-1 and platelets in hepatic ischemia reperfusion injury[J]. J Gastroenterol Hepatol, 2013, 28(5):756-757.
[10] AFZAL M, KAZMI I, KAUR R, et al. Comparison of protective and curative potential of Daucus carota root extract on renal ischemia reperfusion injury in rats[J]. Pharm Biol, 2013, 51(7):856-862.
[11] 元文勇,余伟平,叶启发,等. 大鼠肝脏缺血再灌注损伤程度判定指标的选择[J]. 中国普通外科杂志, 2008, 17(7):650-653.
[12] 郑传东,苟欣,张力,等. 雷帕霉素对肾缺血再灌注大鼠肝脏功能和超微结构的保护作用[J]. 中国医药科学, 2012, 2(1):25-26.
[13] 王冰,汪根树,陈规划. 肝脏缺血再灌注损伤的发生机制研究进展[J]. 器官移植2010, 1(5):317-320.
[14] 王琼叶,侯桂琴,王莉莉,等. 雷帕霉素抑制mTOR信号通路对EC9706细胞生长及凋亡的影响[J]. 郑州大学学报:医学版, 2010, 45(3):356-358.
——雷帕霉素

