沉默Slug抑制胰腺癌细胞迁移和侵袭能力
孟宪魁,张 雷
(西安交通大学医学院第一附属医院老年外科,陕西西安 710061)
胰腺癌是世界范围内常见的恶性肿瘤,因其具有早期症状不典型和转移能力强等特点,确诊时患者多已发生肿瘤转移。由于目前对胰腺癌转移的分子机制研究仍不清楚,尚未出现抑制其转移的有效治疗手段。Slug是SNAI2基因编码的锌指转录因子蛋白,具有高度保守的C2H2锌指结构域,在细胞核内可以直接结合到靶基因编码序列启动子上直接调控靶基因的转录[1-2]。E-cadherin是上皮细胞间黏连斑的主要组成分子,也是上皮细胞最重要的标志物之一[3-4]。前期实验已经证实,Slug可以通过结合E-cadherin基因启动子上的E-box序列,抑制其转录和表达[5],导致上皮细胞间质化(epithelial-mesenchymal transition, EMT)[6-7],从而促进肿瘤转移。但是仍不清楚Slug对胰腺癌侵袭转移的作用以及相关机制,本研究应用小干扰RNA技术(small interference RNA, siRNA)沉默MIAPaca-2细胞中Slug的表达,检测其对胰腺癌细胞迁移和侵袭能力的影响。
1 材料与方法
1.1细胞及实验试剂人胰腺癌细胞MIAPaca-2由西安交通大学医学院第一附属医院肝胆外科马清涌教授惠赠。DMEM培养基(Dulbecco modified Eagle medium)、2.5 g/L胰酶均购自美国GIBCO公司。胎牛血清购自杭州四季青公司。Slug siRNA序列为:5′- GCAUUUGCAGACAGGUCAATT-3′,由深圳华大基因公司合成。Slug、E-cadherin和β-actin抗体购买于美国Santa Cruz公司,生物素标记二抗购买于北京中杉金桥生物技术公司。Lipofectamine 2000购自美国Invitrogen公司。总RNA提取试剂Trizol购自美国Invitrogen公司。逆转录试剂盒和SYBGreen实时定量试剂盒购买于日本TaKaRa生物技术公司。定量Transwell细胞侵袭试剂盒购买于美国密理博公司(QCMTM96-well cell invasion assay kit)。
1.2细胞培养及瞬时转染MIAPaca-2细胞在含有100 mL/L胎牛血清的DMEM培养基、37 ℃、50 mL/L CO2条件下培养及传代。在6孔板中种植MIAPaca-2细胞,当细胞融合度达到80%~90%时,按说明书使用Lipofectamine 2000分别将Slug siRNA和错义siRNA转入不同的培养孔中,构建出实验组(Slug siRNA)和对照组(Scr siRNA)。
1.3QuantitiveReal-timePCR方法检测Slug的mRNA表达水平使用Trizol试剂提取细胞的总RNA。使用逆转录试剂盒,按说明书合成cDNA。取合成好的cDNA,使用SYBGreen实时定量试剂盒和Slug引物(F:5′-AGATGCATATTCGGACCCACA-3′,R:5′-CCTCATGTTTGTGCAGGAGAG-3′),在Life Tech(applied biosystems)7500型实时荧光定量PCR系统上实施quantitive Realtime PCR检测。β⒗-actin被用于内参,其引物序列为5′-CAACTGGGACGACATGGAGA-3′,5′-CAGGCAGCTCGTAGCTCTTC-3′。
1.4Westernblotting检测蛋白表达瞬时转染72 h用RIPA裂解液提取细胞总蛋白。使用BCA蛋白浓度测定试剂盒测定蛋白含量。使用SDS-PAGE胶(120 g/L的分离胶和50 g/L基层胶)。每个上样孔的上样量为50 μg,使用PVDF膜进行转膜、转膜后进行封闭抗原、孵育一抗、洗膜、孵育二抗,洗膜以及显影等。β-actin被用于内参。
1.5细胞划痕实验在6孔板中种植约5×105个细胞,培养过夜。使用1 mL移液器枪头垂直于培养板底面,进行划痕。使用PBS缓冲液洗涤细胞2次,去除漂浮细胞,再次在含有100 mL/L胎牛血清的DMEM培养基、37 ℃、50 mL/L CO2条件下培养。分别在0、24、48 h时拍照,并测量细胞划痕的愈合情况。
1.6定量Transwell细胞侵袭实验肿瘤细胞在无血清的DMEM培养基中饥饿培养24 h。然后在定量Transwell细胞侵袭试剂盒提供的小室的上层,种植1×105个肿瘤细胞,加入无血清的DMEM培养基。小室的下层加入含有100 mL/L胎牛血清的DMEM培养基。于常规条件下培养24 h后,按照试剂盒说明,将穿过Matrigel胶和小室滤孔层的细胞消化至下层小室。加入细胞裂解液和染料工作液后,在荧光光度仪(480/520 nm)下读取实验组和对照组数据。
1.7统计学方法数据使用Graphpad Prism 4.0进行统计分析和绘制示意图。计量资料采用均数±标准差表示,组间比较采用t检验或Mann-Whitney U秩和检验,P<0.05为差异有统计学意义。
2 结 果
2.1靶向siRNA显著降低MIAPaca-2细胞中Slug的表达瞬时转染所合成的Slug靶向siRNA后,MIAPaca-2细胞中Slug的mRNA含量显著减少(图1A)。而Western blotting实验也证实,转染Slug siRNA的MIAPaca-2细胞中Slug蛋白的含量要明显低于转染有Scr siRNA的MIAPaca-2细胞(图1B)。通过瞬时转染靶向siRNA可有效沉默MIAPaca-2细胞中Slug基因的表达。
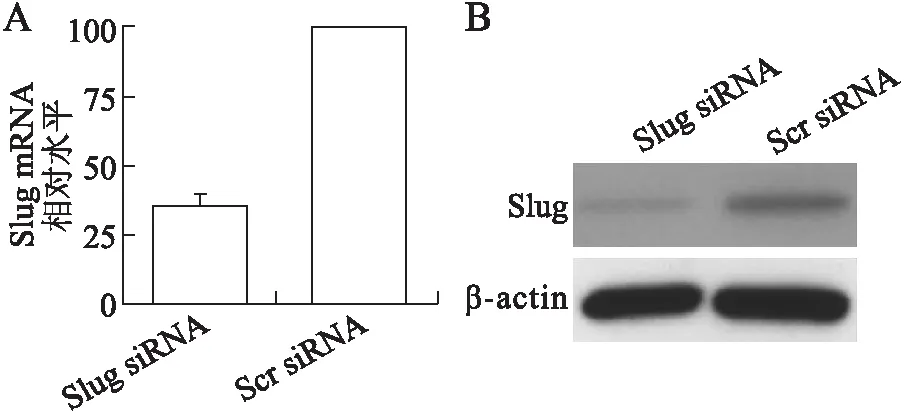
图1靶向siRNA有效沉默MIAPaca-2细胞中SlugmRNA(A)和蛋白(B)表达
Fig.1 Target siRNAs silenced Slug expression in MIAPaca-2 cells at both the mRNA (A) and protein (B) levels
2.2敲除Slug明显降低MIAPaca-2细胞的迁移能力MIAPaca-2细胞分别转染Slug siRNA和Scr siRNA 24 h,细胞划痕平均愈合分别为20%左右和40%,两组差异具有统计学意义(P=0.009)。在48 h时,转染Slug siRNA的MIAPaca-2细胞划痕平均减少了60%,而转染Scr siRNA的MIAPaca-2细胞划痕基本消失,组间差异具有统计学意义(P=0.009,图2)。
2.3沉默Slug明显抑制MIAPaca-2细胞的侵袭能力定量Transwell细胞侵袭实验检测显示转染Slug siRNA的MIAPaca-2细胞穿过包被有Matrigel胶的Transwell小室滤层的细胞明显少于转染Scr siRNA的对照组MIApaca-2细胞(图3)。这表明沉默Slug基因的表达明显抑制了胰腺癌MIAPaca-2细胞的侵袭能力。
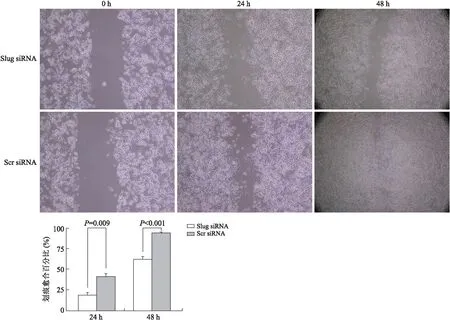

图2 细胞划痕实验证实敲除Slug可有效抑制MIAPaca-2细胞的迁移能力Fig.2 Wound healing assay confirmed that knock-down of Slug repressed the migration capacity of MIAPaca-2 cells
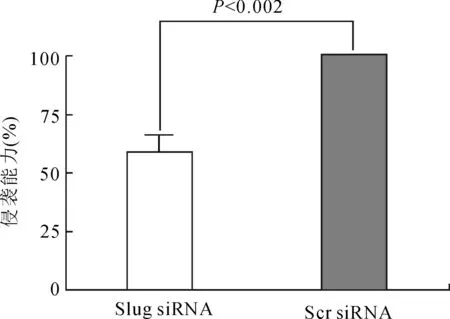
图3Transwells小室侵袭实验证实沉默Slug可有效的抑制MIAPaca-2细胞的侵袭能力
Fig.3 Quantitative Transwell chamber assays showed that silencing Slug inhibited the invasion capacity of MIAPaca-2 cells
2.4沉默Slug上调MIAPaca-2细胞的E-cadherin表达Western blotting实验结果表明Slug基因敲除时,MIAPaca-2细胞的E-cadherin蛋白表达明显增高(图4)。
3 讨 论
胰腺癌是全球第5大致死肿瘤。由于其早期缺乏典型的临床症状,同时尚无有效的临床治疗手段,其5年生存率小于5%[8]。80%胰腺癌患者在确诊时,由于已经发展为晚期肿瘤或出现远处脏器转移,无法接受根治性切除治疗。针对胰腺癌的传统放化疗方法疗效并不理想,这些因素严重影响了胰腺癌的预后。因此,探明胰腺癌转移分子机制对研发相关靶向药物和肿瘤特意标志物具有重要意义。

图4Westernblotting实验证实敲除Slug明显增加了MIAPaca-2细胞中E-cadherin蛋白表达
Fig.4 E-cadherin protein expression was increased significantly by knockdown of Slug in MIAPaca-2 cells
Slug蛋白,也被称为SNAI2蛋白,是一种锌指核转录调控因子,研究证实其具有促进肿瘤转移的功能。本研究使用小干扰RNA技术成功敲除胰腺癌细胞MIAPaca-2中Slug基因,并通过细胞划痕实验和定量Transwell细胞侵袭实验检测证实,下调Slug表达水平可以明显抑制MIAPaca-2细胞的迁移和侵袭能力。
癌症转移是一个复杂的病理生理过程,包括了癌细胞从周围细胞和基质黏连中解离、细胞外基质分解、肿瘤细胞通过基质缺损进入血液循环、淋巴循环和临近组织等。而其中肿瘤细胞粘附能力减弱和运动能力增强在癌症转移过程中起重要作用[9-10]。EMT是指上皮来源的细胞在某些因素刺激下,丧失其上皮细胞的特性如柱状细胞外形、紧密的细胞间黏连以及较弱的细胞运动能力,出现了部分间质细胞的特征。胚胎时期,EMT具有调控组织分化以及脏器形成等重要作用。而当机体发育成熟后,EMT在信号通路调控下自动消失。研究发现,EMT表型在胰腺细胞中再次出现,并促进了肿瘤细胞的侵袭、迁移以及化疗耐药能力[11-12]。但是其具体异常激活机制尚不清楚。
E-cadherin是上皮细胞间重要的粘附分子,在上皮细胞间的粘附反应起重要作用,具有维护上皮细胞形态和结构完整性及极性的功能[13-14]。前期实验已经证实Slug蛋白在细胞核内通过结合在E-cadherin编码基因启动子的E-box片段,直接抑制E-cadherin转录和表达。本实验为探讨沉默Slug明显抑制MIAPaca-2细胞迁移和侵袭能力的具体分子机制,通过Western blotting方法检测了E-cadherin蛋白的表达,结果发现下调Slug表达明显增加了E-cadherin蛋白在MIAPaca-2细胞中的表达。因此,推测Slug在胰腺癌细胞中可以通过抑制E-cadherin表达,诱导EMT表型,使得肿瘤细胞的粘附能力减弱以及运动能力增强,最终促进肿瘤转移的发生。由于EMT在肿瘤化疗耐药性产生过程中起重要作用,本研究为防治胰腺癌转移的治疗靶点提供实验依据,针对Slug的靶向药物有望成为有效的胰腺癌防治药物。
参考文献:
[1] ALVES CC, CARNEIRO F, HOEFLER H, et al. Role of the epithelial-mesenchymal transition regulator Slug in primary human cancers[J]. Front Biosci, 2009, 14(1):3035-3050.
[2] COBALEDA C, PEREZ-CARO M, VICENTE-DUENAS C, et al. Function of the zinc-finger transcription factor SNAI2 in cancer and development[J]. Annu Rev Genet, 2007, 41(6):41-61.
[3] SCHMALHOFER O, BRABLETZ S, BRABLETZ T. E-cadherin, beta-catenin, and ZEB1 in malignant progression of cancer[J]. Cancer Metastasis Rev, 2009, 28(1-2):151-166.
[4] VAN ROY F, BERX G. The cell-cell adhesion molecule E-cadherin[J]. Life Sci, 2008, 65(23):3756-3788.
[6] HOTZ B, ARNDT M, DULLAT S, et al. Epithelial to mesenchymal transition: expression of the regulators snail, slug, and twist in pancreatic cancer[J]. Clin Cancer Res, 2007, 13(16):4769-4776.
[7] LEMMA S, KARIHTALA P, HAAPASAARI KM, et al. Biological roles and prognostic values of the epithelial-mesenchymal transition-mediating transcription factors Twist, ZEB1 and Slug in diffuse large B-cell lymphoma[J]. Histopathology, 2013, 62(2):326-333.
[8] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1):10-29.
[9] SPANO D, HECK C, DE ANTONELLIS P, et al. Molecular networks that regulate cancer metastasis[J]. Semin Cancer Biol, 2012, 22(3):234-249.
[10] JIANG WG, ABLIN RJ. Cancer metastasis, challenges, progress and the opportunities [J]. Front Biosci (Elite Ed), 2011, 3(1):391-394.
[11] NAGATHIHALLI NS, MERCHANT NB. Src-mediated regulation of E-cadherin and EMT in pancreatic cancer [J].Front Biosci, 2012, 17(6):2059-2069.
[12] TIWARI N, GHELDOF A, TATARI M, et al. EMT as the ultimate survival mechanism of cancer cells[J]. Semin Cancer Biol, 2012, 22(3):194-207.
[13] HELDIN CH, VANLANDEWIJCK M, MOUSTAKAS A. Regulation of EMT by TGF beta in cancer[J]. FEBS Lett, 2012, 586(7):1959-1970.
[14] QAZI AM, GRUZDYN O, SEMAAN A, et al. Restoration of E-cadherin expression in pancreatic ductal adenocarcinoma treated with microRNA-101[J]. Surgery, 2012, 152(4):704-711.

