新型自由基清除剂对鼠视神经挫伤后 视网膜细胞的保护作用
周海燕,高 晨,张景科,周丽雅,王小梅,田蔓男,魏志诚
(1. 兰州大学第一医院眼科;2.兰州大学第一医院病理科,甘肃兰州 730000;3. 兰州军区总医院 安宁分院创伤外科,甘肃兰州 730070;4. 兰州大学医学实验动物中心,甘肃兰州 730000; 5. 甘肃省人民医院神经内科电生理检查室,甘肃兰州 730000)
外伤性视神经损伤是指外力冲击作用下所导致的视功能部分或全部丧失,可以是永久性的亦可以是暂时性的,是重要的外伤性致盲因素之一[1-2]。由于缺乏理想的治疗方法,常给患者带来不可逆转的视功能丧失。视神经挫伤后视网膜病变的机理十分复杂,涉及多因素的病变,视网膜神经节细胞(retinal ganglion cells, RGCs)微环境的改变所产生的大量自由基可引起对视网膜细胞的继发性损伤作用[3]。本实验以活体动物为基础,通过建立视神经损伤的动物模型,观察活性氧的表达与视网膜细胞凋亡的关系,并研究新型自由基清除剂依达拉奉对视网膜神经节细胞的保护作用,以探讨视神经挫伤后视网膜神经节细胞的损伤机制及药物治疗。
1 材料与方法
1.1材料与分组选择192只(384眼)健康清洁级SD大鼠(购自兰州大学医学实验中心),体质量230~250 g,雌雄兼用,健康无眼疾。随机等分为正常组、假手术组、对照组、治疗组,每组各48只,16只用于活性氧的检测,16只用于细胞凋亡率检测,8只用于透射电镜观察,剩余8只随组饲养,备用。每只鼠双眼用于实验。TUNEL检测试剂盒购自罗氏(Roche)公司,2′,7′-二氯双氢荧光素双乙酸酯(2′,7′-dichlorofluorescin-diacetate, DCFH-DA)购自美国Sigma公司,Annexin Ⅴ异硫氰酸荧光素(fluoresceinisothiocyanate,FITC)试剂盒购自Pharmingen公司,依达拉奉注射液(edaravone, MCI-186)购自南京先声东元制药有限公司。检测仪器:荧光显微镜(OLYMPUS-AX80日本);流式细胞仪(美国BECKMAN-COULTER Epics XL-4型);激光共聚焦显微镜(德国LEICA TCS SP2);透射电镜(日本电子公司JEM-1230)。
1.2视神经钳夹伤建模方法对照组和治疗组采用1 g/L戊巴比妥钠(20 mg/kg)腹膜注射麻醉大鼠后,按NAKAZAWA等[4]的方法暴露视神经。剪开外眦角,沿角膜缘右眼6∶00~12∶00,左眼12∶00~6∶00,呈180度切开球结膜并向后钝性分离暴露视神经,并于球后1.0 mm处用微血管止血钳(头部宽1 mm,长18 mm)夹持7 s(上紧2齿),用直接检眼镜观察眼底,眼底无缺血者为造模成功。缝合球结膜和外眦角,涂眼膏。术中尽可能钝性分离并避开血管以不影响眼球的血液供应,同时尽可能减少对视神经的牵拉。术后2 d出现Marcus-gun瞳孔,眼球无突出, 眼底无出血者纳入。正常组不做处理,假手术组按造模方法暴露视神经,但不钳夹。
1.3给药方法治疗组在造模后立即腹腔注射依达拉奉30 mg/kg,每隔12 h腹腔注射给药。给药时间为每次30 min,共14 d,每天2次。正常组、对照组、假手术组正常饮食,不给予任何治疗。
1.4活性氧的测定于实验后3、6、10、14 d各组分别取4只大鼠,麻醉后立即摘除双眼球,在显微镜下剥离全层视网膜组织,200目沙网研磨、冲洗过滤, 收取单细胞悬液,DCFH-DA用PBS溶解(终浓度为20 μmol/L)每个样品收集10×103个细胞,37 ℃避光负载30 min,依次上机检测每组活性氧含量。
1.5细胞凋亡率检测于实验后3、6、10、14 d各组分别取4只大鼠,同上法制作单细胞悬液,调整待测细胞浓度为1×109L-1,依照Annexin Ⅴ/PI试剂盒操作说明进行处理后立即上机检测细胞凋亡率。同时滴片用激光共聚焦显微镜观察视网膜细胞的凋亡形态。
1.6透射电镜标本的制作于实验后3、6、10、14 d各组分别取2只大鼠,眼球摘除后迅速浸入25 g/L戊二醛溶液中固定24 h,沿赤道部剪开,弃去眼前节,取后极部视网膜切成1 mm×6 mm左右的组织块共6~8块,再按常规的方法制作电子显微镜样品,观察视网膜超微结构并照相。
2 结 果
2.1各实验组细胞内ROS水平的比较方差分析及两两比较结果显示,视网膜细胞中活性氧的表达量在3、6、10、14 d时每个时间点对照组较治疗组和正常组明显增高,差异有统计学意义(P<0.05),假手术与正常组间相比无显著性差异(表1)。
表1各组间细胞内ROS水平的比较
Tab.1 Comparison of ROS levels in the retinal cells between the experimental groups
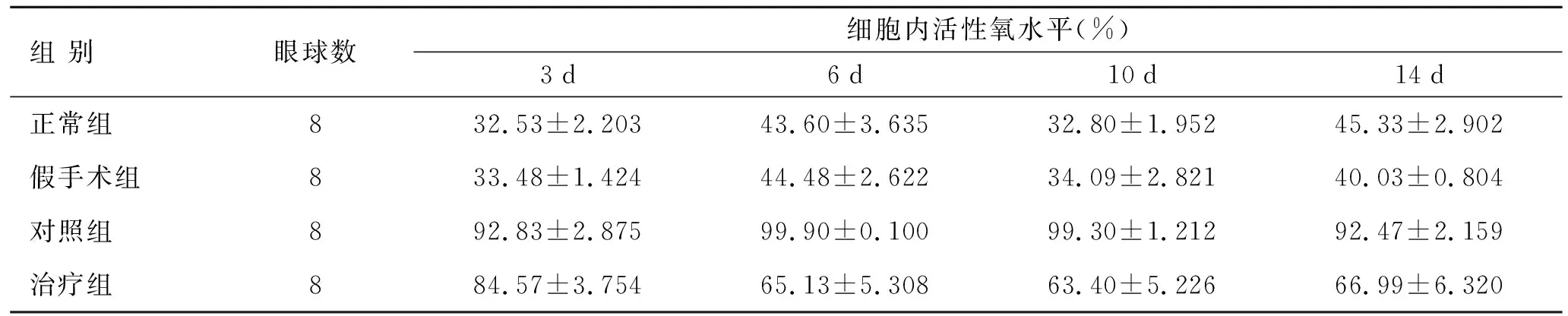
组 别眼球数细胞内活性氧水平(%)3d6d10d14d正常组832.53±2.20343.60±3.63532.80±1.95245.33±2.902假手术组833.48±1.42444.48±2.62234.09±2.82140.03±0.804对照组892.83±2.87599.90±0.10099.30±1.21292.47±2.159治疗组884.57±3.75465.13±5.30863.40±5.22666.99±6.320
2.2各实验组视网膜细胞凋亡率的比较每个时间点,对照组较治疗组和正常组明显增高,差异有统计学意义(P<0.05),假手术与正常组间相比无显著性差异(表2)。
表2各组间视网膜细胞凋亡率的比较
Tab.2 Comparison of apoptosis rate of the retinal cells between the experimental groups
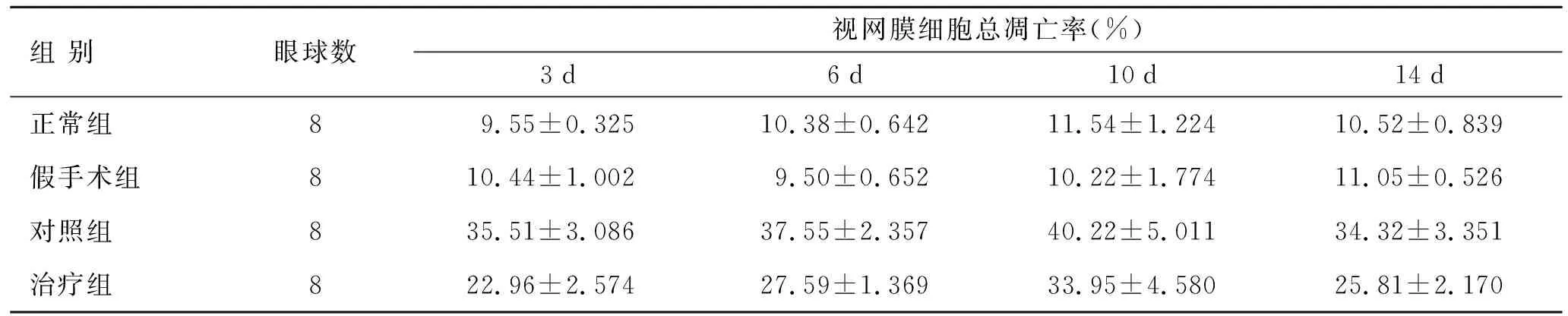
组 别眼球数视网膜细胞总凋亡率(%)3d6d10d14d正常组89.55±0.32510.38±0.64211.54±1.22410.52±0.839假手术组810.44±1.0029.50±0.65210.22±1.77411.05±0.526对照组835.51±3.08637.55±2.35740.22±5.01134.32±3.351治疗组822.96±2.57427.59±1.36933.95±4.58025.81±2.170
2.3激光共聚焦检测各实验组视网膜凋亡细胞形态的变化激光共聚焦显微镜观察, 正常组及假手术组仅见极少数凋亡细胞;对照组第3天,见大量凋亡早期细胞,呈Annexin V高染而PI低染,细胞膜呈绿色而细胞核不着色;对照组第6、10天,见大量凋亡早、中、晚期细胞。Annexin V和PI均为高染,细胞膜呈绿色而细胞核呈红色;部分细胞的核呈碎片状或梅花状,为典型的细胞凋亡形态。治疗组各期凋亡细胞均少于对照组(图1)。

图1各实验组细胞凋亡形态的观察
Fig.1 Morphology of cell apoptosis observed under laser confocal microscope in the experimental groups
A:正常组14 d;B:假手术组造模后14 d;C:治疗组造模后14 d;D:对照组造模后14 d。
2.4透射电镜观察各实验组RGCs细胞凋亡超微结构的改变透射电镜检查显示:正常组与假手术组大鼠RGCs呈椭圆形,核大、呈卵圆形,核质均匀,常染色质较多,异染色质较少。细胞质占细胞比例小,细胞器丰富,可见高尔基体,粗面内质网无明显脱颗粒现象,线粒体板状嵴规则,游离核糖体丰富;对照组大鼠视网膜及视神经较正常组出现明显凋亡形态变化。损伤3~14 d可见RGCs外形不规则,核膜内陷,异染色质增多,聚集成团块状,沿核膜分布,线粒体肿胀,嵴断裂、融合或消失,部分线粒体基质水肿,出现“空化”现象,粗面内质网扩张、脱颗粒,高尔基体、游离核糖体减少。治疗组损伤较对照组有明显减轻(图2)。
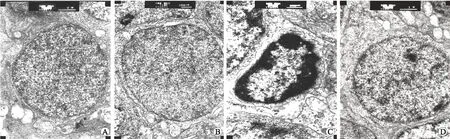
图2各实验组RGCs超微结构的透射电镜观察
Fig.2 The ultrastructural changes of RGCs detected by TEM in the experimental groups
A:正常组(×8 000);B:假手术组(×8 000)。以上2组可见RGCs呈椭圆形、核大,呈卵圆形,核质均匀,常染色质较多,异染色质较少。C:对照组造模后3 d,核膜内陷,异染色质增多,聚集成团块状,沿核膜分布,线粒体肿胀,嵴断裂、融合或消失,部分线粒体基质水肿,部分呈“空化”现象(×10 000)。D:治疗组造模后3 d,损伤较对照组明显减轻(×8 000)。
3 讨 论
外伤性视神经病变是外力对视神经的冲击或挤压损伤,是常见的眼外伤类型。成年哺乳动物视神经属于中枢神经系统的一部分。视神经损伤后,血管营养障碍,造成局部组织缺血、缺氧、水肿,反过来又加重局部缺血和轴索损伤, 多数患者常引起不可逆的视力丧失。因此, 根据外伤性视神经病变的发生机制,视神经受损的严重程度和救治是否及时决定着伤眼的视力预后[5]。
对外伤性视神经损伤的发病机制、神经修复再生规律以及其治疗效果的研究依赖于稳定可靠的视神经损伤动物模型。钳夹视神经损伤的动物模型是目前应用广泛的视神经损伤模型,是用不同的致伤器将视神经自视交叉前任一部位夹伤[6-7],保持了视神经外膜的完整,并可以部分定量,这种模型的致伤率高,接近临床损伤特征,不仅是公认的较精确的视神经不全损伤的模型,还用于青光眼视神经损伤和中枢神经损伤的研究模型[8]。
视神经作为中枢神经的代表,它的再生和保护机制近年来得到深入而广泛的研究,视神经损伤后对视网膜细胞的保护主要是停止或防止其发生凋亡。目前的研究表明,视神经损伤后造成RGCs的凋亡,是导致视力不可逆转阶段的原因,阻止RGCs的凋亡有助于急性视神经病变的治疗。视神经损伤后RGCs的凋亡可能涉及的机制包括:①视神经损伤导致自由基的产生增多,富含不饱和脂肪酸的RGCs轴索及细胞膜受到自由基的攻击而发生脂质过氧化反应,同时自由基可介导Ca2+超载及蛋白质损伤等途径诱导细胞凋亡;②由于神经损伤后产生轴浆运输障碍,导致由上丘或外侧膝状体运输至视网膜RGCs的神经营养因子等物质缺乏或减少;③兴奋性氨基酸的毒性作用:视神经损伤导致了细胞外液谷氨酸、天门冬氨酸等兴奋性氨基酸明显升高,促进细胞外Ca2+内流,Ca2+的增加作为第二信使,激活其他诱发凋亡的物质,导致细胞凋亡[9-12]。④一氧化氮(nitric oxide, NO)的毒性作用:NO作为神经毒素因子,参与神经系统的多种病理损伤过程,可介导神经元及胶质细胞的凋亡;⑤半胱氨酸蛋白酶(Caspase)的毒性作用:Caspase是RGCs继发性死亡的主要介质,Caspases的抑制剂可以通过直接的抑制凋亡和减少来自免疫系统的继发性损害而减轻缺血对神经元的损害[13]。
细胞凋亡是有核细胞在一定条件下通过启动其内部自身机制,主要是通过内源性DNA内切酶的激活而发生的细胞死亡过程[14-15]。在细胞凋亡早期位于细胞膜内侧的磷脂酰丝氨酸(PS)迁移至细胞膜外侧[15],用流式细胞仪分析细胞膜磷脂酰丝氨酸Annexin V/PI荧光标记双染色流式细胞技术是目前量化检测凋亡细胞的可靠方法。本实验使用Annexin Ⅴ/PI荧光标记双染色法可灵敏区分正常细胞、凋亡细胞及坏死细胞。电镜形态学观察是迄今为止判断凋亡最经典、最可靠的方法[16-17]。凋亡细胞的特征性形态改变是核染色质凝集。实验结果显示,对照组大鼠RGCs的细胞核发生了核固缩、染色质边集与核膜内陷等改变,而这些改变均为典型的凋亡细胞的超微结构特征[18]。
中枢神经系统创伤后,可生成自由基、活性氧并引发脂类、糖类等一些氧化毒性产物致细胞毒作用而损伤细胞。ROS即氧自由基及其衍生物,与细胞凋亡密切相关。ROS参与细胞凋亡的机制可发生在凋亡过程的各个环节[19]。DCFH-DA具有亲脂性,很容易通过细胞膜,在胞内被脂酶分解,去酰基形成有极性的DCFH,但DCFH不产生荧光,而ROS能够氧化DCFH为DCF,在流式细胞仪525nm处检测到绿色荧光,其DCF形成量与细胞氧化产物水平呈正比。因此,其荧光强度间接代表细胞内过氧化物的水平[20]
早期进行积极的药物治疗,对修复受损的视神经具有重要的价值。依达拉奉是一种新型自由基清除剂,化学名为3-甲基-1-苯基-2·吡唑啉-5-酮,商品名为Radicut。目前,临床主要用于脑缺血和脑梗塞后的治疗,对脑缺血具有强大的保护作用,是一种有效的中枢神经系统保护剂。其作用机制主要与消除氧自由基、抑制脂质过氧化反应和调控凋亡相关基因表达有关,同时研究还发现依达拉奉可以减轻内质网机能障碍,保护神经的缺血缺氧损伤,减轻其他组织缺血缺氧再灌注损伤[21-22]。对实验性视网膜脱离视神经细胞凋亡有明显的抑制作用[23]。
本实验发现,大鼠视神经钳夹伤后3 d对照组检测到视网膜细胞凋亡,10 d时达高峰,14 d时有所下降,结果显示细胞凋亡发生于视网膜各层,主要集中在视网膜神经节细胞层。其机制可能为视神经夹挫伤对轴突产生直接的机械压迫效应造成部分轴突损伤,受损的节细胞在释放的细胞毒素、氧自由基、钙离子超载或CO毒性等一系列毒理因子作用下,发生以凋亡为主的继发性改变,使节细胞进行性丢失,最终导致视功能丧失[24]。本实验通过用DCFH-DA标记细胞定量检测视网膜细胞内ROS水平,用AnnexinV/PI双染色法定量检测视网膜细胞凋亡率,透射电镜观察RGCs超微结构,发现钳夹大鼠视神经能引起视网膜细胞产生ROS,诱发RGCs的凋亡,依达拉奉通过清除ROS,减轻了细胞损伤,降低了细胞凋亡率,有效的保护了RGCs,是很有临床应用前景的新型视神经保护剂。
参考文献:
[1] STEINSAPIR KD, GOLDBERG RA. Traumatic optic neuropathy: an evolving understanding[J]. Am J Ophthalmol, 2011,151(6):928-933.
[2] 张颖,张卯年. 间接视神经损伤的治疗和视力预后分析[J]. 中华眼科杂志, 2007, 43(3):217-221.
[3] LEVKOVITCH-VERBIN H, HARRIS-CERRUTI C, GRONER Y, et al. RGC death in mice after optic nerve crush injury: oxidative stress and neuroprotection[J]. Invest Ophthalmol Vis Sci, 2000, 41(13):4169-4174.
[4] NAKAZAWA T, TAMAI M, MOIL N. Brain-derived neurotrophic factor prevents axotomized retinal ganglion cell death through MAPK and PDK signaling pathways[J]. Invest Ophthalmol Vis Sci, 2002, 43(10):3319-3326.
[5] 胡运韬,彭秀军,卢成戎,等. 外伤性视神经病变临床救治的初步观察[J]. 中华神经医学, 2003, 2(2):92-94.
[6] YOLES E, SCHWARTZ M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies[J]. Exp Neurol, 1998, 153(1):1-7.
[7] TEZEL G, YANG XJ, YANG JJ, et al. Role of tumor necrosis factor receptor-1 in the death of retinal ganglion cells following optic nerve crush injury in mice[J]. Brain Res, 2004, 996:202-212.
[8] VORWERK KC, ZURAKOWSKI D, MCDERMOTT LM, et al. Effects of axonal injury on ganglion cell survival and glutamate homeostasis[J]. Brain Res Bun, 2004, 62:485-490.
[9] YOLES E, SEHWARZ M. Potential neuroprotective therapy for glaucomatous optic neuropathy[J].Surv Ophthalmol, 1998, 42(4):367-372.
[10] YOLES E, SEHWARZ M. Elevation of intraocular glutamate levels in rats with partial lesion of the optic nerve[J].Arch Ophthalmol, 1998, 116(7):906-910.
[11] YOLES E, WHEELER LA, SCHWARTZ M. Alpha2-adrenoreceptor agonists are neuroprotective in a rat model of optic nerve degeneration[J]. Invest Ophthalmol Vis Sci, 1999, 40(1):65-73.
[12] NASKAR R, QUINTO K, ROMANN I, et al. Phenytoin blocks retinal ganglion cell death after partial optic nerve crush[J]. Exp Eye Res, 2002,74(6):747-752.
[13] WEISHAUPT JH, DIEM R, KERMER P, et al. Contribution of caspase-8 to apoptosis of axotomized rat retinal ganglion cellsinvivo[J]. Neurobiol Dis, 2003, 13(2):124-135.
[14] HENKART PA. Apoptosis: O death, where is thy sting[J]. J Immunol, 1995, 154(10):4905-4908.
[15] 成军. 程序化细胞死亡与疾病[M]. 北京:北京医科大学与中国协和医科大学联合出版社,1997:2-5.
[16] KERR JF, WYLLIE AH, CURRIE AR. Apoptosis: A basic biological phenomenon with wide-ranging implications in tissue kinetics[J]. Br J Cancer, 1972, 26(4):239-257.
[17] OTSUKI Y. Apoptosis in human endometrium: apoptotic detection methods and signaling[J]. Med Electron Microsc, 2001, 34(3):166-173.
[18] 沈强,俞彰,法京,等.电镜下几种凋亡细胞的形态特征[J]. 复旦学报:医学版, 2010, 37(3):322-325.
[19] 周海燕,鲁建华,张文芳,等. 紫外线致兔晶状体上皮细胞损伤的实验研究[J]. 眼科新进展, 2006, 26(10):733-736.
[20] BRATTON DL, FADOK VA, RICHTER DA, et al. Polyamine regulation of plasma membrane phospholipid flip-flop during apoptosis[J]. J Biol Chem, 1999, 274(40):28113-28120.
[21] YANG T, SUN L, LI J, et al. Combined effects of a neutrophil elastase inhibitor(sivelestat sodium) and a free radical scavenger (edaravone) on lipopolysaccharide-induced acute lung injury in rats[J]. Inflamm Res, 2012, 61(6):563-569.
[22] KARA M, DAGLIOGLU YK, KUYUCU Y, et al. The effect of edaravone on ischemia-reperfusion injury in rat ovary[J]. Eur J Obstet Gynecol Reprod Biol, 2012, 162(2):197-202.
[23] ROH MI, MURAKAMI Y, THANOS A, et al. Edaravone, an ROS scavenger, ameliorates photoreceptor cell death after experimental retinal detachment[J]. Invest Ophthalmol Vis Sci, 2011, 52(6):3825-3831.
[24] 史检波,徐锦堂,夏潮勇. 视神经损伤对视网膜结构的形态学研究[J]. 眼外伤职业眼病杂志, 1998, 20(4):283-285.

