G-CSF动员干细胞系对大鼠心肌缺血再灌注 损伤的早期影响
王 鑫,耿希刚,谭云鹤,潘龙毅,徐 涛,钟守平,李广顺
(1. 西安交通大学医学院第一附属医院心血管外科,陕西西安 710061;2. 西安市中心医院 心胸外科,陕西西安 710003;3. 西安市中心医院泌尿外科,陕西西安 710003)
体外循环的建立保障了心脏外科手术的顺利进行,而由此导致的心肌细胞短暂缺血及缺血再灌注损伤成为研究的重要课题。近年来,干细胞移植应用于心肌损伤的治疗成为热点,但因异体移植存在风险[1],动员自体干细胞迁移治疗则成为可行的办法。本研究就是利用粒细胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)动员干细胞系,探讨其对心肌缺血再灌注损伤的早期影响。
1 材料与方法
1.1动物、药品及试剂SD大鼠30只(西安交通大学医学院实验动物中心);重组人粒细胞集落刺激因子(瑞白,齐鲁制药厂);大鼠血管内皮生长因子(VEGF)ELISA试剂盒(武汉博士德生物工程有限公司);RNA提取试剂盒(Fast200,上海飞捷生物技术有限公司);cDNA逆转录试剂盒(美国MBI公司);2×PCRmix(西安润德生物技术公司);100 bp DNA ladder marker(广州东盛生物技术公司)。
1.2方法
1.2.1动物分组及造模 30只SD大鼠,体质量(270±30)g,随机分为:假手术组(8只)、对照组(11只)及动员组(11只)。造模前1周,给予动员组大鼠腹腔注射G-CSF 50 μg/(kg·d)[2],共7 d。造模参照张新宁等[3]报道的方法。假手术组:行开胸手术后于左冠脉前降支穿过缝线不结扎。对照组:行开胸手术后于左冠脉前降支穿过缝线并做活结结扎,30 min后再去除结扎线灌注120 min。动员组:于手术前1周给予连续腹腔注射7 d,之后处理同对照组。造模后24 h各组最终存活大鼠数量均为8只。
1.2.2血液标本的采集 动员组G-CSF动员7 d后采集各组血常规指标;建模后24 h采集各组心肌酶谱指标。采集的标本后置入全自动血生化分析仪,记录所得数据并统计分析。
1.2.3组织标本的制备 麻醉后处死大鼠,立即取出心脏。①组织切片:用PBS液冲洗,浸入固定液,石蜡常规包埋并切片,HE染色后光学显微镜下观察。②RT-PCR:用经DEPC处理的PBS液反复冲洗干净,用RNA酶灭活的刀剪取心前区缺血再灌注区域,立即置入-80 ℃液氮保存。
1.2.4ELISA法检测血清VEGF 造模后24 h采取各组大鼠外周血300 μL,5 000 r/min离心30 min,吸取表面血清并保存在-20 ℃冰箱。按照试剂盒说明进行操作,在492 nm处获得相应吸光度值(A)并统计。
1.2.5RT-PCR法检测目的基因 本实验共包含两部分,第一部分为组间比较:各组Sca-1、CD34、CTnI、Bcl-2基因在造模后24 h的表达情况;第二部分为组内比较:即动员组中CD34及Sca-1基因在注射前、造模前、造模后24 h不同时间点的表达情况。按试剂盒说明提取组织标本RNA,并得到cDNA产物,按照94 ℃变性3 min,进入循环:94 ℃ 30 s,Tm 30 s,72 ℃ 30 s。目的基因共35个循环,内参20个循环。72 ℃延伸10 min。其中目的基因CD34(5′-TTCCCGAAAGACTCTGATTG-3′,5′-ACCATTCTCCGTGTAATAAGG-3′;145 bp;Tm:62 ℃)、Sca-1(5′-GGCAGCAGACACAGATACG-3′,5′-CCGACCACCTCCTCTTCC-3′;175 bp;Tm:60 ℃)、Bcl-2(5′-GCAGAGATGTCCAGTCAG-3′,5′-GCCATATA-
GTTCCACAAAGG-3′;273 bp;Tm:60 ℃)、CTnI(5′-GCCAACTACCGAGCCTATGC-3′,5′-CTTCAAA-GCCCAGCCCATCC-3′;205 bp;Tm:62 ℃)及内参GAPDH(5′-ATGGTGAAGGTCGGTGTGAACG-3′,5′-CGCTCCTGGAAGATGGTGATGG-3′;233 bp,Tm:60 ℃)
1.3统计学处理应用SPSS 13.0软件进行统计分析。计量资料以均数±标准差表示,组间差异比较采用方差分析并行方差齐性检验,多组数据两两之间比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结 果
2.1血清学指标
2.1.1血常规检测结果 WBC值经方差分析(F=160.01,P<0.05)3组之间存在统计学差异。其中,动员组较其他两组有所升高(P<0.05),而假手术组与对照组则没有统计学差异(P=0.322)。其他指标HGB(F=1.876,P=0.178)、RBC(F=0.081,P=0.923)以及PLT(F=0.142,P=0.868)3组之间没有统计学差异(表1)。
表1动员组G-CSF动员7d后各组血常规指标的比较
Tab.1 Blood routine test results in each group
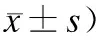
(n=8,
与假手术组及对照组比较,*P<0.05。
2.1.2心肌酶谱的检测结果 建模后24 h各组心肌酶谱相关指标数据如表2所示。3组间3个指标方差分析的结果CK:F=1 136.295,P<0.01;CK-MB:F=1 721.238,P<0.01;CTnI:F=1 204.033,P<0.01,说明这3个指标在3组间均存在统计学差异。进一步两两比较显示,动员组及对照组各个指标较假手术组增高(P<0.05);但动员组较对照组各心肌酶谱指标是降低的(P<0.05)。
表2建模后24h各组心肌酶谱检测指标的比较
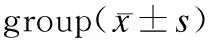
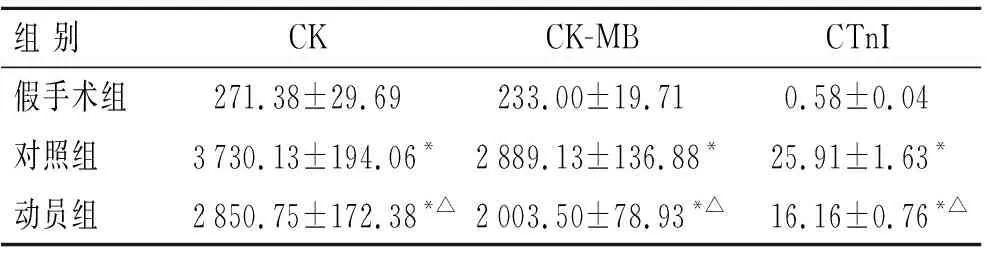
组 别CKCK-MBCTnI假手术组271.38±29.69233.00±19.710.58±0.04对照组3730.13±194.06*2889.13±136.88*25.91±1.63*动员组2850.75±172.38*△2003.50±78.93*△16.16±0.76*△
n=8;与假手术组比较,*P<0.05;与对照组比较,△P<0.05。
2.2组织切片结果由图1可见,正常的心肌组织结构为条索状平滑肌构成,细胞核、细胞质结合紧密,胞质染色均匀(图A)。对照组(图B)心肌细胞整体肿胀,胞质出现裂纹,胞质松散;细胞核与胞质出现分离,甚至部分细胞核出现溶解;心肌纤维之间的联系出现断裂。动员组(图C)较对照组胞质松散相对减少,核质连接较为紧密,且胞质近细胞核处染色均匀。
2.3各组VEGF的表达情况假手术组、对照组、动员组VEGF的表达分别为:(39.45±9.68)pg/mL、(47.86±5.45)pg/mL、(66.95±8.28)pg/mL,经方差分析,3组间VEGF的表达存在统计学差异(F=24.804,P<0.01)。进一步两两比较,动员组较假手术组、对照组VEGF含量高(P<0.05),而假手术组、对照组之间尚不能肯定有统计学差异(P=0.048)。
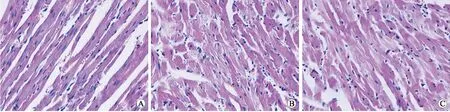
图1各组大鼠心肌组织的变化
Fig.1 Changes of rat myocardial tissues (HE, ×400)
A:假手术组;B:对照组;C:动员组。
2.4RT-PCR检测结果
2.4.1RT-PCR比较3组之间各项指标的表达 由图2可以看出,对照组及动员组各目的基因均较假手术组表达增高。运用凝胶分析软件Labworks进行半定量分析,选取累计吸光度(IA)值为指标,统计结果如表3所示。3组间目的基因经方差分析差异有统计学意义。CD34:F=43.26,P<0.01;Sca-1:F=26.33,P<0.01;CTnI:F=14.56,P<0.01;Bcl-2:F=216.91,P<0.01。进一步两两比较得知:CD34在假手术组、对照组之间没有统计学差异(P=0.565),而动员组较假手术组、对照组表达增高(P<0.05);CTnI在对照组表达较假手术组、动员组降低(P<0.05),但假手术组、动员组两组之间没有统计学差异(P=0.37);Sca-1在动员组及对照组较假手术组表达增高(P<0.05),而Bcl-2在动员组较对照组表达增高(P<0.05)。
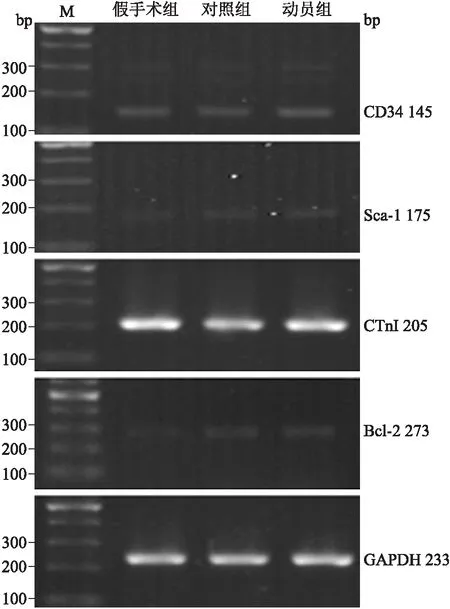
图2RT-PCR检测各组相关目的基因的表达
Fig.2 The expression of target genes in each group (RT-PCR)
表3各组目的基因累计吸光度平均值的比较


目的基因假手术组对照组动员组CD348120.90±821.418378.80±306.4311657.67±200.52*△Sca-1526.75±28.541089.75±158.47795.18±34.31*CTnI95418.67±7263.1670973.00±4390.1390754.67±5664.68△Bcl-2840.22±29.962115.49±102.712592.37±150.34△
与假手术组比较,*P<0.05;与对照组比较,△P<0.05。
2.4.2G-CSF动员后动员组CD34、Sca-1在不同时间点的变化 动员组CD34和Sca-1在3个时间点均有所表达(图3)。半定量分析结果显示,两种目的基因在3个时间点的表达均有统计学差异。CD34:F=26.082,P<0.05;Sca-1:F=22.205,P<0.05。两两比较得知:CD34在注射前的表达最低(P<0.05)。而其他两个检测时间没有统计学差异(P>0.05);而Sca-1在造模后24 h的表达最高(P<0.05),注射前与造模前的IOD值经统计学分析后(P=0.055),尚不能认为两者的表达存在差异(表4)。
3 讨 论
心肌缺血再灌注损伤的治疗可以通过血管再生、增加局部灌注、减少细胞坏死的途径,这其中就包括血管内皮生长因子(VEGF)、缺氧诱导因子-1α(HIF-1α)[4]等。也可动员干细胞到外周血,利用归巢促进其向损伤的心肌细胞迁移,从而修复细胞[5]。干细胞动员可通过外界因素的干预或者自身机体的代偿机制促使干细胞迁移,从而使得外周血干细胞数量增加。本研究就是应用G-CSF作为刺激因子[6-7],探讨其对早期心肌缺血再灌注损伤的影响。建模开始前,我们先给予动员组连续7d G-CSF注射,结果动员组的白细胞较其他两组均有统计学差异[8];为进一步证实,我们又从基因层面分析动员组CD34与Sca-1在注射前和注射后7 d的表达,结果显示G-CSF注射后CD34[9]与Sca-1表达是增高的,从而证实G-CSF确实有动员干细胞的作用[2]。建模后24 h,我们先采集血样分析心肌酶谱,结果提示动员组较对照组心肌酶谱指标下降,说明G-CSF的干预可减少心肌细胞的凋亡。而组间行Bcl-2[10]表达的比较则证明G-CSF的动员的确有抑制心肌细胞凋亡的作用,从而减少了血清中的CTnI含量,提高了其细胞中的含量(动员组高于对照组表达量,P<0.05)。由于G-CSF有动员干细胞的作用,我们检测了CD34与Sca-1在组间的表达。结果发现,CD34在假手术组及对照组间表达没有统计学差异。其中对照组IOD值较假手术组高,提示因局部组织损伤是可以引发自身代偿机制动员干细胞系的;但动员组较其他两组CD34表达明显升高,说明预注射细胞因子有明显的动员干细胞系作用,而因损伤靠自身代偿动员干细胞系是需要一定时间的;Sca-1是较为公认干细胞系细胞表面标志物的一个指标,尽管本实验中半定量分析看出动员组及对照组Sca-1较假手术组有所增加,提示有干细胞的动员,但在表达增高的两组中,动员组Sca-1表达量相对低,考虑可能与实验样本量少,Sca-1自身表达量低相关,尚需加大样本量进一步验证。VEGF的高表达是治疗组织损伤的一个途径,它对内皮细胞的增殖、迁移及血管重建有着重要的意义[11]。而干细胞修复组织的形式中包含自身分泌的细胞因子对损伤组织的影响[12],这其中就包含VEGF。我们发现动员组在CD34及Sca-1均高表达的同时,VEFG的含量较其他两组也是明显增加的。说明动员的干细胞系可能存在旁分泌修复作用。G-CSF不仅能动员干细胞系,同时有报道发现G-CSF的刺激可提高VEFG水平[13]。因此,可以推断,G-CSF的预动员对心肌缺血再灌注损伤的早期修复可能有双重保护作用,但需进行更加深入的研究。本研究初步证实了应用G-CSF可提前动员机体内的干细胞系,从而减轻心肌缺血再灌注早期的损伤程度,进一步减少心室重构,改善心功能。
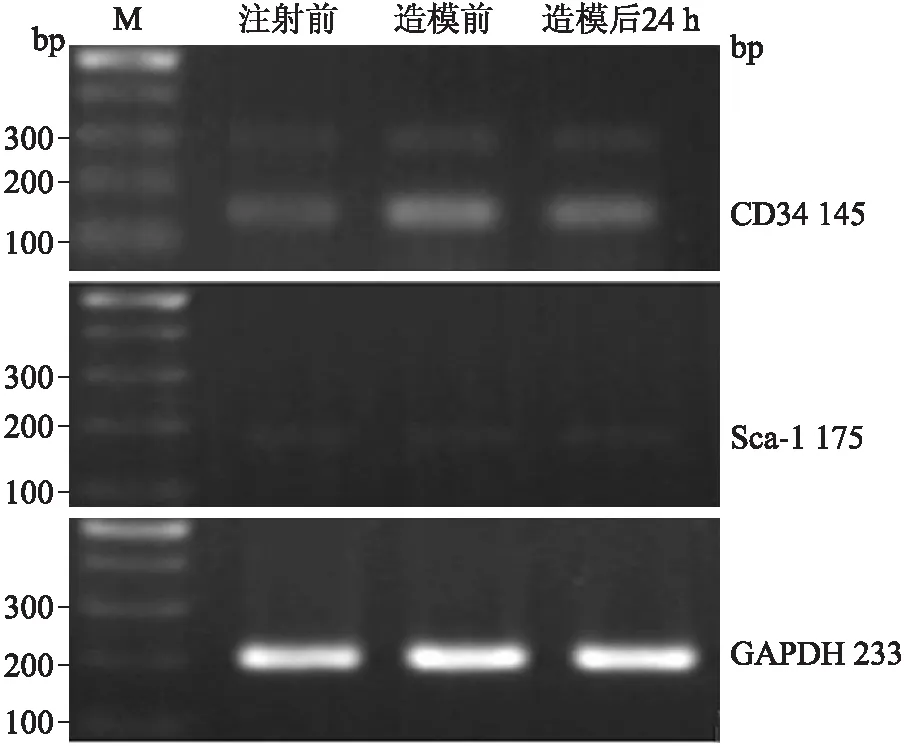
图3RT-PCR检测动员组CD34、Sca-1不同时间点的表达
Fig.3 The expression of CD34 and Sca-1 in mobilization group
表4动员组组内CD34、Sca-1的累计吸光度均值的比较


基 因注射前造模前造模后24hCD3418536.00±2713.4541223.33±3476.67*36074.67±5419.15*Sca-12865.57±281.613410.23±237.184376.60±319.06△
与注射前比较,*P<0.05;△P<0.05。
参考文献:
[1] MAKKAR RR, LILL M, CHEN PS. Stem cell therapy for myocardial repair:Is it arrhythmogenic? [J]. J Am Coll Cardiol, 2003, 42(12):2070-2072.
[2] 孙晓春,蔡花,吴乐乐. G-CSF动员大鼠外周血间质干细胞的初步实验研究[J]. 中国细胞生物学学报, 2010, 32(5):762-765.
[3] 张新宁,吕琪,张永亮,等. 大鼠心肌缺血再灌注模型建立方法的改进[J]. 武警医学院院报, 2008, 11(17):941-943.
[4] SEMENZA GL. Hypoxia-inducible factor 1:control of oxygen homeostasis in health and disease[J]. Pediatr Res, 2001, 49(5):614-617.
[5] JACKSON KA, MAJKA SM, WANG HY, et al. Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cell[J]. J Clin Invest, 2001, 107(11):1395-1402.
[6] DEINDL E, ZARUBA MM, BRUNNER S, et al. G-CSF administration after myocardial infarction in mice attenuates late ischemic cardiomyopathy by enhanced arteriogenesis[J]. FASEB J, 2006, 20(7):956-958.
[7] LOPEZ PA, RIBEIRO FT, CHABOT V, et al. G-CSF stimulation of bone marrow mesenchymal stromal cells promotes CD34+cell migration via a MMP-2-dependent mechanism[J]. Stem Cells Dev, 2012, 21(17):3162-3172.
[8] DUHRSEN U, VILLEVAL JL, BOYD J, et al. Effect of recombinant human granulocyte colony-stimulating factor on hematopoietic progenitor cells in cancer patients[J]. Blood, 1998, 72(6):2074-2081.
[9] NIENABER CA, PETZSCH M, KLEINE HD, et al. Effects of granulocyte-colony-stimulating factor on mobilization of bone-marrow-derived stem cells after myocardial infarction in humans[J]. Nat Clin Pract Cardiovasc Med, 2006, 3 (Suppl 1):S73-77.
[10] HARADA M, QIN Y, TAKANO H, et al. G-CSF prevents cardiac remodeling after myocardial infarction by activating the Jak-Stat pathway in cardiomyocytes[J]. Nat Med, 2005, 11(3):305-311.
[11] ZHANG ZG, ZHANG L, JIANG Q, et al. VEGF enhances angiogenesis and promotes blood-brain barrier leakage in the ischemic brain[J]. J Clin Invest, 2000, 106(7):829-838.
[12] XU YX, CHEN L, HOU WK, et al. Mesenchymal stem cells treated with rat pancreatic extract secrete cytokines that improve the glycometabolism of diabetic rats[J]. Transplant Proc, 2009, 41(5):1878-1884.
[13] 陈向东,王东. G-CSF对大鼠脑缺血再灌注模型脑组织内VEGF表达的影响及脑保护作用[J]. 内蒙古医学杂志, 2011, 43(5):535-538.

