中国贝类养殖对海洋碳循环的贡献评估
李海晏 ,陈 涛张海燕姚志通,叶 瑛夏枚生
(1.浙江大学 海洋科学与工程学系 海洋资源研究所,浙江 杭州 310058;2.浙江大学 舟山海洋研究中心,浙江 舟山 316021;3.杭州电子科技大学 材料与环境工程学院,浙江 杭州 310018)
LI Hai-yan1, 2,CHEN Tao1,ZHANG Hai-yan1,YAO Zhi-tong3,YE Ying1,XIA Mei-sheng1
(1.Department of Ocean Science and Engineering,Zhejiang University,Hangzhou 310058,China;2.Zhoushan Ocean Research Institute,Zhejiang university,Zhoushan 316021,China;3.Materials Science and Environmental Engineering,Hangzhou Dianzi University,Hangzhou 310018,China)
自工业革命以来,由于石化燃料的大量燃烧,大气中温室气体增加,温室效应加剧,导致气候、生态系统、人类活动受到严重影响。在京都议定书生效以后,由 CO2等温室气体导致的气候变化问题引起全球关注,成为国际上外交博弈的工具[1]。因此,如何准确评估生物圈生态系统的碳沉积能力,并探讨实现增加碳沉积途径成为目前亟待解决的课题[1]。
海洋碳储量约为3.8×105亿t,比大气多50倍,因此,海洋对碳的吸收能力将直接影响到全球碳循环[2]。中国陆架边缘海域面积约为300万km2,占全球的12.5%,是世界上最宽、生产力最高的陆架边缘海之一[2]。其中15 m等深线以内的浅海滩涂面积只有12.4万km2,占陆架边缘海的4.1%,但该区域海洋碳循环异常活跃,因为它是自然生产力很高和人类水产养殖活动最集中的区域[1]。养殖贝类可以通过生物矿化作用将海水中的溶解无机碳转化为 CaCO3贝壳;伴随着贝壳收获,大量碳被直接从海水中移出,这将对养殖区及邻近海域的碳汇有重要影响。因此,对中国浅海贝类养殖碳沉积潜力进行估算,可为争取国家碳份额的合法权益提供基础数据。
1 全球暖化与碳循环
1.1 全球暖化
近100年来,全球气温平均提高约0.6 ℃± 0.2 ℃[3]。0.6℃的温差不仅造成平均温度上升,而且导致炎热与寒冷的日数分别增加与减少[4]。现在全球暖化速度越来越快,估计 21世纪气温每 10年将上升 0.15~0.6 ℃[5],这将造成更加剧烈的气候变化[6]。
全球暖化是由温室气体浓度增加造成的[4]。温室气体包括 CO2、CH4、N2O、O3、CFC 等。但在总量上CO2贡献了约60 %的暖化作用[7],极地温度与大气CO2的浓度变化趋势一致[4],因此CO2是造成全球暖化的主要原因,对地表温度影响显著。在工业化以前,地球大气中CO2浓度维持在280 mg/kg,如今已达380 mg/kg,并以每年2 mg/kg的速度增加[8]。石化燃料的燃烧和森林砍伐是引起大气中 CO2浓度增加的主要原因[9]。另外,水泥生产和火山喷发也造成大气中CO2浓度增加[9]。
在地质年代里耗时千万年的暖化过程,在现今CO2浓度的增加速度下,仅几个世纪就可完成。这将对人类和各种生物造成严重冲击[10]。全球暖化使表层海水温度升高,对流层水蒸气增加,能量传递加快,这将导致飓风[11]、热浪侵袭[12]更加频繁。表层海水温度上升约 0.74 ºC,冰山熔化,就会使全球平均海平面上升17~20 cm[13]。如果南极和格陵兰岛的冰山全部熔化,将会使海平面上升约7 m[14]。如果温室气体持续释放,在21世纪海平面将上升20~100 cm,这将导致严重的生态灾难和经济破坏,以及沿海数千万人口将被迫迁移[14]。目前每年人为排放的 CO2约 25 %被海洋吸收,与海水作用形成碳酸,造成海洋酸化。自工业化以来海水 pH从 7.8~8.2下降了0.1~0.12[15],并以每年0.0018的速率持续下降[15]。若海水pH在21世纪再下降0.1~0.5,将对海水化学性质、海洋环境造成直接的影响[15]。暖化造成极地海洋冰层覆盖的面积减少,使得北极熊等生物的栖息地减少,极地的食物链与生态改变[16]。海洋酸化使海水碳酸钙饱和度下降,钙化速率降低,使珊瑚难以保持其外部的碳酸钙骨质结构,其生长与存活受到影响。这将威胁到海洋生物的多样性,超过75 %的珊瑚鱼种数量因而减少,其中50 %的鱼种数量将降到一半以下[17]。到 21世纪中叶,主要造礁生物,珊瑚与钙化藻类的钙化速率将比工业化前减少10%~50%[9]。气候暖化还可能造成病媒散布、缩短病原发育时间,增加中暑和呼吸系统疾病等负面影响[18]。
1.2 海洋碳循环的格局
全球碳循环是指化学性质活跃的碳在各大碳库之间迁移和转换的过程。从全球尺度来看,全球共存在岩石圈、海洋、大气、陆地生物圈、水生生物圈、化石燃料 6 个主要碳库。岩石圈是第一大碳库,海洋是仅次于岩石圈的第二大碳库。但是岩石圈的碳主要以碳酸钙结晶的形式存在,性质稳定,只有极少一部分通过风化的作用参与到地球化学循环中去[19];而海洋碳库中的碳主要以溶解无机碳的形式存在,化学性质活跃;同时,海洋碳库是大气碳库的 50倍,陆地生物圈碳库的 19 倍,化石燃料碳库的 9倍,因此海洋是全球第一大活跃碳库[19]。大气碳库虽然较小,却是调节全球气候的最关键因素。全球暖化的根源就是由于人类对石油、煤炭、天然气等化石燃料的开发利用,使本该被长期封存在岩石圈中的有机碳被转换成CO2进入了大气圈[20]。
自20世纪末,一系列针对海洋碳循环过程的大型国际科研计划(国际地圈与生物圈计划(IGBP)核心计划全球海洋通量联合研究(JGOFS)、海岸带陆海相互作用(LOCIZ)、上层海洋与低层大气研究(SOLAS)、全球海洋生态系统动力学(GLOBEC)、海洋生物地球化学和生态系统综合研究(IMBER)相继实施,使人们对海洋碳循环过程有了更深入的了解。生物圈中循环的碳有95% 存在于海洋中,用千年的时间尺度看,海洋决定了大气 CO2的浓度,在大气和海洋之间每年流动着900 亿t的碳。CO2的海气交换主要发生在海洋表层,每年都有大量的 CO2从大气圈进入海洋,其速率除与风力,海洋环流和垂直对流等物理过程有关外,与温度、CO2分压等化学和生物过程都有密切关系,通常高纬度的海水温度低、盐度高,海水吸收CO2,低纬度海域则相反[21]。海洋碳循环过程主要是在“溶解度泵”、“碳酸盐泵”、“生物泵”的作用下完成的。在这个 3个泵的作用下,实现了碳在海洋中的迁移和变化,对缓解全球气候变化做出了巨大贡献,最终调节了全球气候[19-20]。
目前,石化燃料燃烧、森林砍伐、水泥生产、以及火山喷发每年直接释放了约93.3亿t碳的CO2进入大气,扣除海洋、森林、草原与湿地每年吸收掉约46.6亿t碳的CO2外,现在大气每年约增加46.7亿t碳的CO2[6]。即约一半人为释放的CO2被陆地与海洋生态系统吸收[6]。
海洋每年约从大气中吸收 22亿 t碳的 CO2[22],其中浮游植物、珊瑚礁等吸收了约3.84亿t碳的CO2,即现在海水中每年约增加18.2亿t碳的CO2,迄今已吸收了约 1 400亿 t碳的 CO2,相当于石化燃料燃烧CO2释放量的50 %,或总人为CO2释放量的30 %[23]。
1.3 贝类养殖在海洋碳循环中的作用
近海是海洋生产力最高的区域,同时还是受人类活动影响最强烈的区域,在近海存在着大量的贝类高密度养殖区[20]。贝类是近海生态系统中物质流和能量流的驱动者。贝类通过两种促进生长的方式使用海洋碳。一种方式是利用海水中的形成CaCO3躯壳,其反应式如下: Ca2++2= CaCO3+CO2+H2O。虽然每形成 1 mol 的碳酸钙,会释放1 mol 的CO2,但是可以吸收2 mol 的碳酸氢根[24]。实际上,形成的 CaCO3贝壳,少量随有机碳从表面海水垂直输送到海洋深部,绝大部分通过收获从海水中移出。另一种方式是通过滤食摄取水体中的悬浮颗粒有机碳(包括浮游植物和颗粒有机碎屑等)促进贝类个体软组织的生长[2]。贝类的滤食系统十分发达,有着极高的滤水率,能够利用上覆水中乃至整个水域的浮游植物及颗粒有机物质。大规模的贝类养殖活动对水体中悬浮颗粒有机物质的数量以及组成有一定的控制作用[2]。
贝壳的生长过程是一种生物矿化过程,同时也是一种碳的地球化学循环过程(循环周期长达数百万年),在这个过程中贝类吸收利用二氧化碳(以碳酸氢根的形式)[20]。大量的贝类养殖对移除、降低空气中的二氧化碳浓度,缓解温室效应具有一定的贡献[2]。
2 中国贝类养殖对海洋碳循环的影响评估
2.1 中国海水养殖状况
中国海水养殖发达,养殖面积和产量居世界首位[2]。农业部渔业局的统计资料显示,中国海水养殖业产量1955年仅10万t,此后逐步提高[25]。在近30年里得到了快速发展,1990年和 2000年分别超过300万t和1000万t,2009年和2010年分别上升至1405万t和1482万t。中国海水养殖业的快速发展主要得益于浅海贝类和藻类养殖的兴起,如在 2009年和2010年的海水养殖产量中贝类产量分别约占总产量的74.94 %、74.76 %,藻类分别约占10.36 %、10.40 %,二者相加约占中国海水养殖产量的 85 %,甲壳类、虾类和鱼类一共约占13 %,其他类别约占2 %[25](图 1)。可见,中国海水养殖是一个以贝藻养殖为主的水产养殖业,尤其是贝类养殖,独占约75 %。
2.2 中国贝类养殖产量
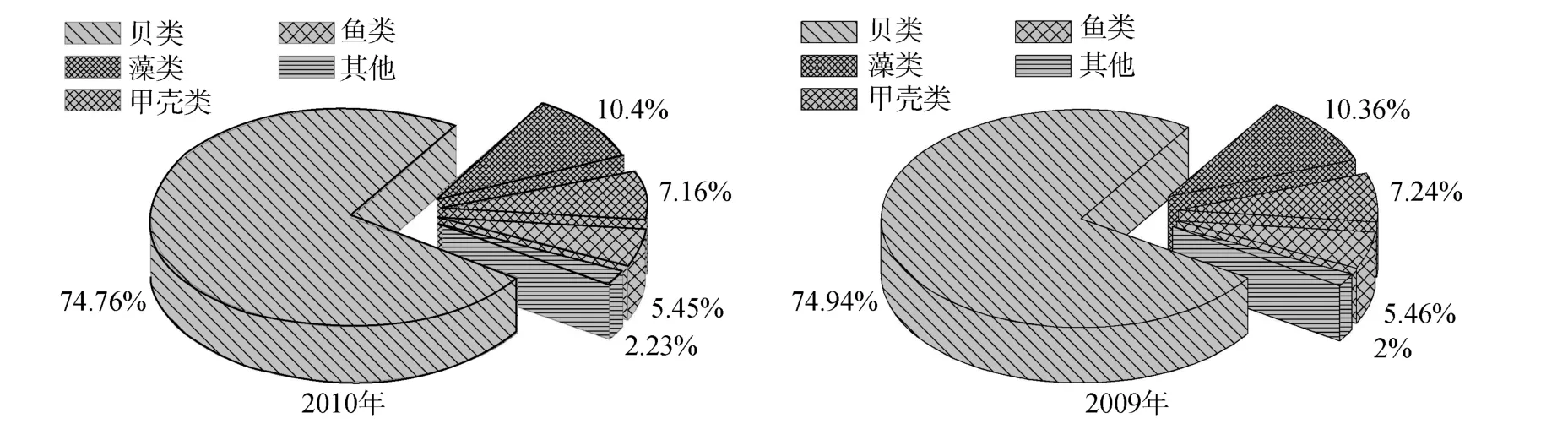
图1 中国海水养殖产量组成Fig.1 Composition of mariculture yields of China
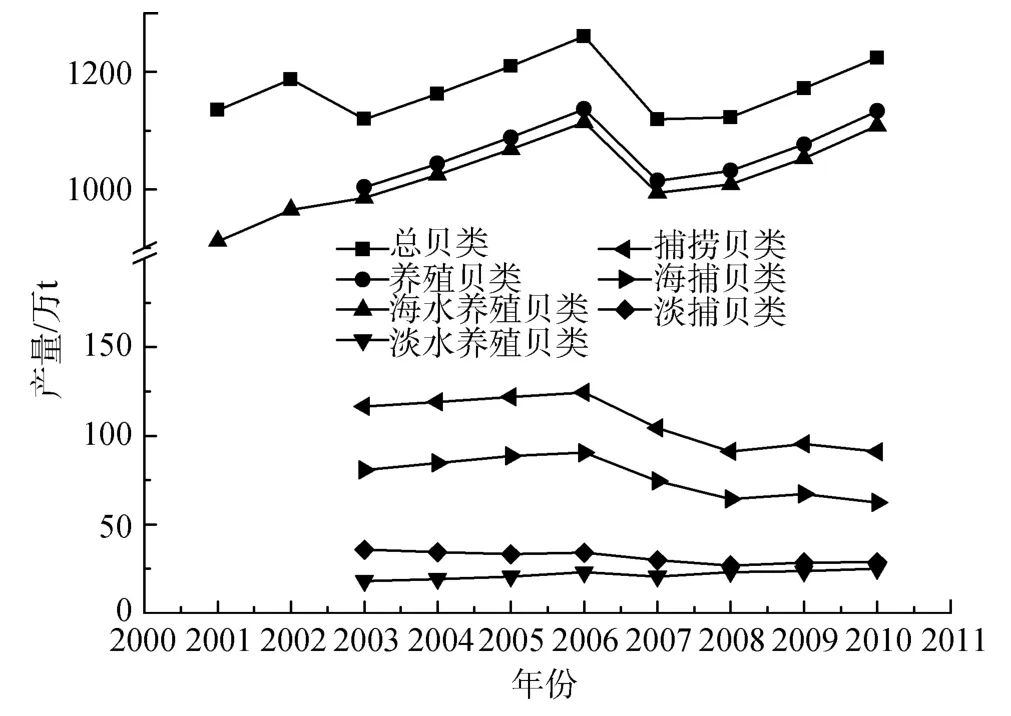
图2 中国贝类产量构成(按养殖方式和捕捞方式分)Fig.2 Composition of shellfish yields of China (classified by culture methods and fishing methods)
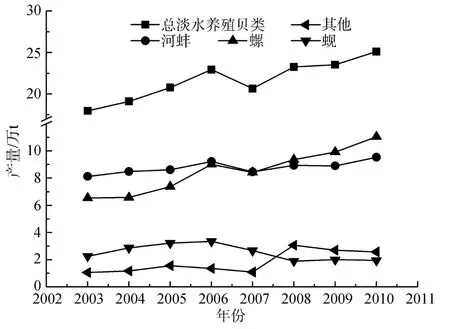
图3 中国淡水贝类养殖产量构成(按品种分)Fig.3 Composition of freshwater shellfish yields of China(classified by variety)
中国贝类养殖始于20 世纪70 年代初,据农业部渔业局统计,80年代初,年产量约30万t,90年代初增至100万t。随后有了较大发展,自2001年以来的统计资料显示,近 10年中国贝类总产量稳定在1100万 t以上,有增加的趋势,其中 2006年产量最高,达约1261.02万t(图2)。2010年,海水养殖贝类总产量已达1108万t,主要养殖种类为牡蛎、蛤类、扇贝和贻贝等,产量分别达约364、354、141、70万t,共约占海水养殖贝类产量的83.84 %[25]。淡水养殖贝类最近10年都为20万t 左右,2009年和2010年分别约为23.4万t和25万t。每年捕捞总产量稳定在95万t左右,2009年和2010年贝类捕捞量分别为95万t和91万t[25],以海洋捕捞为主,淡水捕捞只有约30万t。养殖产量远高于捕捞产量,海水养殖产量远高于淡水养殖产量。
中国海水贝类养殖产量和面积呈增长趋势。牡蛎、蛤、扇贝、贻贝产量较大,2010年分别约为364.28、353.89、140.75、70.21万 t。蛤、扇贝的养殖产量增长最为显著,分别从 2001年的 201.44、96.03万 t增长到 2010年的 353.89、140.75万 t;而牡蛎产量一直稳定在350万t左右(图4)。从2001年到2010年,中国海水贝类养殖面积从79.66万ha增长到130.80万ha,增长显著。其中扇贝养殖面积增长最为明显,从2001的5.51万ha增长到2010年的39.97万ha,而蛤、牡蛎等的养殖面积比较稳定(图5)。
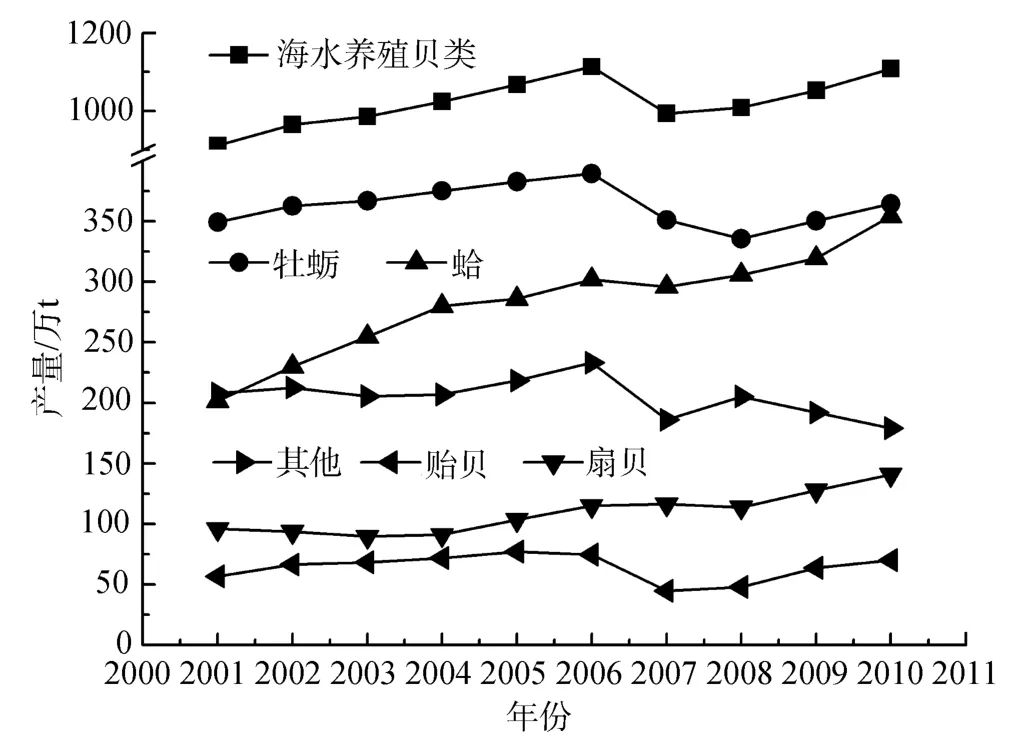
图4 中国海水贝类养殖产量构成(按品种分)Fig.4 Composition of mariculture shellfish yields of China(classified by variety)
捕捞贝类产量如同其他渔业一样,受资源量和捕捞强度的影响。而资源量又受水文和环境污染等因素的影响;捕捞强度则受技术、成本、市场等因素的影响,各种因素间又相互影响。从图 2可以看出,近 10年来,贝类捕捞量远小于养殖量,仅为贝类总产量的10 %左右,并有降低的趋势。贝类捕捞量远小于市场的需求量,这促进了贝类养殖的持续发展。全球暖化可能增加贝类生产力,而海洋酸化可能降低贝类存活率和生长速度,二者对贝类养殖产量的影响尚无定论,但是即使有影响,也远低于人为的掌控[6]。
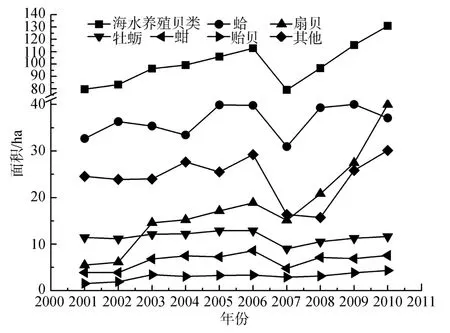
图5 中国海水贝类养殖面积构成(按品种分)Fig.5 Composition of mariculture shellfish area of China(classified by variety)
2.3 中国贝类养殖的碳沉积潜力
依据农业部渔业局编制的《中国渔业统计年签》,以2001年(或2003年)到2010年的年平均产量计算捕获贝类和养殖贝类的碳沉积能力。养殖贝类和捕获贝类总产量的碳沉积为 58.57万 t/a,碳沉积能力相当于122.28万ha的造林,其中淡、海水养殖贝类总产量的碳沉积为 53.30万 t/a,碳沉积能力相当于111.27万ha的造林(淡、海水养殖贝类产量的碳沉积量分别为1.08、51.15万t/a,碳沉积能力分别相当于 2.25、106.78万 ha的造林);淡、海水捕获总产量的碳沉积为 5.40万 t/a,碳沉积能力相当于11.27万ha的造林(淡、海水捕获产量的碳沉积分别为1.57、3.83万t/a,碳沉积能力分别相当于3.28、8.00万 ha的造林)。海水贝类养殖产量的碳沉积量占贝类总产量碳沉积量的87.33%,其中海水贝类养殖中牡蛎、蛤、扇贝、贻贝产量的碳沉积量分别为19.91、14.23、5.44、3.21万t/a,碳沉积能力分别相当于 41.57、29.71、11.36、6.70万 ha的造林(表 1)。以上淡、海水贝类碳沉积能力可减少大气CO2增加量的0.0125% (目前大气每年增加约46.7亿 t碳的CO2[6])。
2.4 贝类养殖与其他方式碳沉积能力比较
根据农业部渔业局编制的《中国渔业统计年签》的牡蛎、蛤、扇贝、贻贝的平均养殖产量与养殖面积的统计资料计算得到它们的产量分别为 31.45、7.75、6.02和 20.77 t/(ha·a),碳沉积能力分别为1.573、0.388、0.301 和 1.039 t/(ha·a)(表 2)。
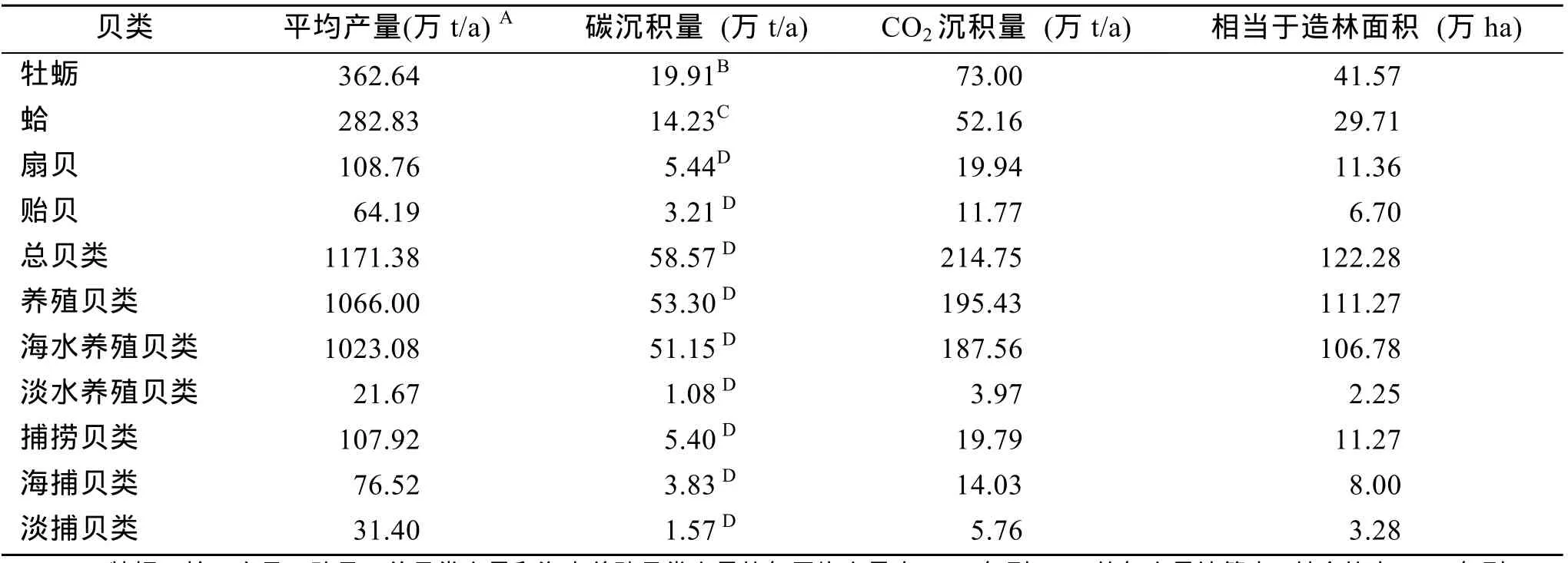
表1 中国养殖贝类和捕捞贝类碳沉积潜力Tab.1 Potential of carbon deposition by shellfish culture and fishing in China
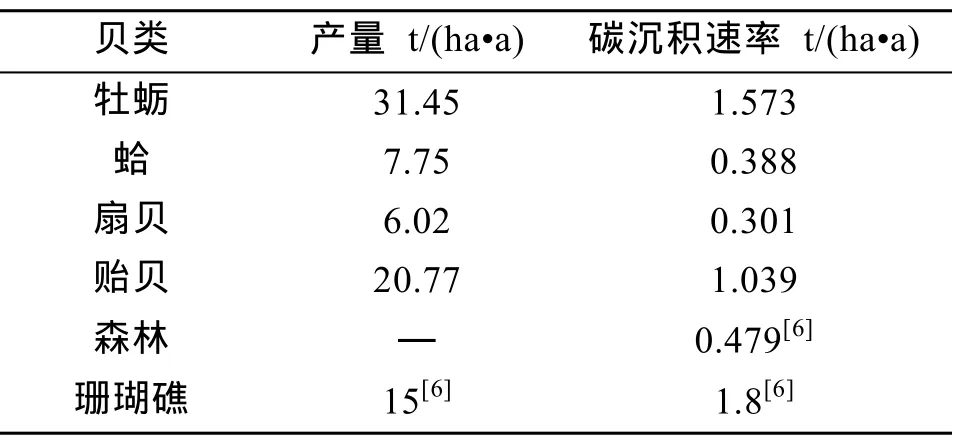
表2 4种贝壳、珊瑚和森林的碳沉积速率Tab.2 Carbon deposition rate of four kinds of shellfishes,coral reef and forest
2.4.1 贝类养殖与森林碳沉积能力比较
如2.3所述,目前中国贝类养殖和捕获的碳沉积能力约为58.57万t/a,约相当于122.28万ha的造林,仅占大气CO2增加量的0.0125 %,远低于目前森林19.2亿t/a的碳沉积能力[6]。然而森林的碳沉积能力受到森林面积有限的限制,即一定面积下森林仅能成长至其生物质量的极限值,其碳沉积与碳释放达到平衡后则难以再进行碳沉积作用。但以贝壳来进行碳沉积则可以时间换取空间来进行长期持续的累积,避免了森林受限于单位面积下生物质量生长极限值的限制,并且全球的森林正以 730万 ha/a的速度在减少[26],其碳沉积能力也将随着逐渐降低,但以贝类来生产 CaCO3的碳沉积能力,目前仍有成长空间。另外,若以单位面积的碳沉积能力作比较,牡蛎、贻贝的碳沉积能力高于森林(表2)。
2.4.2 贝类养殖与珊瑚碳沉积能力比较
虽然表 2的结果显示贝类养殖单位面积的碳沉积能力不及珊瑚礁,但是目前的全球暖化与海洋酸化严重影响珊瑚礁的存活率和生长。珊瑚礁对海洋酸化显得敏感脆弱,估计到 21世纪中叶,主要的造礁生物、珊瑚与钙化藻类的钙化率将比工业化前下降10%~50 %[27]。但目前的海洋酸化对贝类养殖似乎不会造成什么影响[6]。Waldbusser等[28]指出在pH下降0.5的环境下,东方牡蛎(Crassostrea virginica)的钙化将显著减少;而 Havenhand等[29]研究显示,即使未来海洋酸化导致海水 pH下降 0.35,也不影响太平洋牡蛎(Crassostrea gigas)精子的速度、活力与受精。因此目前的海洋酸化(~ –0.1 pH)对贝类的生长不会造成显著的影响,凸显出以贝类养殖进行碳沉积的优越性。
2.4.3 贝类养殖与碳捕捉、封存工程碳沉积能力比较
碳捕捉与封存(carbon capture and storage,CCS)工程是用来降低人类 CO2释放的重要选择,CCS工程是将燃烧石化燃料所释放出的 CO2予以捕捉后,经由运输并注入深层地底的碳贮槽(如深盐层、耗尽的油田与天然气槽)或深海以永久封存来达到碳沉积的效果[30]。将以贝壳掩埋和CCS工程来进行碳封存做比较,贝壳的陆地掩埋并不要求掩埋深度,甚至曝露堆积在地表、或在美国常见的以牡蛎壳来铺设路面(风化所造成的碳释放远低于堆积量),或将贝壳制备成微粉作为功能性填料用于树脂复合材料中都可达到碳封存的效果;若投置深海,工程上简单、成本低,对环境几乎无负面影响。若将捕捉的 CO2直接注入深海,容易造成深海的酸化,并需要直通深海的长管;而地层掩埋需相当的深度使不致释出,且难以保证长期不对环境造成负面影响,捕捉与注入成本都较高。因此以贝壳的碳沉积效果来进行CCS工程优于直接将CO2捕获、封存于深海。
2.4.4 贝类养殖与碳权交易
CO2的碳权交易价格最高逾 30欧元/t[6],若以30欧元/t估算,则中国淡、海水贝类养殖产量可分别创造32.4万欧元/a、1534.5万欧元/a的碳权商机,分别相当于人民币268.4万元/a、12 711.2万元/a。
3 结论
(1)中国贝类养殖和捕获总产量的碳沉积为58.57万t/a,碳沉积能力相当于122.28万ha的造林,可减少大气 CO2增加量的 0.0125%。其中海水养殖产量的碳沉积量为51.15万t/a,相当于106.78万ha的造林,可减少大气CO2增加量的0.0109 %。
(2)牡蛎、蛤、扇贝和贻贝单位面积的碳沉积能力分别为 1.573、0.388、0.301、1.039 t/(ha·a),与森林的碳沉积能力0.479 t/(ha·a)相比,并不逊色,尤其是牡蛎和贻贝甚至超过森林的碳沉积能力。贝类的碳沉积能力虽低于珊瑚礁的1.8 t/(ha·a),但在目前全球暖化或海洋酸化,珊瑚礁发育更加困难的情况下,兼之贝类具有食用经济价值,更显出以贝类养殖来进行碳沉积的可行性和优势。
(3)贝类养殖钙化作用的碳沉积能力具有降低大气中二氧化碳浓度的作用,所衍生的碳权商机,能吸引投资者主动投入,优于其他高成本的温室气体解决方案。
[1]严立文,黄海军,陈纪涛,等.我国近海藻类养殖的碳汇强度估算[J].海洋科学进展,2011,29(4): 537-545.
[2]张继红,方建光,唐启升.中国浅海贝藻养殖对海洋碳循环的贡献[J].地球科学进展,2005,20(3): 359-365.
[3]Sarmiento J L,Gruber N.Sinks for anthropogenic carbon[J].Physics Today,2002,55(8): 30-36.
[4]Houghton J.Global warming[J].Reports on Progress in Physics,2005,68(6): 1343-1403.
[5]Hansen J,Sato M,Ruedy R,et al.Global temperature change[J].Proceedings of the National Academy of Sciences,2006,103(39): 14288-14293.
[6]陈俊宏.二枚贝养殖的钙化作用与其碳隔离能力的评估[D].基隆: 台湾海洋大学,2010.
[7]Rodhe H.A comparison of the contribution of various gases to the greenhouse effect[J].Science,1990,248(4960): 1217-1219.
[8]Mckibben B.Carbon's new math[J].National Geographic,2007,212(4): 33-34.
[9]Doney S C,Fabry V J,Feely R A,et al.Ocean acidification:the other CO2problem[J].Marine Science,2009,1: 169-192.
[10]Tanner L H,Hubert J F,Coffey B P,et al.Stability of atmospheric CO2levels across the Triassic/Jurassic boundary[J].Nature,2001,411(6838): 675-677.
[11]Trenberth K.Uncertainty in hurricanes and global warming[J].Science,2005,308(5729): 1753-1754.
[12]Campbell-Lendrum D,Corvalán C.Climate change and developing-country cities: implications for environmental health and equity[J].Journal of Urban Health,2007,84(1): 109-117.
[13]Tyrrell T.Calcium carbonate cycling in future oceans and its influence on future climates[J].Journal of Plankton Research,2008,30(2): 141-156.
[14]Dasgupta S,Laplante B,Meisner C,et al.The impact of sea level rise on developing countries: A comparative analysis[J].Climatic Change,2007,93(3): 379-388.
[15]Miller A W,Reynolds A C,Sobrino C,et al.Shellfish face uncertain future in high CO2world: influence of acidification on oyster larvae calcification and growth in estuaries[J].PLoS One,2009,4(5): e5661.
[16]Durner G M,Douglas D C,Nielson R M,et al.Predicting 21st-century polar bear habitat distribution from global climate models[J].Ecological Monographs,2009,79(1): 25-58.
[17]Jones G P,Mccormick M I,Srinivasan M,et al.Coral decline threatens fish biodiversity in marine reserves[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(21): 8251-8253.
[18]Campbell-Lendrum D,Corvalán C.Climate change and developing-country cities: implications for environmental health and equity[J].Journal of Urban Health,2007,84(1): 109-117.
[19]Falkowski P,Scholes R J,Boyle E,et al.The global carbon cycle: a test of our knowledge of earth as a system[J].Science,2000,290(5490): 291-296.
[20]张明亮.栉孔扇贝生理活动对近海碳循环的影响[D].青岛: 中国科学院海洋研究所,2011.
[21]王凯雄,姚铭.全球变化研究热点——碳循环[J].浙江大学学报: 农业与生命科学版,2001,27(5): 473-478.
[22]Hoegh-Guldberg O,Mumby P J,Hooten A J,et al.Coral reefs under rapid climate change and ocean acidification[J].Science,2007,318(5857): 1737-1742.
[23]Khatiwala S,Primeau F,Hall T.Reconstruction of the history of anthropogenic CO2concentrations in the ocean[J].Nature,2009,462(7271): 346-349.
[24]张明亮,邹健,毛玉泽,等.养殖栉孔扇贝对桑沟湾碳循环的贡献[J].渔业现代化,2011,38(4): 13-16.
[25]农业部渔业局.中国渔业统计年鉴 2011[M].北京:中国农业出版社,2011: 1-120.
[26]Kinderman G E,Obersteiner M,Sohngen B,et al.Global cost estimates of reducing carbon emissions through avoided deforestation[J].Proceedings of the National Academy of Sciences,2008,105(30): 10302-10307.
[27]Kleypas J A,Yates K K.Coral reefs and ocean acidification[J].Oceanography,2009,22(4): 108-117.
[28]Waldbusser G G,Voigt E P,Bergschneider H,et al.Biocalcification in the eastern oyster (Crassostrea virginica)in relation to long-term trends in Chesapeake Bay pH[J].Estuaries and Coasts,2010,34: 221-231.
[29]Havenhand J N,Schlegel P.Near-future levels of ocean acidification do not affect sperm motility and fertilization kinetics in the oyster Crassostrea gigas [J].Biogeosciences,2009,6: 3009-3015.
[30]Herzog H J.What future for carbon capture and sequestration?[J].Environmental Science &Technology,2001,35(7): 148-153.

