多环芳烃在赤潮微藻光合作用中所起作用的研究❋
唐学玺,王 明,张 珺,张焕新,张智鹏,刘骋跃
(1.中国海洋大学生态学实验室,山东青岛266003;2.国立群山大学海洋科学学院,韩国群山573701)
多环芳烃在赤潮微藻光合作用中所起作用的研究❋
唐学玺1,王 明1,张 珺2,张焕新1,张智鹏1,刘骋跃1
(1.中国海洋大学生态学实验室,山东青岛266003;2.国立群山大学海洋科学学院,韩国群山573701)
采用实验生态学的方法,研究了3种多环芳烃-菲、芘和蒽对3种赤潮微藻-赤潮异弯藻、亚历山大藻和中肋骨条藻光合速率的影响。结果表明:较低浓度的菲、芘和蒽处理使3种赤潮微藻的光合速率有所提高,而较高浓度处理则降低了藻细胞的光合速率。3种多环芳烃-菲、芘和蒽胁迫对赤潮异弯藻光合速率的96 h·EC50分别为0.089、0.110和0.124 mg·L-1,对中肋骨条藻的96 h半抑制剂量分别为0.103、0.127和0.138 mg·L-1,对亚历山大藻的96 h半抑制剂量分别为0.116、0.131和0.141 mg·L-1,说明3种多环芳烃对赤潮微藻均表现出一定的毒性效应,其中菲的毒性作用最强。UV-B辐射(0.3 J·m-2的辐射剂量)和多环芳烃的联合作用一方面增强了菲、芘和蒽对3种赤潮微藻光合效率的抑制作用,导致光合速率明显降低,另一方面在一定程度上改变了3种多环芳烃毒性作用的强弱,使芘的毒性作用变得最强。
UV-B辐射;多环芳烃;赤潮异弯藻;亚历山大藻;中肋骨条藻;光合作用
在工业尚不发达的时期,人类产生的污染物较少,进入海洋的各种物质随之被海洋分解和净化,海洋自身并没有发生显著的变化,因此长期以来海洋是地球上最稳定的生态系统之一。但是自1980年代起,随着我国经济的快速发展,产生并排入海洋的污染物越来越多,海洋污染日趋严重,极大地限制了海洋资源的可持续利用和海洋经济的发展。
持久性有机污染物(Persistent Organic Pollutants,简称POPs)指的是能够长期存在于环境中,具有很长的半衰期,且能通过食物链放大,对人类健康及环境造成严重影响的有机化合物。多环芳烃(Polycyclic Aromatic Hydrocarbons,简称PAHs)是海洋环境中普遍存在的持久性有机污染物之一,能够在海洋生物体内富集和放大[1-5],不但对海洋生物产生毒害,而且还能危及人类健康。此外,多环芳烃还是一类环境内分泌干扰物质,能够干扰生物激素的正常产生和释放,影响生物的生殖和种群的繁衍与稳定。
PAHs是广泛存在的具有毒性,诱变和致癌作用的污染物,在自然条件下难以降解且其持久性随着分子量的增大而增加。因为其广泛存在,耐降解以及潜在的生物富集和致癌性而受到广泛关注。此外,在海洋生态系统中PAHs能够通过最上层水体的感光氧化作用和沉积物微生物的活动降解,但其在沉积物的广泛存在表明富集现象控制着降解过程,因而一些PAHs可能显示相似的发展动力学。
臭氧减少是由于人类活动向大气中排入氯氟烃(如氟里昂)和含溴卤化烷烃(哈龙)等气体引起的,臭氧层破坏已成为当前全球面临的环境问题之一。自1970年代以来就开始受到世界各国的关注。1985年,科学家首次发现,南极上空在9~10月平均臭氧含量减少50%左右,并周期性出现。北极臭氧层耗损也很明显。臭氧层减薄导致的紫外线B波段(UV-B)辐射增强,已对全球产生了显著的生态学效应[6-7]。有关UV-B辐射增强和多种污染物对海洋微藻的联合作用已有报道。结果显示,营养盐(N,P和Fe)的缺乏和UV-B辐射对海洋微藻的生长具有交互抑制作用[8-10]。唐学玺等[11]和Gala等[12]的研究指出,UV-B辐射和PAHs的联合作用一方面显著加剧了海洋微藻DNA的伤害程度,另一方面大大抑制了海洋微藻的生长和生理过程。海洋浮游微藻是引发赤潮的主要生物,其分泌的赤潮藻毒素能够直接导致海洋生物死亡,甚至能够通过食物链传递造成人类食物中毒。鉴于UV-B辐射和PAHs对微藻的交互影响,UV-B辐射和PAHs对赤潮藻以及赤潮的发生都可能存在十分重要的作用。
本文在前期工作的基础上[13-14],继续选用3种赤潮微藻-亚历山大藻、赤潮异弯藻和中肋骨条藻为材料,开展菲、芘和蒽和UV-B辐射对其光合作用的单独和耦合效应研究,为揭示UV-B辐射增强和PAHs对海洋生物乃至海洋生态系统的影响提供参考依据。
1 材料和方法
1.1实验藻种
中肋骨条藻(Skeletonema costatum)、赤潮异弯藻(Heterosigma akashiwo)和亚历山大藻(Alexandrium tamarense Balech)来自于中国海洋大学海洋生态学研究室,三者均属赤潮微藻。
1.2微藻培养
用于微藻培养的培养液采用f/2营养盐配方,3种赤潮微藻均在对数生长期接种。接种密度均为0.2× 104cell·mL-1。在整个实验过程中,控制培养温度:(19±1)℃;光照强度:3000lx;光暗周期:12∶12。每组实验设4个平行样。
1.3 UV-B辐射
首先建立UV-B辐射体系。紫外B灯由北京曙光电源厂生产,UV-B型紫外辐射强度仪由北京师范大学生产。用乙酸纤维素薄膜(上海生化试剂公司,厚度为0.12 mm)包被紫外B灯,以除去280 nm的短波辐射。在正式实验前,整个体系需连续照射72 h,以消除薄膜滤过作用的不稳定性。为防止薄膜老化,所用薄膜每隔1周更换1次。
辐射过程中,保持辐射强度为1.25μW·cm-2,通过控制辐射时间调整辐射剂量。参照蔡恒江等[15]的研究结果,选择UV-B辐射剂量为0.3 J·m-2,每天以紫外B灯取代日光灯管照射处理。
1.4 PAHs暴露实验
将3种多环芳烃溶于丙酮配成一定浓度的母液,于4℃避光保存。根据预备实验的结果,配置含有0、0.03、0.06、0.09、0.12和0.15 mg·L-1菲、芘和蒽的培养液。3种赤潮微藻在对数生长期接种,接种密度为0.2×104cell·mL-1。一次性培养96 h后取样,分别测定其光合速率。
1.5光合速率的测定与计算
采用黑白瓶定氧法测定。用虹吸法将黑白瓶装满经过不同剂量UV-B辐射处理的藻液,藻液加入前充分爆气,使其CO2和空气中CO2处于平衡状态,然后塞紧瓶塞,使之进行光合作用。反应过程中光源为40 W的白色日光灯,光强控制为3000lx(~60μmol·m-2·s-1),温度设置为(19±1)℃,反应时间设定为50 min。反应终止后用YSI DO200型溶氧仪测定溶氧浓度,计算单位水体中氧的增加量,以此表示单位水体中藻的净光合速率,并计算相对光合速率:
相对光合速率=(处理组净光合速率/对照组净光和速率)×100%。
1.6数据分析
以单因素方差分析分析分别检验不同浓度下,菲、芘和蒽对3中赤潮藻光合速率的影响。数据分析前分别以Levene’s检验和Shapiro-Wilk检验验证方差齐性和正态性。显著性水平设定为α=0.05,数据分析采用IBM SPSS 19.0(SPSS Inc,U.S.)进行。
2 结果
2.1菲、芘和蒽暴露条件下赤潮异弯藻光合速率的变化
菲、芘和蒽暴露条件下赤潮异弯藻光合速率的变化显示出一定的规律性(见图1),在本实验选择的最低处理浓度,即0.03 mg·L-1暴露下,菲对赤潮异弯藻的光合速率没有明显的影响(P>0.05),芘和蒽处理使赤潮异弯藻的光合速率都有所提高(P<0.05),与对照组相比差异显著,显示出二者在低浓度下的刺激作用。其次,当处理浓度提高到0.06 mg·L-1时,菲处理对赤潮异弯藻的光合速率明显降低,与对照组相比差异极显著(P<0.01),芘和蒽处理对赤潮异弯藻的光合速率没有显著的影响(P>0.05)。随着处理浓度的继续提高,赤潮异弯藻的光合速率明显下降,与对照组相比差异显著(P<0.01),说明高浓度的PAHs暴露对赤潮异弯藻光合作用有显著抑制作用。根据相对光合速率的变化求得菲、芘和蒽对赤潮异弯藻光合速率的96 h· EC50分别为0.089、0.110和0.124 mg·L-1。
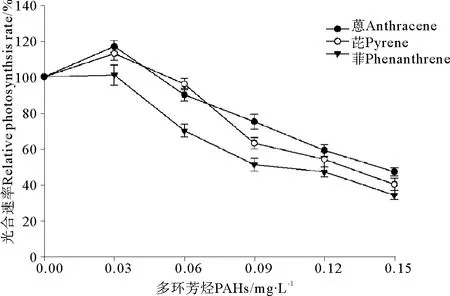
图1 3种多环芳烃处理对赤潮异弯藻光合速率的影响Fig.1 The effects of three kinds of polycyclic aromatic hydrocarbons treatment on photosynthetic rate of Heterosigma akashiwo
2.2菲、芘和蒽暴露条件下中肋骨条藻光合速率的变化
在3种多环芳烃-菲、芘和蒽暴露条件下中肋骨条藻光合速率的变化同样显示出类似的规律性(见图2)。在本实验选择的最低暴露浓度(0.03 mg·L-1)条件下,菲、芘和蒽引起中肋骨条藻的光合速率有所提高,与对照组相比差异显著(P<0.05)。其次,随着处理浓度的不断提高,中肋骨条藻的光合速率逐渐下降。当浓度大于0.06 mg·L-1时,与对照组相比光合速率的下降极显著(P<0.01),说明高浓度的PAHs暴露对中肋骨条藻的光合作用有显著抑制作用。根据相对光合速率的变化求得菲、芘和蒽对中肋骨条藻光合速率的96 h·EC50分别为0.103、0.127和0.138 mg·L-1。
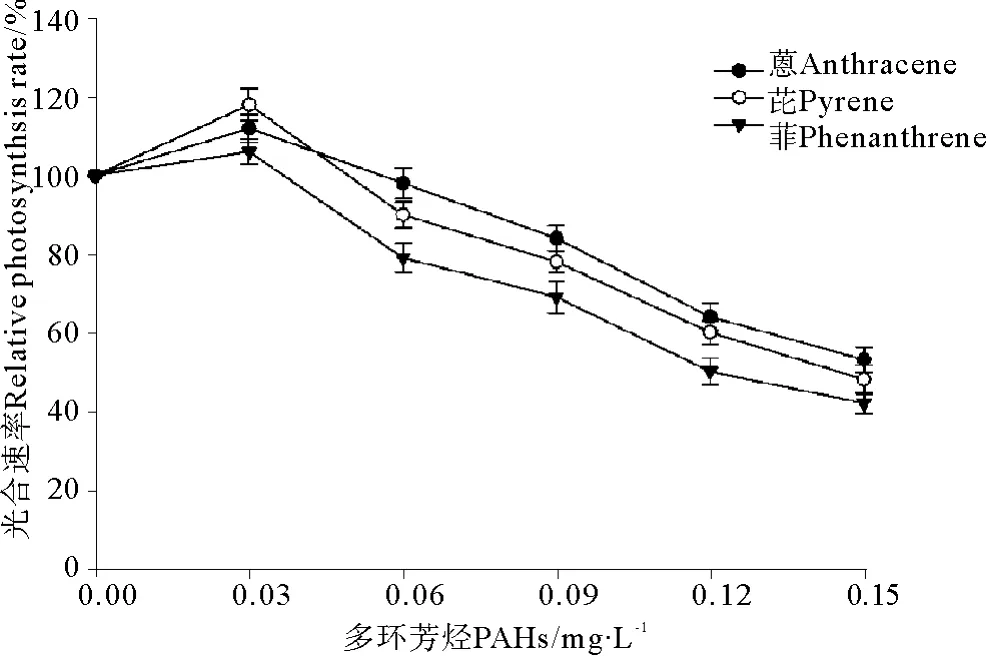
图2 3种多环芳烃处理对中肋骨条藻光合速率的影响Fig.2 The effects of three polycyclic aromatic hydrocarbons treatment on photosynthesis rate of Skeletonema costatum
2.3菲、芘和蒽暴露条件下亚历山大藻光合速率的变化
菲、芘和蒽暴露条件下,亚历山大藻光合速率的变化见图3。在本实验选用的较低处理浓度(0.03和0.06 mg·L-1)暴露条件下,3种多环芳烃-菲、芘和蒽对亚历山大藻光合速率的影响总体上不明显,有时甚至出现提高的现象。当浓度达到0.09 mg·L-1时,蒽处理对亚历山大藻的光合速率仍然没有明显影响,与对照组相比差异不显著(P>0.05)。当菲、芘和蒽处理浓度提高到最高0.15 mg·L-1时,亚历山大藻的光合速率出现明显下降,与对照组相比差异极显著(P<0.01),这充分说明高浓度的PAHs暴露对亚历山大藻的光合作用有显著抑制作用。根据相对光合速率的变化求得菲、芘和蒽对亚历山大藻光合速率的96 h· EC50分别为0.116、0.131和0.141 mg·L-1。
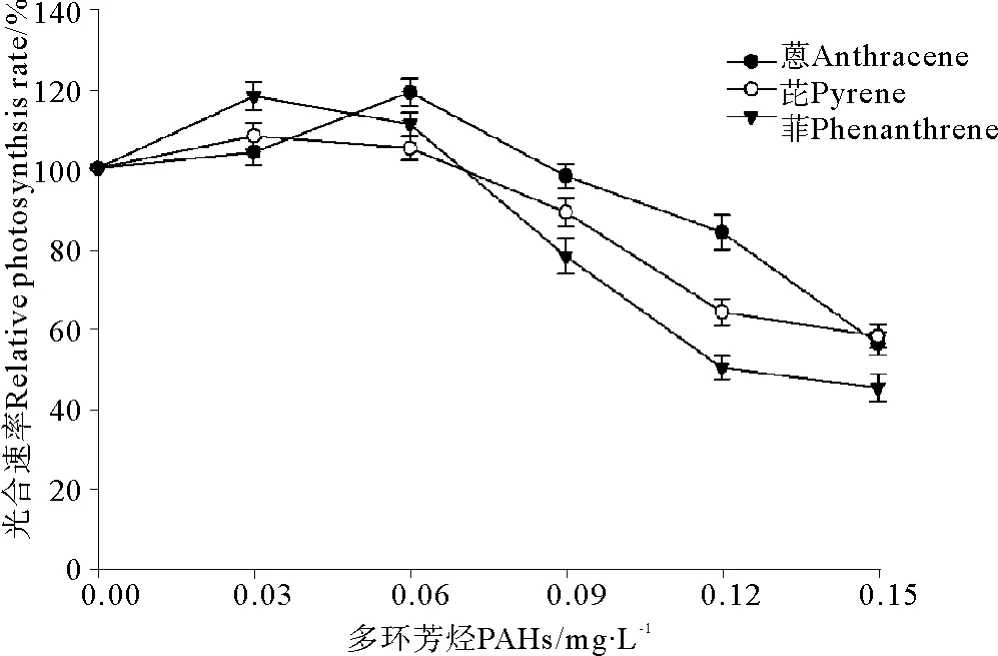
图3 3种多环芳烃暴露条件下对亚历山大藻光合速率的变化Fig.3 The effects of three kinds of polycyclic aromatic hydrocarbons on photosynthetic rate of Alexandrimu tamarense Balech
2.4 3种PAHs和UV-B辐射联合暴露条件下赤潮异弯藻光合速率的变化
菲、芘、蒽与UV-B辐射(0.3 J·m-2)联合暴露条件下赤潮异弯藻光合速率的变化见图4。结果表明,UV-B辐射加重了3种PAHs在单独暴露条件下对赤潮异弯藻光合速率的抑制效应。与单独暴露条件下的结果(见图1)相比,赤潮异弯藻的光合速率显著下降。芘和蒽在单独暴露浓度为0.03 mg·L-1时,光合速率呈现出升高的现象(见图1),但是当附加0.3 J·m-2UV-B辐射后,光合速率呈现出降低的现象(见图5)。另一方面,0.3 J·m-2的UV-B辐射引起了菲、芘和蒽对赤潮异弯藻毒性大小的改变,图1、4比较发现,在单独暴露条件下菲、芘和蒽对赤潮异弯藻毒性大小是菲>芘>蒽(见图1),菲的毒性最大;在与UV-B辐射(0.3 J·m-2)联合暴露条件下,菲、芘、蒽对赤潮异弯藻毒性大小是芘>菲>蒽(见图4),芘的毒性最大。
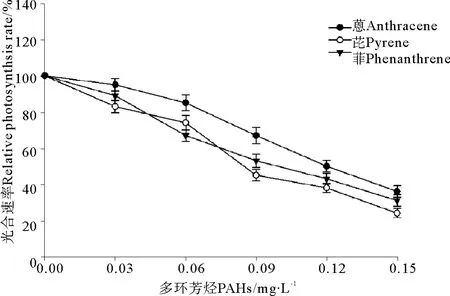
图4 3种多环芳烃与UV-B辐射联合暴露条件下赤潮异弯藻光合速率的变化Fig.4 The joint effects of three kinds of polycyclic aromatic hydrocarbons and UV-B radiation on photosynthetic rate of Heterosigma akashiwo
2.5 3种PAHs和UV-B辐射联合暴露条件下中肋骨条藻光合速率的变化
菲、芘、蒽与UV-B辐射(0.3 J·m-2)联合暴露条件下中肋骨条藻光合速率的变化见图5。结果表明,UV-B辐射同样加重了3种PAHs在单独暴露条件下对中肋骨条藻光合速率的抑制效应。与单独暴露条件下的结果(见图2)相比,中肋骨条藻的光合速率显著下降。3种PAHs在单独暴露浓度为0.03 mg·L-1时,光合速率呈现出升高的现象(见图2),但是当附加0.3 J·m-2UV-B辐射后,光合速率呈现出降低的现象(见图5)。另一方面,0.3 J·m-2的UV-B辐射引起了菲、芘和蒽对中肋骨条藻毒性大小的改变,图2、5比较发现,在单独暴露条件下菲、芘和蒽对中肋骨条藻毒性大小是菲>芘>蒽,菲的毒性最大(见图2);在与UV-B辐射(0.3 J·m-2)联合暴露条件下,菲、芘、蒽对中肋骨条藻毒性大小是芘>菲>蒽,芘的毒性最大(见图5)。
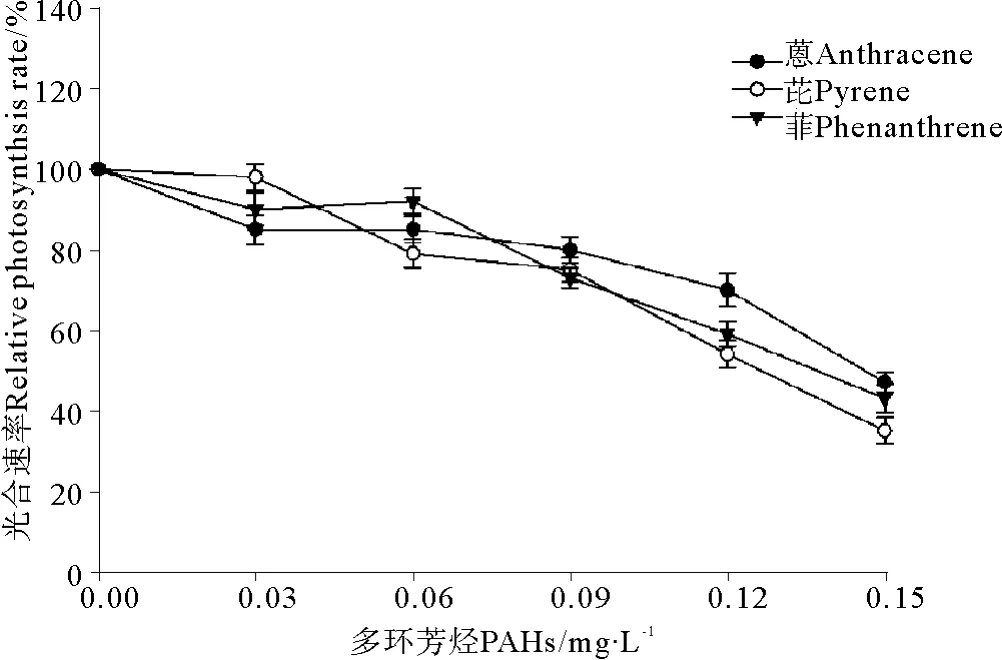
图5 3种多环芳烃与UV-B辐射联合暴露条件下中肋骨条藻光合速率的变化Fig.5 The joint effects of three kinds of polycyclic aromatic hydrocarbons and UV-B radiation on photosynthetic rate of Skeletonema costatum
2.6 3种PAHs和UV-B辐射联合暴露条件下亚历山大藻光合速率的变化
菲、芘、蒽与UV-B辐射(0.3 J·m-2)联合暴露条件下亚历山大藻光合速率的变化见图6。结果表明,UV-B辐射仍然加重了3种PAHs在单独暴露条件下对亚历山大藻光合速率的抑制效应。与单独暴露条件下的结果(见图3)相比,亚历山大藻的光合速率显著下降(见图6)。另一方面,0.3 J·m-2的UV-B辐射引起了菲、芘和蒽对亚历山大藻毒性大小的改变,图3、6比较发现,在单独暴露条件下菲、芘和蒽对亚历山大藻毒性大小是菲>芘>蒽,菲的毒性最大(见图3);在与UVB辐射(0.3 J·m-2)联合暴露条件下,菲、芘、蒽对亚历山大藻毒性大小是芘>菲>蒽,芘的毒性最大(见图6)。
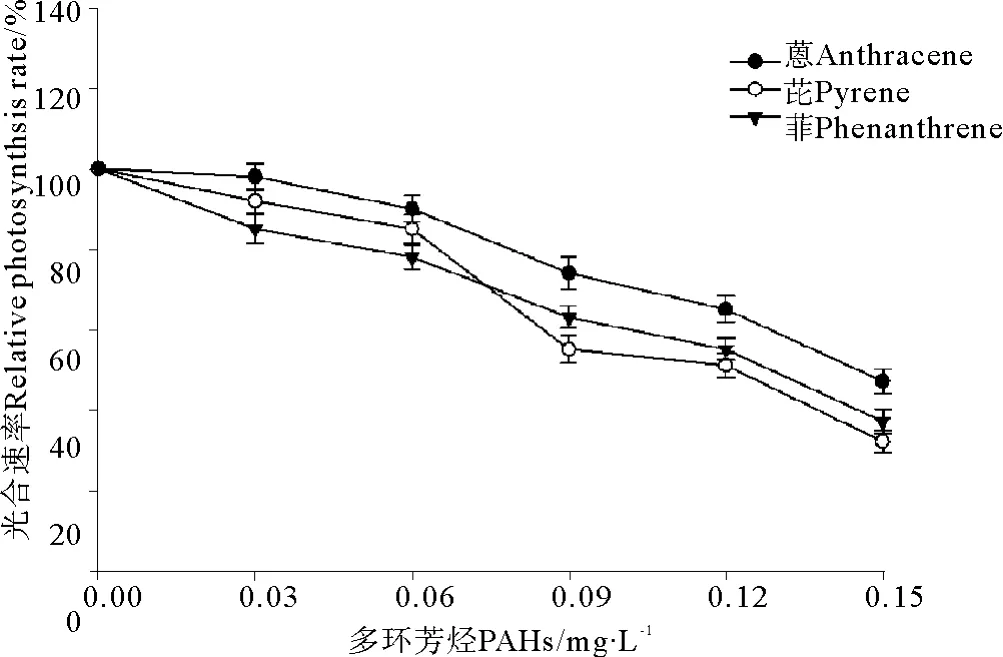
图6 3种多环芳烃与UV-B辐射联合暴露条件下亚历山大藻光合速率的变化Fig.6 The joint effects of three kinds of polycyclic aromatic hydrocarbons and UV-B radiation t on photosynthetic rate of Alexandrimu tamarense Balech
3 讨论
3.1 3种多环芳烃对赤潮微藻光合速率影响的差异性分析
不同类型的污染物对同一种生物的毒性往往显示出很大的差异,即使是同一类型的污染物(有机磷农药、有机氯农药和多溴联苯醚等),由于化学结构不同其对生物的毒性大小也会出现较大差异。研究指出三苯基锡对海洋微藻的毒性要远远大于三丁基锡[16]。有机磷农药对害虫和其他非靶生物的毒性大小也不相同,这与它们在化学结构上的差异紧密相关[17]。邹立等[18]研究了11种有机磷农药对海洋亚心形扁藻的毒性效应并分析了构效关系,指出这11种有机磷农药对扁藻的毒性大小各不相同,并与它们化学结构的差异密切相关。王娜等[19]报道了6种有机磷农药对浮游生物毒性大小的构效关系,同样证实有机磷农药的毒性大小主要取决于其本身的化学结构。多溴联苯醚是一类新兴的有机污染物,其对海洋生物的毒性大小差异显著并与自身的化学结构有关。研究表明,高溴代多溴联苯醚的毒性往往大于低溴代多溴联苯醚[20]。本文选用的3种PAHs对3种赤潮微藻(赤潮异弯藻、中肋骨条藻和亚历山大藻)光合速率抑制作用的大小同样显示出一定的差异性,这可能与他们因化学结构不同而导致的毒性大小差异有关。这与作者前期以菲、芘、蒽为毒物,以赤潮微藻(赤潮异弯藻、中肋骨条藻和亚历山大藻)为受试生物开展的关于对微藻生长和类胡萝卜素含量影响的研究结果一致[13-14]。
3.2多环芳烃和UV-B辐射对赤潮微藻的联合效应
有关多环芳烃和UV-B辐射对海洋生物的联合作用在国内外已有许多工作。Gala等[11]和唐学玺等[12]通过各自的研究指出,在多环芳烃(PAHs)单独暴露条件下,浮游植物的DNA受到伤害,生长和光合作用被抑制;当附加UV-B辐射时,这种伤害和抑制效应明显加强。其机理[21-22]在于当多环芳烃受到UV-B辐射时发生了光敏化,产生了对生物体有间接氧化伤害作用的活性氧自由基,继而加剧了多环芳烃对海洋微藻的伤害效应。另有研究表明,多环芳烃进入生物体内会选择性地积累在细胞的溶酶体中,而当生物体再次受到UV-B辐射时,积累在溶酶体中的多环芳烃又会发生光敏化作用,对溶酶体造成间接的氧化伤害[23-24]。对鱼类的研究工作表明,多环芳烃往往会选择性地积累在鱼类鳃细胞中并产生毒性作用,而当鱼类继续受到UV-B辐射时,其毒性可以上千倍地提高[25]。本文选择的3种多环芳烃对3种赤潮微藻都表现出了较高的毒性,与UV-B辐射(0.3 J·m-2)联合作用时,毒性更大。蔡恒江等[15]的工作证实,0.3 J·m-2的UV-B辐射剂量单独作用时,对这3种赤潮微藻(亚历山大藻、中肋骨条藻和赤潮异弯藻)没有表现出毒性作用。所以作者判断,UV-B辐射很可能引发了3种多环芳烃的光敏化,导致了活性氧自由基的爆发产生,继而造成了赤潮微藻的间接氧化伤害。
3.3联合作用下多环芳烃毒性大小发生变化的原因
在单独暴露条件下,3种多环芳烃对3种赤潮微藻毒性大小都是菲>芘>蒽,菲的毒性最大,蒽的毒性最小,芘的毒性位于其间;当菲、芘和蒽分别与UV-B辐射(0.3 J·m-2)联合作用时,对3种赤潮微藻的毒性大小依次是芘>菲>蒽,芘的毒性最大。毒性大小的改变很可能与菲、芘和蒽的光敏化差异密切相关。已证实,积累在生物体内的多环芳烃在UV-B辐射条件下发生光敏化作用,进而对生物体造成间接的氧化伤害[23-24]。文本选择的菲、芘和蒽具有不同的化学结构特点,所以三者在UV-B辐射暴露条件下发生光敏化的程度必然存在差异。因此推测,与菲和蒽相比,芘的化学结构特征可能更容易在UV-B辐射下发生光敏化,产生更多的有氧化伤害作用的活性氧自由基,因此表现出更高的毒性作用。
海洋生态系统是一个极其复杂的系统,其中的污染物以不同性质、不同种类、不同水平的复合体系共存。这些污染物之间可以通过矢量加和、协同或拮抗作用对海洋生态系统产生复杂的影响,导致生物群落和生物资源产生一系列不可逆的影响。阐明多种典型海洋污染物的复合作用对海洋生态系统影响的效应和本质是必须面对的一个科学问题。
[1] Siron R,Pelletier E,Delille D,et al.Fate and effects of dispersed crude oil under icy conditions simulated in mesocosms[J].Marine Environmental Research,1993,35(3):273-302.
[2] Warshawsky D,Cody T,Radike M,et al.Biotransformation of benzo[a]pyrene and other polycyclic aromatic hydrocarbons and heterocyclic analogs by several green algae and other algal species under gold and white light[J].Chemico-Biological Interactions,1995,97(2):131-148.
[3] Carman K R,Fleeger J W,Pomarico S M.Response of a benthic food web to hydrocarbon contamination[J].Limnology and Oceanography,1997,42(3):561-571.
[4] Kalf D F,Crommentuijn T,van de Plassche E J.Environmental quality objectives for 10 polycyclic aromatic hydrocarbons(PAHs)[J].Ecotoxicology and Environmental Safety,1997,36(1):89-97.
[5] Erickson R J,Ankley G T,DeFoe D L,et al.Additive toxicity of binary mixtures of phototoxic polycyclic aromatic hydrocarbons to the oligochaete Lumbriculusυariegatus[J].Toxicology and Applied Pharmacology,1999,154(1):97-105.
[6] Boucher N P,Prezelin B B.Spectral modeling of UV inhibition of in situ Antarctic primary production using a field-derived biological weighting function[J].Photochemistry and Photobiology,1996,64(3):407-418.
[7] Smith R C,Prezelin B B,Baker K S,et al.Ozone depletion:ultraviolet radiation and phytoplankton biology in Antarctic waters[J]. Science,1992,255(5047):952-959.
[8] Shick J M,Dunlap W C.Mycosporine-like amino acids and related gadusols:Biosynthesis,accumulation,and UV-protective functions in aquatic organisms[J].Annual Review of Physiology,2002,64(1):223-262.
[9] Litchman E,Neale PJ,Banaszak A T.Increased sensitivity to ultraviolet radiation in nitrogen-limited dinoflagellates:photoprotection and repair[J].Limnology and Oceanography,2002,47(1):86-94.
[10] Raven J A,Evans M CW,Korb R E.The role of trace metals in photosynthetic electron transport in O2-evolving organisms[J]. Photosynthesis Research,1999,60(2-3):111-150.
[11] Gala W R,Giesy JP.Using the carotenoid biosynthesis inhibiting herbicide,Fluridone,to investigate the ability of carotenoid pigments to protect algae from the photo-induced toxicity of anthracene[J].Aquatic Toxicology,1993,27(1):61-70.
[12] 唐学玺,黄健,王艳玲,等.UV-B辐射和蒽对三角褐指藻DNA伤害的相互作用[J].生态学报,2002,22(3):375-378.
[13] 王云彗,肖慧,唐学玺.多环芳烃对3种赤潮微藻类胡萝卜素含量的影响及其对UV-B辐射的响应[J].中国海洋大学学报:自然科学版,2007,37(4):631-635.
[14] 周立明,孟祥红,肖慧,等.3种多环芳烃和UV-B辐射对3种赤潮微藻生长的作用[J].武汉大学学报:理学版,2007,52(6):773-777.
[15] 蔡恒江,唐学玺,张培玉.3种赤潮微藻对UV-B辐射处理的敏感性[J].海洋科学,2005,29(3):30-32.
[16] 高尚德,吴以平,赵心玉.有机锡对海洋微藻的生理效应:Ⅰ.三苯基锡和三丁基锡对光合色素含量的影响[J].海洋与湖沼,1994,25(3):259-265.
[17] 谢昆,乔澍,付川,等.有机磷农药定量构效关系研究进展[J].重庆三峡学院学报,2011,27(3):88-90.
[18] 邹立,李永祺.用QSAR法研究有机磷农药对海洋扁藻的构效关系[J].海洋与湖沼,1999,30(2):206-211.
[19] 王娜,刘莉莉,孙凯峰,等.有机磷农药的构效关系及其对浮游生物的毒性效应[J].生态环境学报,2012,21(1):118-123.
[20] 唐学玺,柯可,王悠.多溴联苯醚在海洋环境中的分布及其对海洋生物的影响研究[J].海洋湖沼通报,2010,1:36-46.
[21] Lesser M P.Elevated temperatures and ultraviolet radiation cause oxidative stress and inhibit photosynthesis in symbiotic dinoflagellates[J].Limnology and Oceanography,1996,41(2):271-283.
[22] 唐学玺,杨震,王悠,等.紫外辐射诱发三角褐指藻自由基伤害的研究[J].海洋通报,1999,18(4):93-96.
[23] Moor M N,Lowe D M.UV-B radiation,pollutants and health of coastal seas:Pilot study,report to the department of the environment EPG[R].Ostend,Belgium:ICES Marine Habitat Committee,1995:14.
[24] Lowe D M,Soverchia C,Moore M N.Lysosomal membrane responses in the blood and digestive cells of mussels experimentally exposed to fluoranthene[J].Aquatic Toxicology,1995,33(2):105-112.
[25] Oris J T.Solar ultraviolet radiation enhanced toxicity of polycyclic aromatic hydrocarbons in aquatic systems[C].NY(USA):Iaglr.Buffalo,1994:166.
Study on the Effects of Polycyclic Aromatic Hydrocarbons on the Photosythesis in Red Tide Microalgae
TANG Xue-Xi1,WANG Ming1,ZHANG Jun2,ZHANG Huan-Xin1,ZHANG Zhi-Peng1,LIU Cheng-Yue1
(1.Ecology Laboratory,Ocean University of China,Qingdao 266003,China;2.College of Marine Science,Kunsan National University,Kunsan 573701,Korea)
The photosynthesis responses of Heterosigma akashiwo,Skeletonema costatum and Alexandrium tamarense Balech to polycyclic aromatic hydrocarbons(PAHs)exposure treatment was studied by experimental ecology methods.The results showed that lower concentration of phenanthrene,pyrene and anthracene could promote the photosynthesis of Heterosigma akashiwo,Skeletonema costatum and Alexandrium tamarense Balech.However,higher concentration of phenanthrene,pyrene and anthracene exhibited inhibition to photosynthesis rate.The 96 h·EC50values of phenanthrene,pyrene and anthracene treatment to photosynthesis of Heterosigma akashiw were 0.89,0.110 and 0.124 mg·L-1respectively,and that to Skeletonema costatum were 0.103,0.127 and 0.138 mg·L-1and to Alexandrium tamarense Balech were 0.116,0.131 and 0.141 mg·L-1.The results indicated that three kinds of polycyclic aromatic hydrocarbons exhibited certain toxicity to red tide microalgae,and toxicity of phenanthrene was strongest.The combination of 0.3 J·m-2UV-B radiation and polycyclic aromatic hydrocarbons intensified the inhibition to photosynthesis rate,which declined more significantly than single exposure in polycyclic aromatic hydrocarbons in three species of red tide microalgae.On the other hand,it changed the three PAHs toxicity in a certain extent,which was strongest in pyrene.
UV-B radiation;Polycyclic Aromatic Hydrocarbons;Heterosigma akashiwo;Alexandrium tamarense Balech;Skeletonema costatum;photosynthesis
Q 89
A
1672-5174(2014)10-080-06
责任编辑 高 蓓
国家自然科学基金委员会-山东省人民政府海洋科学研究中心联合资助项目(U1406403)资助
2014-08-03;
2014-08-28
唐学玺(1965-),男,教授,博导,主要从事海洋生态毒理学的研究工作。E-mail:tangxx@ouc.edu.cn

