杏仁中央核内注射μ阿片受体激动剂DAMGO增加蔗糖溶液摄入引起的Fos表达
孙 波,闫剑群,王 倩,赵小林,李金容,闫 薇,宋 琳
(西安交通大学医学院生理学与病理生理学系,陕西西安 710061)
杏仁中央核内注射μ阿片受体激动剂DAMGO增加蔗糖溶液摄入引起的Fos表达
孙 波,闫剑群,王 倩,赵小林,李金容,闫 薇,宋 琳
(西安交通大学医学院生理学与病理生理学系,陕西西安 710061)
目的探讨杏仁中央核内μ阿片受体对大鼠蔗糖溶液摄入的影响及调节机制。方法杏仁中央核注入μ阿片受体激动剂DAMGO或生理盐水(Saline),测量大鼠对蔗糖溶液及蒸馏水的摄入量;利用免疫组化方法观察注入DAMGO或Saline后,蔗糖溶液摄入引起的Fos免疫阳性神经元的分布和数量。结果与Saline组相比,DAMGO注射增加3 h的蔗糖溶液摄入量,并在伏隔核(核),弓状核,外侧下丘脑,吻端、中间及尾端孤束核核团增加蔗糖摄入引起的Fos表达。结论杏仁中央核内μ阿片受体的激活可能通过作用于伏隔核、弓状核、外侧下丘脑及孤束核参与大鼠蔗糖溶液摄入的调节。
杏仁中央核;μ阿片受体;蔗糖溶液摄入;Fos
杏仁中央核(CeA)是边缘系统中与情感、动机和摄食等有关的结构。Ce A中的谷氨酸能神经元参与甜味觉的传递[1],而GABA能神经元参与钠欲调节[2]。在中枢神经系统中,阿片肽主要参与奖赏相关行为的调节。研究表明,CeA内存在大量μ阿片受体(μopioid receptor,MOR)[3]。我们之前的研究显示,Ce A内注入MOR激动剂DAMGO可增加大鼠对蔗糖溶液的摄入[4],但其具体机制有待进一步研究。BOT[5]研究发现在豚鼠脑室内给予DAMGO可引起许多部位c-Fos表达的增加,包括杏仁核,下丘脑及伏隔核等。据此假设Ce A内注入DAMGO增加大鼠蔗糖溶液的摄入可能通过以下机制实现:DAMGO作用于Ce A中的MOR,通过由Ce A发出的纤维投射,影响其他与蔗糖溶液摄入相关的脑区或核团的活动,从而调节蔗糖溶液的摄入。LEVINE[6]研究发现,Ce A内注入DAMGO可增加伏隔核壳部的c-Fos表达,而对于其他脑区或核团的c-Fos表达并没有影响。本研究将Ce A内DAMGO注射与蔗糖溶液摄入相结合,了解Ce A内DAMGO注射对于蔗糖溶液摄入引起的相关核团Fos表达的影响,从而进一步研究Ce A内DAMGO注射增加蔗糖溶液摄入的机制。
1 材料与方法
1.1 实验动物健康雄性SD大鼠30只,体质量210~250 g,由西安交通大学医学院实验动物中心提供。动物分笼饲养,动物房温度维持在20~24℃,光暗周期为12 h∶12 h,无强烈声光刺激。所有动物适应饲养环境1周,其间自由进食正常大鼠饲料并自由饮用蒸馏水。30只大鼠随机分为两批,一批用于双瓶选择实验(n=15),另一批用于Fos表达实验(n=15)。
1.2 单侧CeA内套管植入手术水合氯醛(300 mg/kg)腹腔注射麻醉动物,固定大鼠头部于脑立体定位仪上,使前囟和后囟处于同一平面。根据大鼠脑图谱确定CeA的位置:前囟后2.4 mm,中缝旁开4.1 mm,脑表面下7.0 mm。单侧Ce A植入26G不锈钢套管。术后连续3 d腹腔注射青霉素(20 000 U)防感染。术后大鼠恢复5 d,使体质量升至术前水平。
1.3 双瓶选择实验及套管位置鉴定训练开始前24 h,将水瓶从笼中移除。第2天早上8∶30,给予大鼠双瓶供水,两个刻度饮水瓶(250 m L)放置饲养笼前,间隔5 cm,瓶内均为蒸馏水;3 h后,将水瓶移除。大鼠在早上8∶30~11∶30进行双瓶饮水,其余时间禁水。饮水期间将食物撤除。以上述条件适应性训练5 d,并进行核团注射训练,使大鼠适应注射过程。
上述训练后,进行双瓶选择试验,流程如下:实验前禁水24 h;实验当天早上8∶15,给予大鼠单侧Ce A注射0.5μL DAMGO(2 nmol,Sigma)或生理盐水,注射60 s,停留60 s;注射后15 min,将两个已知质量的水瓶放置饲养笼前,一个为0.3 mol/L的蔗糖溶液,另一个为蒸馏水;3 h后,将水瓶移除并称重,计算出蔗糖溶液及蒸馏水的摄入量。
每只大鼠均接受两次注射,一次为DAMGO,一次为生理盐水;两次注射的间隔时间为3 d。双瓶选择实验结束后,向CeA中注入0.5μL膀胺天蓝,所有动物经致死剂量戊巴比妥钠腹腔注射麻醉(100 mg/kg),并相继用100 mL生理盐水及200 mL的100 mL/L甲醛溶液经左心室灌流固定,剥离脑组织,置入100 mL/L甲醛溶液中。脑组织做冠状冰冻切片(片厚40μm)。在切取的脑片中,选取含有CeA的切片,光镜下参照大鼠脑图谱对套管位置进行定位。
1.4 CeA内注射DAMGO后蔗糖溶液摄入引起的Fos表达训练开始前24 h,将水瓶从笼中移除。第2天早上9∶30,将水瓶放回饲养笼前,瓶内为蒸馏水;2 h后,将水瓶移除。大鼠在早上9∶30~11∶30饮水,其余时间禁水。饮水期间将食物撤除。以上述条件适应性训练5 d,并进行核团注射训练,使大鼠适应注射过程。
上述训练后,15只大鼠随机分为生理盐水组(n =7)和DAMGO组(n=8),进行如下实验:实验前禁水24 h;实验当天早上9∶15,给予大鼠单侧Ce A注射0.5μL DAMGO(2 nmol,Sigma)或生理盐水,注射60 s,停留60 s;注射后15 min,将水瓶放置饲养笼前,瓶内为0.3 mol/L的蔗糖溶液;2 h后,将水瓶移除,向Ce A中注入0.5μL膀胺天蓝,将大鼠用致死量的水合氯醛麻醉,开胸,先以0.01 mol/L PBS(p H 7.4)100 m L经左心室至主动脉进行快速灌注,然后用含750 g/L饱和苦味酸和40 g/L多聚甲醛的0.1 mol/L PB(p H 7.4)250 m L快速灌注固定,再以同样的灌注液250 m L缓慢滴注,持续1.5~2 h。灌注完毕后取脑组织,后固定4 h,再移入250 g/L蔗糖溶液中,4℃过夜。脑组织完全沉底后,用冰冻切片机冠状切取,片厚40μm,用0.01 mol/L PBS冲洗3次,每次10 min,用于Fos免疫组化标记。
1.5 套管位置鉴定及Fos免疫组化检测切取的脑片中,选取含有CeA的切片,光镜下参照大鼠脑图谱对套管位置进行定位,套管位置正确的大鼠继续进行Fos免疫组化实验。
切片先后经3 m L/L的双氧水和3 m L/L Triton X-100孵育后,50 m L/L的山羊血清封闭1 h后,加rabbit anti-c-Fos一抗(Abcam,1∶800稀释)的抗体稀释液并应用链霉亲和素-过氧化物酶试剂盒(Zhongshan Bio-tech Co.)进行二抗及辣根过氧化物酶-卵白素孵育;最后利用3,3'-二氨基联苯胺盐酸盐(DAB)使免疫反应产物显色。将染色切片在光学显微镜下观察并照相。此外,另取一套脑片,进行阴性对照(不加一抗)实验。进行Fos免疫阳性神经元计数时,对于不同的核团,双侧均计数后取平均值。
1.6 数据处理各组数据均以均数±标准误表示。双瓶选择实验中,每只大鼠均接受两种不同处理,即DAMGO注射以及生理盐水注射,属于同源配对,采用配对t检验;Fos表达实验中,实验大鼠被随机分成两组,即DAMGO组及生理盐水组,采用两独立样本均数的t检验。所有数据均采用SPSS 13.0软件进行统计分析,P<0.05作为有显著性差异的统计学标准。
2 结 果
2.1 组织学定位参考大鼠脑图谱(图1),双瓶选择实验15只大鼠中有4只Ce A定位不准确,另有1只大鼠在实验过程中出现套管脱落,所以最终有10只大鼠的数据用于统计分析。每只大鼠间隔3 d先后接受DAMGO和生理盐水,因此,双瓶选择实验DAMGO组及生理盐水组最后均有10只大鼠的数据用于统计分析。Fos表达实验15只大鼠中有4只Ce A定位不准确,所以最终有11只大鼠的数据用于统计分析,其中生理盐水组5只,DAMGO组6只。

图1 显微照片显示套管位置Fig.1 Photomicrograph showing representative cannula placement
2.2 双瓶选择实验结果与生理盐水组相比,Ce A内注射DAMGO使大鼠在3 h内摄入0.3 mol/L蔗糖溶液的量显著增加(t=-3.886,P=0.004);两组对蒸馏水的摄入量差异无统计学意义(t=0.419,P=0.658,图2)。
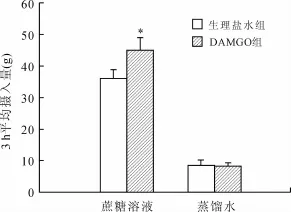
图2 CeA内注射DAMGO对0.3 mol/L蔗糖溶液及蒸馏水摄入的影响Fig.2 Effects of intra-CeA injection of DAMGO on the intake of 0.3 mol/L sucrose solution and distilled water in rats
2.3 CeA内注射生理盐水或DAMGO后蔗糖摄入引起的Fos表达情况与生理盐水组相比,Ce A内注射DAMGO后蔗糖摄入引起的Fos表达在以下核团均增加,差异有统计学意义:伏隔核(核)(t= -4.751,P=0.001),弓状核(t=-6.425,P= 0.000),外侧下丘脑(t=-6.117,P=0.000),吻端孤束核(t=-3.128,P=0.012),中间孤束核(t= -5.010,P=0.001)及尾端孤束核(t=-3.817,P=0.004)(表1、图3)。
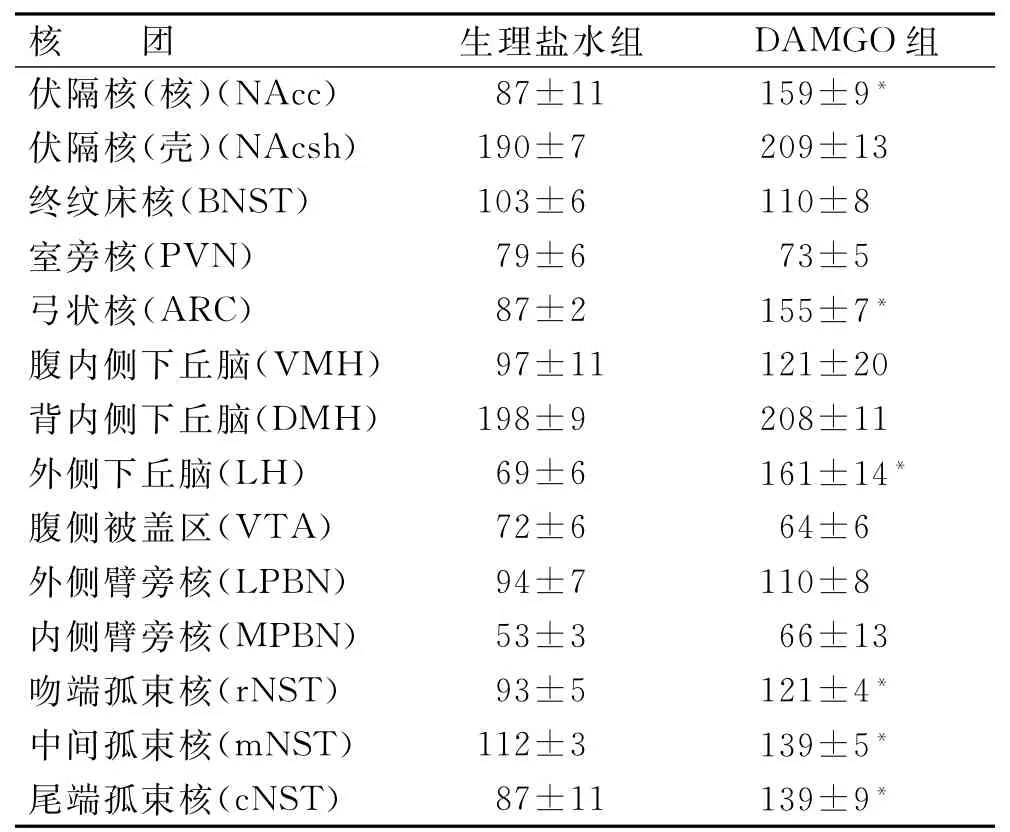
表1 CeA内注射生理盐水或DAMGO后蔗糖摄入引起的不同核团的Fos免疫阳性神经元数Tab.1 The number of sucrose intake induced Fos-immunoreactive neurons under the condition of saline or DAMGO administration in Ce A
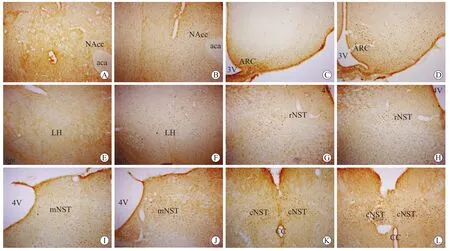
图3 CeA内注射生理盐水或DAMGO后蔗糖摄入引起的不同核团的Fos表达Fig.3 Microphotographs showing sucrose intake induced Fos-immunoreactive expression in different nuclei under the condition of saline or DAMGO administration in Ce A
3 讨 论
c-Fos是一种典型的在神经元内表达的即刻早期基因。细胞外的多种刺激均能诱导其快速、短暂及特异性表达。因此,大量研究以c-Fos作为中枢神经系统神经元激活的解剖标志[7-8]。蔗糖溶液的摄入可引起许多脑区或核团的c-Fos表达,包括伏隔核、下丘脑、杏仁核、臂旁核及孤束核等[9-10]。我们之前的研究发现,Ce A内注入MOR激动剂DAMGO可增加大鼠对蔗糖溶液的摄入,且在CeA内,蔗糖溶液摄入相关的神经元表达MOR[4]。本研究为进一步明确Ce A内DAMGO注射通过激活哪些相关核团来增加蔗糖溶液的摄入;因此将Ce A内DAMGO注射与蔗糖溶液摄入相结合,探讨Ce A内DAMGO注射对于蔗糖溶液摄入引起的Fos表达的影响,结果显示,Ce A内注入DAMGO后蔗糖摄入引起的Fos表达在伏隔核(核)、弓状核、外侧下丘脑、吻端孤束核、中间孤束核及尾端孤束核均增加,表明CeA内MOR的激活可能通过作用于这些核团参与大鼠蔗糖溶液摄入的调节。
Ce A内DAMGO注射增加伏隔核内蔗糖摄入引起的Fos表达,可能部分是由于这两个核团之间的相互神经投射引起的[6,11]。此外,这些部位之间的多突触传导通路也可能解释本研究的结果。许多研究表明,杏仁核,下丘脑,臂旁核及孤束核之间存在密切的解剖学投射关系[12-15],因此,这些结构之间存在直接或间接的纤维联系。尽管到目前为止,没有研究表明Ce A与弓状核之间存在直接的纤维联系,但与Ce A有直接纤维联系[16]的臂旁核及尾端孤束核向下丘脑有大量的纤维投射[17]。因此,臂旁核或尾端孤束核可能作为Ce A与弓状核联系的中转站。同样,目前为止尚没有文献报道Ce A与外侧下丘脑之间有直接纤维联系,但CeA和外侧下丘脑均与臂旁核之间存在纤维投射[18-19],故可通过臂旁核的中转,CeA与外侧下丘脑之间可能存在间接的纤维联系。
尾端孤束核主要接受内脏感觉神经的投射[20],与下丘脑、杏仁核及臂旁核之间存在相互的神经纤维投射。因此,尾端孤束核与CeA之间存在直接的纤维联系。中间孤束核内有瘦素受体的分布,且该受体可被外周给予的瘦素激活;外周给予瘦素可以改变大鼠对蔗糖溶液的摄入[21-22]。因此,中间孤束核可能参与蔗糖溶液摄入的调节。吻端孤束核是味觉信息传递的第一级中枢[23],与外侧下丘脑及CeA均有直接的纤维联系;此外,吻端孤束核及Ce A也可能通过臂旁核存在间接的纤维联系。
LEVINE[6]研究发现,Ce A内注入DAMGO仅可增加伏隔核壳部的c-Fos表达,而对于其他脑区或核团的c-Fos表达并没有影响。本研究先在Ce A内注入DAMGO,再观察在此状态下,蔗糖摄入在脑组织各核团引起的Fos表达情况。在所观察的核团中,很多核团的Fos表达并没有增加,但不能说明这些核团的神经元活动没有发生变化。Fos可以作为中枢神经系统神经元激活的解剖标志;但如果某个核团的神经元被抑制,Fos则无法将其反映出来。
综上所述,本实验结果表明,Ce A内MOR的激活可能通过作用于伏隔核、弓状核、外侧下丘脑及孤束核参与大鼠蔗糖溶液摄入的调节,但对于通过何种纤维投射或何种神经递质发挥作用等具体机制仍需进一步研究。
[1]赵小林,闫剑群,陈坷,等.脑干和杏仁中央核的谷氨酸能神经元参与甜味觉的传递与调制[J].南方医科大学学报,2011,31 (7):1138-1141.
[2]王倩,闫剑群,李金容,等.杏仁中央核GABA能神经元参与钠欲调节[J].南方医科大学学报,2010,30(8):1783-1786.
[3]MANSOUR A,FOX CA,BURKE S,et al.Immunohistochemical localization of the cloned mu opioid receptor in the rat CNS[J].J Chem Neuroanat,1995,8(4):283-305.
[4]孙波,闫剑群,王倩,等.杏仁中央核μ阿片受体参与蔗糖溶液摄入的调节[J].南方医科大学学报,2012,32(4):487-491.
[5]BOT G,CHAHL LA.Induction of Fos-like immunoreactivity by opioids in guinea-pig brain[J].Brain Res,1996,731(1-2):45-56.
[6]LEVINE AS,OLSZEWSKI PK,MULLETT MA,et al.Intraamygdalar injection of DAMGO:effects on c-Fos levels in brain sites associated with feeding behavior[J].Brain Res,2004,1015(1-2):9-14.
[7]HERRERA DG,ROBERTSON HA.Activation of c-fos in the brain[J].Prog Neurobiol,1996,50(2-3):83-107.
[8]HUNT SP,PINI A,EVAN G.Induction of c-fos-like protein in spinal cord neurons following sensory stimulation[J].Nature,1987,328(6131):632-634.
[9]CHEN K,YAN J,LI J,et al.c-Fos expression in rat brainstem following intake of sucrose or saccharin[J].Front Med,2011,5(3):294-301.
[10]MUNGARNDEE SS,LUNDY RF,NORGREN R.Expression of Fos during sham sucrose intake in rats with central gustatory lesions[J].Am J Physiol Regul Integr Comp Physiol,2008,295(3):R751-763.
[11]ZHANG M,KELLEY AE.Intake of saccharin,salt,and ethanol solutions is increased by infusion of a mu opioid agonist into the nucleus accumbens[J].Psychopharmacology(Berl),2002,159(4):415-423.
[12]MACDONALD AF,BILLINGTON CJ,LEVINE AS.Effects of the opioid antagonist naltrexone on feeding induced by DAMGO in the ventral tegmental area and in the nucleus accumbens shell region in the rat[J].Am J Physiol Regul Integr Comp Physiol,2003,285(5):R999-R1004.
[13]KOTZ CM,GLASS MJ,LEVINE AS,et al.Regional effect of naltrexone in the nucleus of the solitary tract in blockade of NPY-induced feeding[J].Am J Physiol Regul Integr Comp Physiol,2000,278(2):499-503.
[14]WARD HG,SIMANSKY KJ.Chronic prevention of mu-opioid receptor(MOR)G-protein coupling in the pontine parabrachial nucleus persistently decreases consumption of standard but not palatable food[J].Psychopharmacology(Berl),2006,187(4):435-446.
[15]GLASS MJ,BILLINGTON CJ,LEVINE AS.Naltrexone administered to central nucleus of amygdala or PVN:neural dissociation of diet and energy[J].Am J Physiol Regul Integr Comp Physiol,2000,279(1):R86-92.
[16]GLASS MJ,BRIGGS JE,BILLINGTON CJ,et al.Opioid receptor blockade in rat nucleus tractus solitarius alters amygdala dynorphin gene expression[J].Am J Physiol Regul Integr Comp Physiol,2002,283(1):R161-167.
[17]CARR KD,PARK TH,ZHANG Y,et al.Neuroanatomical patterns of Fos-like immunoreactivity induced by naltrexone in food-restricted and ad libitum fed rats[J].Brain Res,1998,779(1-2):26-32.
[18]LEI Q,YAN J,HUANG T,et al.Role of the lateral hypothalamus in modulating responses of parabrachial gustatory neurons in the rat[J].Brain Res Bull,2008,77(4):165-171.
[19]KANG Y,YAN JQ,HUANG T.Blocking of AMPA receptors in the central amygdaloid nucleus modulates the parabrachial nucleus taste responses in rats[J].Acta Physiologica Sinica,2004,56(6):671-677.
[20]TRAVERS SP,NORGREN R.Organization of orosensory responses in the nucleus of the solitary tract of rat[J].J Neurophysiol,1995,73(6):2144-2162.
[21]SHIGEMURA N,OHTA R,KUSAKABE Y,et al.Leptin modulates behavioral responses to sweet substances by influencing peripheral taste structures[J].Endocrinology,2004,145 (2):839-847.
[22]NINOMIYA Y,SHIGEMURA N,YASUMATSU K,et al. Leptin and sweet taste[J].Vitam Horm,2002,64:221-248.
[23]HAMILTON RB,NORGREN R.Central projections of gustatory nerves in the rat[J].J Comp Neurol,1984,222(4):560-577.
(编辑 国 荣)
Injection ofμopioid receptor agonist DAMGO into the central nucleus of amygdala increases sucrose solution intake induced Fos expression in rats
SUN Bo,YAN Jian-qun,WANG Qian,ZHAO Xiao-lin,LI Jin-rong,YAN Wei,SONG Lin
(Department of Physiology and Pathophysiology,Medical School of Xi'an Jiaotong University,Xi'an 710061,China)
ObjectiveTo determine the effects ofμopioid receptor(MOR)in the central nucleus of amygdala(Ce A)on sucrose solution intake in rats and related mechanisms.MethodsSprague-Dawley rats
intra-CeA injection of MOR agonist DAMGO or saline,and then underwent two-bottle choice test between sucrose solution and distilled water.After intra-Ce A injection of DAMGO or saline,Fos expression induced by sucrose solution intake was labeled and identified in different brain nuclei with immunohistochemistry.ResultsCompared with saline injection,intra-CeA injection of DAMGO significantly increased sucrose solution intake in rats over a 3-h period and increased Fos expression induced by sucrose solution intake in nucleus accumbens(core),arcuate nucleus,lateral hypothalamus,rostral nucleus tractus solitarius,medial nucleus tractus solitarius and caudal nucleus tractus solitarius.ConclusionActivation of MOR in Ce A may stimulate NAcc,ARC,LH and NST to modulate sucrose solution intake in rats.
central nucleus of amygdala;μopioid receptor;sucrose solution intake;Fos
R338
A
1671-8259(2014)05-0581-05
10.7652/jdyxb201405003
2013-12-10
2014-03-05
国家自然科学基金资助项目(No.31300966;31371107);中国博士后科学基金(No.2013M540761) Supported by the National Natural Science Foundation of China(No.31300966;31371107)and the National Science Foundation for Post-doctoral Scientists of China(No.2013M540761)
闫剑群,教授.E-mail:jqyan810@gmail.com
孙波(1985-),女(汉族),博士,讲师.E-mail:sunbo1217@mail.xjtu.edu.cn
时间:2014-07-22 16∶11 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1611.001.html

