同步放化疗联合尼妥珠单抗治疗食管癌
杨 燕,李建成,陈俊强,陈明强,吴海山,王晓颖,潘丁龙
(1.福建医科大学省立临床医学院,福建福州350014;2.福建省肿瘤医院,福建福州350014)
同步放化疗联合尼妥珠单抗治疗食管癌
杨 燕1,李建成2,陈俊强2,陈明强2,吴海山2,王晓颖1,潘丁龙1
(1.福建医科大学省立临床医学院,福建福州350014;2.福建省肿瘤医院,福建福州350014)
目的观察同步放化疗联合尼妥珠单抗治疗食管癌的疗效及毒副反应。方法33例食管癌患者采用同步放化疗,并于放疗第1天起应用尼妥珠单抗,同时观察疗效及毒副反应。结果2 3例既往未接受过放、化疗的患者有效率87.0%,1、2 a总生存率分别为67.0%和45.9%;10例复发和(或)转移的患者有效率90.0%,1 a生存率23.3%,中位生存期8.2个月。主要毒副反应有骨髓抑制、放射性食管炎、胃肠道反应、放射性气管炎,毒副反应程度较轻,均可耐受。结论同步放化疗联合尼妥珠单抗治疗食管癌疗效较好,且患者耐受性好,值得临床进一步研究推广。
食管肿瘤;放疗;化疗;靶向治疗
食管癌是一种世界范围内常见的危害人类健康的恶性肿瘤,其发病有明显的地域性。我国是食管癌高发区,年发病及死亡人数分别占全世界食管癌总发病与死亡人数的52.5%与41.8%。目前以手术和放疗为主,但大多数患者在就诊时已为中晚期,失去手术机会。不能手术的远处转移及局部晚期的食管癌患者中位生存期分别为9和14个月[1]。放疗作为治疗食管癌的另一重要手段,但单纯放疗仅有10%~15%的患者能够长期带瘤生存[2]。为了提高疗效,多学科综合治疗已成为当今研究的重点。近年来以表皮生长因子受体(epidermal growth factor receptor,FGFR)为靶点的重组人源化抗人类FGFR单克隆抗体尼妥珠单抗据研究能增强放、化疗敏感性,在多种实体肿瘤治疗中取得良好疗效[3]。我科对33例中晚期食管癌患者采用放疗联合尼妥珠单抗靶向治疗,取得了较好的疗效,现报道如下。
1 资料与方法
1.1 临床资料2008年10月至2013年1月我院收治的中晚期食管癌患者33例,其中男28例,女5例,年龄41~84岁,中位年龄59岁。所有病例均经胃镜、食管钡餐和胸部增强CT、腹部彩色超声(必要时腹部CT)、心电图、血常规、全身骨扫描、肝功能、肾功能等检查,病理活检确诊为鳞癌。23例既往未接受过放、化疗的患者,其中20例为不能或不愿意接受手术的初治患者,3例食管癌术后患者;10例为治疗后复发和(或)转移患者。均以AJCC 2002分期标准进行分期,未接受手术的患者临床分期主要依据颈胸和上腹部增强CT、食管钡餐片,20例初治患者中Ⅱ期4例,Ⅲ期6例,Ⅳ期10例;3例术后患者(术前未行放、化疗),2例为全腔镜食管癌3野根治术患者,1例为姑息性三切口食管胸上段鳞癌切除+胃代食管左颈部吻合术术后患者,病理分期均为Ⅳ期;10例治疗后复发患者,局部复发及淋巴结转移者4例,单纯淋巴结转移6例。治疗前KPS评分≥70分,预计生存期≥3个月。
1.2 治疗方法
1.2.1 放疗方法 患者采用CT模拟定位,扫描范围从C2~L4,层厚5 mm,层距5 mm。靶区的勾画需2位医生共同进行,肿瘤靶区(GTV)包括食管壁增厚>0.5 cm的肿瘤,食管旁、气管食管旁沟、心包角淋巴结短径>0.5 cm和>1 cm的纵隔转移淋巴结;临床靶区(CTV)包括原发灶及其前后左右0.5~0.8 cm,上下3 cm的组织;计划靶区(PTV)主要考虑摆位误差和靶区移动,一般在CTV外放0.5 cm。放疗剂量为1.8~2.0 Gy/次,1次/d,5次/周,20例初治食管癌患者总剂量60~66 Gy。3例术后患者食管瘤床及相应淋巴引流区为 CTV,CTV外扩 0.5 cm为 CTV-P,2.0 Gy/次,1次/d,5次/周,共5周。在横断面上逐层评价靶区剂量分布、危及器官受照剂量情况,并结合剂量体积直方图(dose volume histogram,DVH)评价和优化治疗计划,脊髓最大受照剂量<45 Gy。肺V20<30%。治疗计划确认后在治疗机上进行剂量验证,准确无误后执行治疗计划。10例治疗后复发和(或)淋巴结转移患者亦针对复发或转移灶行调强放疗,剂量2.0 Gy/次,1次/d,5次/周,共5~6周。
1.2.2 化疗方法 紫杉醇联合奈达铂,放疗第1天开始同步化疗,紫杉醇135~175 mg·m-2,d1;奈达铂80 mg·m-2,d2,21 d为1周期,化疗4周期。化疗过程中给予止吐、保护胃肠黏膜、保肝等对症治疗。放、化疗期间每周检查血常规1~2次,再程化疗前复查肝肾功能、心电图等。
1.2.3 靶向治疗方法 尼妥珠单抗(商品名:泰欣生)用法:200 mg加入质量分数0.9%氯化钠溶液250 mL静脉滴注,时间不少于60 min。放疗第1天开始,每周使用1次,共5~6次,每次用药剂量相同,用药期间不因放疗中断而中断尼妥珠单抗的使用,直到放疗结束。用药前予以地塞米松及异丙嗪预处理以防止过敏反应,用药中,心电监护各项指标,测定生命体征,并记录注射部位的皮肤反应及其他毒副反应。
1.3 观察指标和评价标准治疗期间,监测血常规及生化指标等常规检查,每周记录毒副反应,放疗结束后1个月行颈胸部增强CT、食管钡餐片、腹部彩超(必要时腹部CT)等检查行近期疗效评价,疗效评价按照WHO制定的实体瘤客观疗效评价标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),以CR +PR计算有效率。化疗毒副反应按WHO毒副反应判断标准[4],放疗毒副反应按放射肿瘤治疗协作组制定的急性放射损伤分度标准[5]。
1.4 随访方法随访时间从放疗开始计算,放化疗期间每周随访2次记录毒副反应;放化疗结束后第1年每2个月随访1次,第2年每3个月随访1次,其后为每6个月随访1次,随访内容包括胸部CT、食管吞钡片、腹部彩超、食管肿瘤标志物等并对肿瘤情况及后期毒副反应进行记录。随访截止于2013年4月30日,随访时间为3.5~29.7个月,随访率100.0%。
1.5 统计学处理采用SPSS 17.0分析数据,安全性数据采用统计描述方法,毒副反应发生率=至少发生1种毒副反应的例数/评价安全性人数×100%。生存分析采用Kaplan-Meier法。
2 结果
2.1 治疗完成情况
2.1.1 23例既往未接受过放化疗的患者治疗完成情况 20例初治患者均完成足量的60 Gy放疗,85.0%(17/20)患者完成了4周期足量化疗,1例患者因出现Ⅲ度骨髓抑制及转氨酶升高(酒精性肝硬化患者)只接受了2周期同步化疗,1例患者同步放化疗过程中出现肌酐升高(高血压肾功能不全患者)只接受1次化疗,另1例患者出现Ⅳ度骨髓抑制及Ⅲ度放射性食管炎只接受了2周期化疗。所有患者从放疗第1天开始配合尼妥珠单抗靶向治疗6次。3例术后患者均完成足量的50 Gy放疗及4周期足量化疗,1例患者第2周期同步化疗后出现Ⅲ度骨髓抑制及Ⅲ度放射性食管炎,第3周期化疗推迟1周。3例均从放疗第1天开始配合尼妥珠单抗靶向治疗5次。
2.1.2 10例治疗后复发和(或)淋巴结转移的患者完成治疗的情况 10例患者均完成足量的50~60 Gy放疗,5例只完成2周期同步化疗,2例完成3周期化疗,1例化疗1周期,2例单纯放疗;10例均从放疗第1天开始配合尼妥珠单抗靶向治疗5~6次。
2.2 近期疗效33例食管癌患者均可评价疗效,23例既往未接受过放、化疗的患者中CR 9例,PR 11例,SD 2例PD 1例,有效率87.0%,仅1例患者放疗结束后1个月复查发现右肺转移。10例治疗后复发和(或)淋巴结转移患者中CR 1例,PR 8例,SD 1例。
2.3 毒副反应
2.3.1 同步放化疗联合靶向治疗中出现的急性毒副反应 所有患者均可评价毒副反应。最常见的毒副反应为放射性食管炎、骨髓抑制、放射性气管炎,多为轻中度。骨髓抑制及时给予粒细胞集落刺激因子治疗,中-重度放射性食管炎给予激素及抗生素预防感染,配合黏膜保护剂、必要时营养支持等治疗,短期内能恢复,对治疗影响不大。由于采用预防性和治疗性用药,过敏反应、恶心、呕吐的发生率低,程度轻。腹泻、放射性肺炎、放射性皮炎等较少发生,观察中无出现声音嘶哑。33例患者治疗过程中骨髓抑制≥Ⅲ度占24.2%(8/33);放射性食管炎≥Ⅲ度15.2%(5/33)。10例治疗后复发和(或)淋巴结转移患者中,1例出现Ⅱ度腹泻,9例Ⅰ、Ⅱ度骨髓抑制,2例Ⅲ度骨髓抑制,1例Ⅲ度放射性食管炎,对症处理后均短期内恢复。23例既往未接受过放、化疗的食管癌患者具体毒副反应见表1。
2.3.2 与尼妥珠单抗相关的毒副反应 观察中2例出现轻微背部皮疹,可自行缓解,不影响治疗;2例出现II度腹泻,对症处理后好转;无出现血压降低、头晕、发热等副反应。
2.4 远期疗效截至2013年4月30日,23例既往未接受过放、化疗的食管癌患者,7例出现远处转移,其中肝转移3例,肺转移3例,骨及双肺转移1例;其中2例同时伴有原发灶局部复发。9例死亡,其中7例死于肿瘤复发或转移,1例在放疗结束后2个月余食管溃疡穿孔并发肺部感染死亡,1例死于其他。1、2 a总生存率67.0%和45.9%。10例治疗后复发和(或)淋巴结转移患者,目前死亡5例,1 a生存率23.3%。中位生存期8.2个月。3例稳定,1例肝转移,1例骨转移。生存曲线见图1、2。
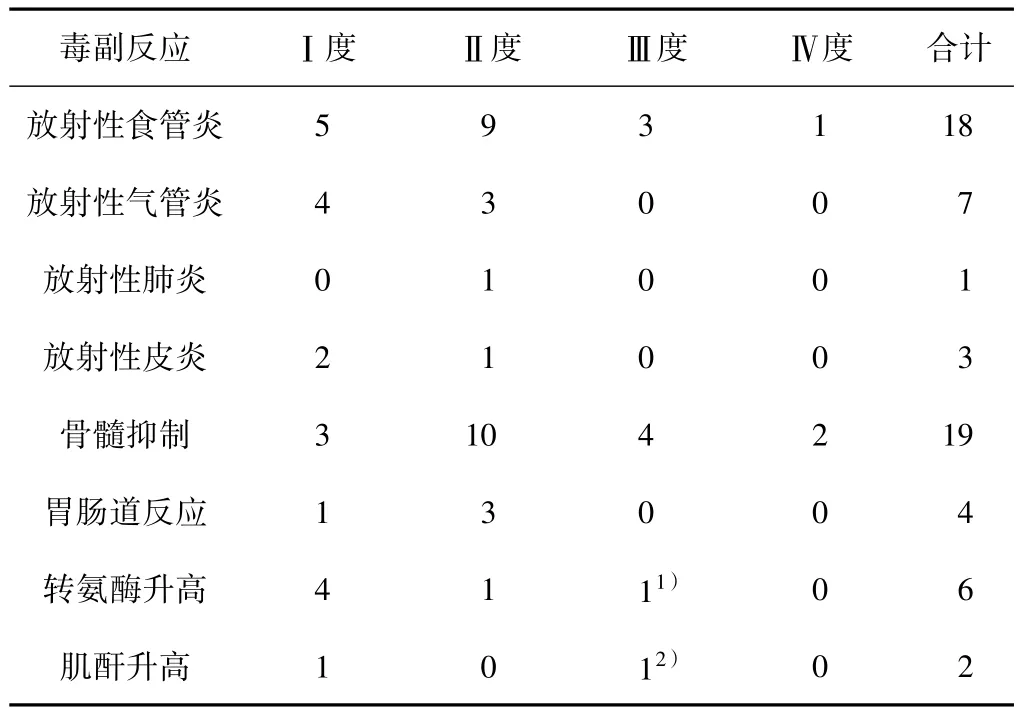
表1 23例既往未接受过放、化疗的食管癌患者同步放化疗联合靶向治疗急性毒副反应 n
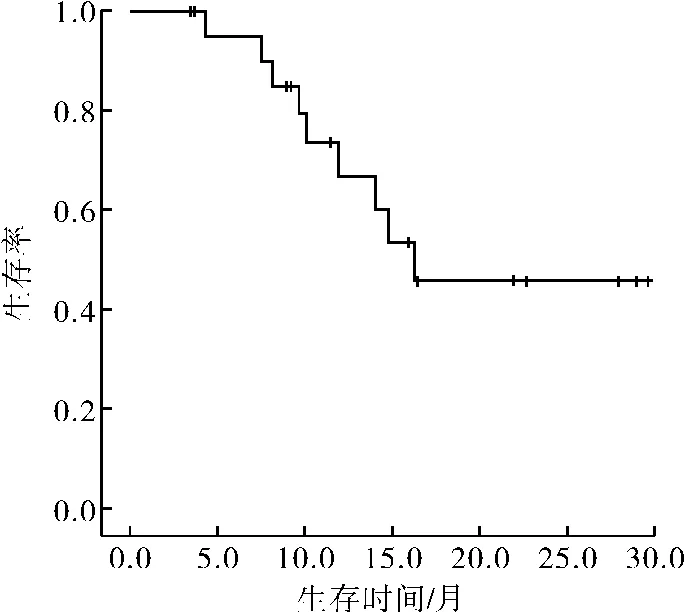
图1 23例既往未接受过放化疗的食管癌患者的总生存曲线
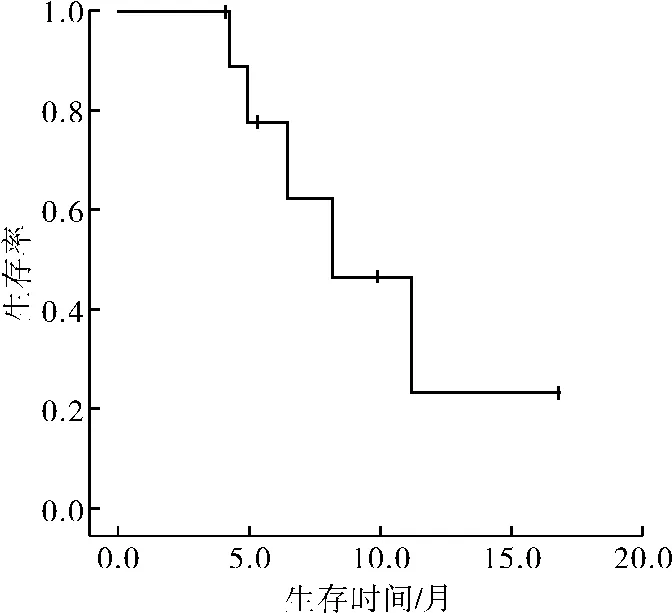
图2 10例治疗后复发和(或)淋巴结转移患者的总生存曲线
3 讨论
食管癌是常见的恶性肿瘤之一,我国食管癌的发病率及死亡率均居世界首位。大多数患者在就诊时已为中晚期,失去手术机会,同步放化疗已成为不能手术患者的标准治疗方案[6],目前针对中晚期食管癌的姑息治疗还没有最佳的标准治疗方案,多学科综合治疗是公认的比较适宜的治疗方法。近年来以FGFR为靶点的靶向治疗逐渐成为研究热点。FGFR在多种恶性肿瘤细胞表面异常高表达,并与其配体结合参与了肿瘤细胞生长增殖和凋亡等多种重要功能的调控,因而成为当前抗肿瘤的重要靶点[7]。FGFR的表达与肿瘤的放、化疗敏感性相关,高表达FGFR的细胞对放化疗更加耐受。通过阻断FGFR信号转导通路可阻滞细胞周期进展,促进细胞凋亡,抑制新生血管生成,遏制肿瘤浸润和转移,增强放、化疗敏感性[8]。研究[9]报道FGFR在食管鳞癌组织中的阳性表达率达50% ~70%,为其在食管鳞癌的治疗中提供了理论基础。
以FGFR为靶点的重组人源化抗人类FGFR单克隆抗体尼妥珠单抗能够与FGFR特异性结合,并通过占据FGFR分子的表位,竞争性抑制FGFR的天然配体FGF、TGF等与FGFR的结合,有效阻断经FGFR介导的信号传递和细胞学效应,进而抑制肿瘤细胞的增殖、诱导肿瘤细胞的凋亡、抑制肿瘤新生血管生成。尼妥珠单抗主要是通过抗体依赖细胞介导的细胞毒性(ADCC)和补体依赖的细胞毒性(CDC)等机制发挥抑制肿瘤生长和转移的作用。还能够通过降低S期肿瘤细胞的生物合成,并使肿瘤细胞在G1期停滞(放疗增敏靶点),以及诱发肿瘤细胞凋亡等机制抑制肿瘤的生长和转移[10]。
同步放化疗在治疗中晚期食管癌中取得了较好的疗效,Wong等[6]研究发现,对中晚期可切除的Ⅲ期食管癌患者采取同步放化疗可达到放化疗联合手术基本一致的中位生存期和2 a生存率,而同步放化疗组较同步放化疗联合手术组3个月病死率更低,住院时间也明显缩短。国内鲁高锋等[11]观察顺铂联合5-氟尿嘧啶方案同步放化疗治疗食管癌近期疗效达60.5%,1、2和3a生存率分别为60.5%、39.5%和26.3%,显著高于单纯放疗组。沈康等[12]比较观察同步放化疗与序贯放化疗治疗中晚期食管癌近期疗效,结果显示有效率分别为67.0%、59.7%。本组资料显示,尼妥珠单抗联合同步放化疗在治疗23例既往未接受过放、化疗的食管癌患者中,近期疗效达87.0%,近期疗效好;1、2 a总生存率67.0%和45.9%,远期疗效尚可。宋轶鹏等[10]采用尼妥珠单抗联合同步放化疗治疗局部进展期食管癌的有效率85.7%,高于同步放化疗的71.4%,与本组疗效相近。国内外鲜见尼妥珠单抗联合同步放化疗治疗中晚期食管癌疗效的报道。Shah等[13]报道贝伐单抗联合化疗治疗食管癌的Ⅱ期临床研究中有效率为65%~68%。本观察研究中,3例术后病理分期为Ⅳ期的患者经尼妥珠单抗联合放疗达到 CR,10例复发或转移的患者近期有效率达90.0%。结果显示尼妥珠单抗联合放化疗,近期疗效较好。
本组资料显示,尼妥珠单抗联合同步放化疗中患者出现骨髓抑制≥Ⅲ度24.2%,放射性食管炎≥Ⅲ度15.2%,对症处理后均短时间恢复,对比国内同步放化疗研究毒副反应无明显增加。1例酒精性肝硬化患者同步治疗过程中出现转氨酶Ⅲ度升高,1例高血压肾功能不全患者出现肌酐短期升高,其余观察中转氨酶、肌酐无出现明显升高,未出现严重的肝肾功能损害、骨髓抑制及放射性食管炎等,提示同步治疗中急性毒副反应可以耐受,尼妥珠单抗未增加同步放化疗的毒副反应发生率和严重程度。
本组尼妥珠单抗联合放化疗治疗中表现出了良好的耐受性。观察中仅2例出现轻微背部皮疹,自行缓解,不影响治疗;2例出现Ⅱ度腹泻,对症处理后好转;无出现血压降低、头晕、发热等毒副反应。
综上所述,同步放化疗联合尼妥珠单抗靶向治疗有较好的食管癌近期局部控制率及远期生存率。毒副反应较轻,患者均能耐受。尼妥珠单抗无明显的毒副反应。因随访时间短,例数较少,其远期疗效及晚期放射损伤有待长期的随访结果。
[1] Cunningham D,Okines AF,Ashley S.Capecitabine and oxaliplatin for advanced esophagogastric cancer[J].N Fngl J Med,2010,362(9):858-859.
[2] Nishimaki T,Shimoji H,Sunagawa H.Recent changes and the future roles of esophageal cancer surgery[J].Ann Thorac Cardiovasc Surg,2004,10(6):324-332.
[3] Bang YJ,Van Cutsem F,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HFR2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-697.
[4] 孙燕,周际昌.临床肿瘤内科手册[M].第3版.北京:人民卫生出版社,1996:23-26.
[5] 殷蔚伯,谷铣之.肿瘤放射治疗学[M].第3版.北京:中国协和医科大学出版社,2003:1108-1109.
[6] Wong R,Malthaner R.Combined chemotherapy and radiotherapy(without surgery)compared with radiotherapy alone in localized carcinomao f the esophagus[J].Cochrane Database Syst Rev,2006,(1):CD002092.
[7] Burgess AW.FGFR family:structure physiology signalling and therapeutic targets[J].Growth Factors,2008,26(5):263-274.
[8] Dietz A,Boehm A,Mozet C,et al.Current aspects of targeted therapy in head and neck tumors[J].Fur Arch Otorhinolaryngol,2008,265 Suppl 1:S3-S12.
[9] Moghbeli M,Abbaszadegan MR,Farshchian M,et al.Association of PYGO2 and FGFR in esophageal squamous cell carcinoma[J]. Med Oncol,2013,30(2):516.
[10]宋轶鹏,马金波,陈尔成,等.尼妥珠单抗联合同期放化疗治疗局部进展期食管癌疗效观察[J].肿瘤研究与临床,2012,24(10):704-706.
[11]鲁高锋,毛伟敏,祝鑫海,等.顺铂联合5-FU方案同步放化疗治疗食管癌的临床疗效观察[J].海峡药学,2010,22(5):128 -129.
[12]沈康,肖庆成.同步放化疗与序贯放化疗治疗中晚期食管癌的临床研究[J].肿瘤基础与临床,2011,24(6):512-514.
[13]Shah MA,Jhawer M,Ilson DH,et al.PhaseⅡstudy of modified docetaxel,cisplatin,and fluorouracil with bevacizumab in patients with metastatic gastroesophageal adenocarcinoma[J].J Clin Oncol,2011,29(7):868-674.
Concurrent Chemoradiotherapy Combined with Nimotuzumab in the Treatment of Esophageal Carcinoma
Yang Yan1,Li Jiancheng2,Chen Junqiang2,Chen Mingqiang2,Wu Haishan2,Wang Xiaoying1,Pan Dinglong1
(1.Provincial Clinical College of Fujian Medical University,Fuzhou 350014,China;2.Fujian Tumor Hospital,Fuzhou 350014,China)
ObjectiveTo investigate the efficacy and toxicities of concurrent chemoradiotherapy combined with nimotuzumab in the treatment of esophageal carcinoma.MethodsThirty-three patients with esophageal carcinoma were treated by concurrent chemoradiotherapy,nimotuzumab was used from the first day of radiotherapy,and the efficacy and toxicities were evaluated.ResultsOf all the 23 patients who had not
radiotherapy and chemotherapy,the effective rate was 87.0%,the 1-,2-year survival rates were 67.0%and 45.9%.The effective rate of 10 patients who were relapse and(or)metastasis after the treatment was 90.0%,the 1-year survival rate was 23.3%,the median survival time was 8.2 months.The main toxicities were bone marrow suppression,radiation esophagitis,gastrointestinal reaction,radiation bronchitis,all the toxicities were mild and can be tolerated.Conclusion Concurrent chemoradiotherapy combined with nimotuzumab in the treatment of esophageal carcinoma achieved high efficacy,and the toxicities can be tolerated.
esophageal carcinoma;radiotherapy;chemotherapy;target therapy
10.3969/j.issn.1673-5412.2014.05.012
R735.1;R730.58
A
1673-5412(2014)05-0400-05
2013-05-21)
杨燕(1987-),女,硕士在读,主要从事食管癌及肺癌的临床研究。F-mail:yangyanaoxue@163.com
李建成(1963-),男,博士,主任医师,主要从事食管癌及肺癌的临床及基础研究。F-mail:jianchengli6@126.com

