改良激素法建立早期股骨头坏死动物模型①
闵红巍,刘克敏,王安庆,韩新祚,顾蕊
股骨头坏死(osteonecrosis of the femoral head,ONFH)高发于30~50岁人群,治疗困难且致残率高,是临床骨科急待解决的重大课题。激素性ONFH是非创伤性ONFH的主要原因之一,确切的发病机制尚不明确,其病变晚期不可逆。目前,ONFH研究的一个重点是早期诊断,希望通过中西药物、体外震波、自体骨髓干细胞移植等方法使早期的ONFH逆转,有极大的临床价值。而研究早期诊断的主要方法是建立早期的ONFH的动物模型。本实验通过改良激素法有效地复制出接近临床的早期ONFH动物模型,适用于ONFH发病机制及早期诊断等方面的研究。
1 材料和方法
1.1 动物及分组
健康雄性比格犬20只,由首都医科大学动物中心提供,体重(6.0±0.5)kg,适应性饲养1周后编号,用随机数字表法将其分为实验组和对照组,每组各10只。饲养温度(22±3)℃,湿度(50±20)%,分笼在相同条件下喂养。
1.2 动物模型的制备
实验组肌注脂多糖(美国SIGMA公司)10 μg/kg,然后连续3 d肌注甲基泼尼松龙(美国普强药厂产品)20 mg/kg;对照组肌注等量生理盐水。
1.3 观察内容及方法
1.3.1 一般行为学观察 连续4个月对各组比格犬进行一般状态的观察,包括精神状态、毛色、姿势、体重等。
1.3.2 血液学检查 两组动物注射药物前和注射药物后24 h抽静脉全血2 ml进行凝血功能测定(ACL200全自动血凝分析仪,美国贝克曼-库儿特公司),包括血浆凝血酶原时间(PT)、活化部分凝血酶时间(APTT)、抗凝血酶-Ⅲ(AT-Ⅲ)。
1.3.3 MRI检查 全部犬在注射药物后2个月、4个月分别行股骨头轴位、冠状位扫描。扫描采用1.5 T超导型磁共振机(Philips)。速眠新(长春军事医学科学院军事兽医研究所)0.2 ml/kg肌肉注射麻醉后,将比格犬仰卧位置于髋关节线圈内,髋关节及膝关节弯曲成适当角度后固定于线圈上,采用SE序列T1WI(TR/TE=358/18 ms)、 T2WI(TR/TE=1015/1000 ms)进 行 扫 描 ,层厚4 mm,间隔4 mm,FOV 210,矩阵256×256,扫描范围130 mm。MRI均由两位放射诊断科医师阅片,观察有无软骨及软骨下骨质形态和信号改变。
1.3.4 组织形态学观察 注射药物后2个月、4个月,两组各处死5只动物。速眠新麻醉效果满意后,取髋关节后外侧切口,逐层切开组织显露髋关节,显露出股骨上端,用电锯行股骨上端截骨,取下股骨头,大体标本观察包括股骨头外形改变和关节软骨面的改变。
标本沿冠状面切开后置于10%福尔马林溶液中固定2周,10%硝酸脱钙1周,冲水过夜后,按常规方法沿股骨头冠状面切片,层厚1.0 μm,进行HE染色。由两位病理科医师于显微镜(Olympus)下观察股骨头区骨髓水肿情况、血管改变(压迹、血栓等)、髓腔造血细胞和脂肪细胞的数量变化、坏死情况,骨细胞坏死情况、空陷窝数、骨小梁数量和周围成骨情况,以及软骨面塌陷和软骨下骨板情况。
1.4 统计学分析
采用SPSS 13.0统计软件对用药前后两组动物的凝血参数进行配对t检验。显著性水平α=0.05。
2 结果
2.1 一般形态观察结果
动物形态:两组动物形态未见明显改变,无消瘦、腹胀、四肢变细等,实验期间无动物出现死亡。
股骨外形:股骨头形态正常,软骨面光滑,无塌陷,切面肉眼观察未见明确的坏死灶。
2.2 镜下结构
对照组10只动物的20个股骨头在用药后2个月、4个月时,可见软骨细胞排列整齐,软骨下血管丰富,骨小梁整齐清晰,排列规则,骨小梁中的骨细胞清晰可见,周围成骨细胞丰富,空陷窝少见,髓腔内造血细胞丰富,形态正常。见图1。
实验组用药后2个月,5只动物有4髋出现ONFH,表现为脂肪细胞肥大,髓腔造血细胞减少,骨小梁变细,间距增大,结构紊乱,部分有断裂现象,骨小梁内骨细胞核固缩,胞核小,空陷窝数增多。骨髓表现为片状坏死。见图2。
实验组用药后4个月,5只动物有6髋出现ONFH,表现为骨髓造血细胞极少,充满脂肪细胞,骨小梁中断,空陷窝增多,坏死骨小梁周围可见少量成骨细胞,坏死灶可见炎细胞和少量新生血管,部分坏死灶周围见纤维血管组织修复。见图3。
2.3 影像学表现
对照组应用药物后2个月和4个月,10只犬的20个股骨头形态正常,T1WI表现为高信号,T2WI表现为低或中等信号,MRI未见异常信号改变。见图4。实验组应用药物后2个月和4个月后,10只犬的20个股骨头形态正常,MRI未见异常信号改变。见图4。
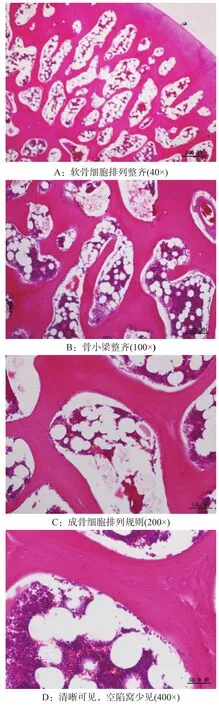
图1 对照组正常病理图(HE染色)
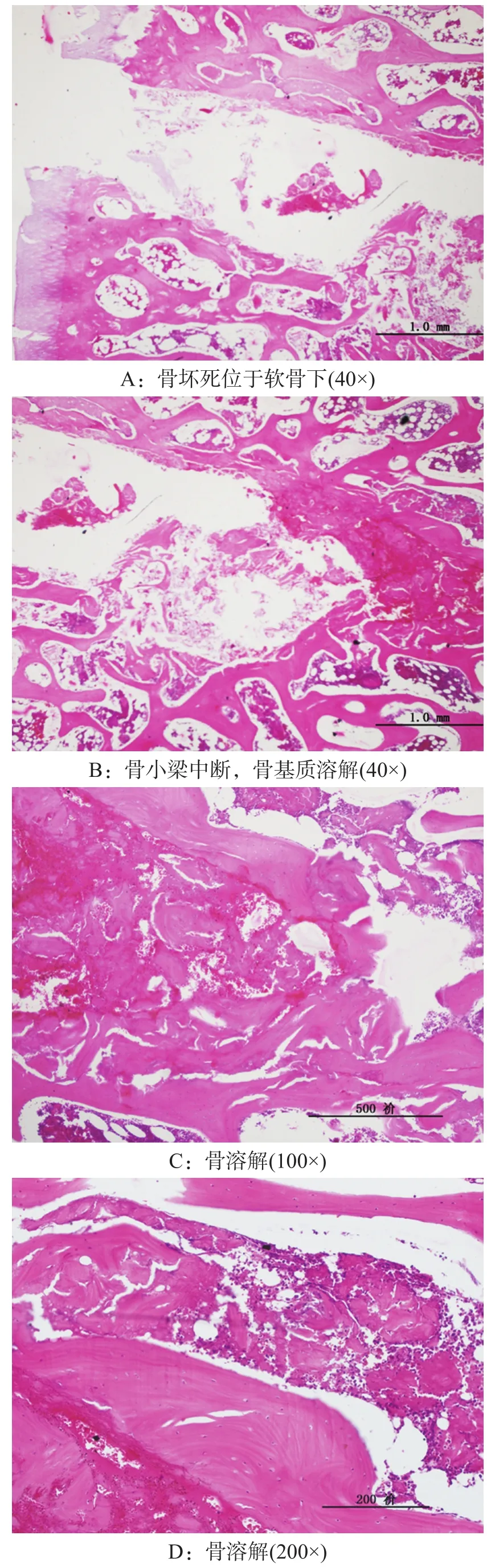
图2 实验组用药2个月后(HE染色)
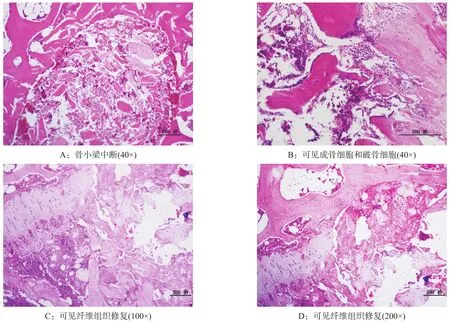
图3 实验组用药4个月后(HE染色)
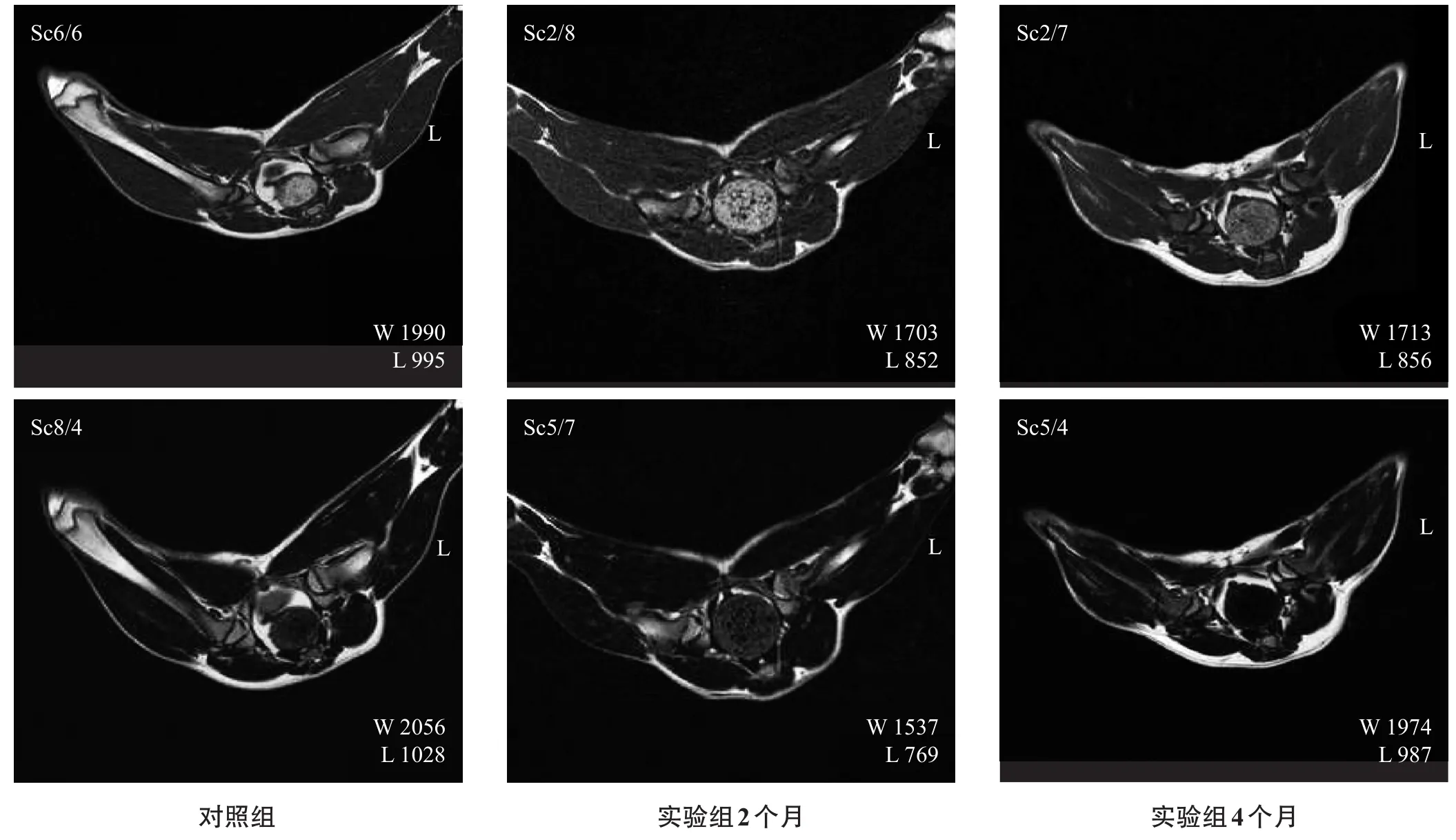
图4 两组MRI(股骨头形态均正常,未见异常信号)
2.4 血液学指标检测结果
用药前,两组间PT、APTT、AT-Ⅲ均无显著性差异(P>0.05)。注射后,实验组PT、APTT、AT-Ⅲ均显著缩短(P<0.001),且显著短于对照组(P<0.001)。见表1~表3。
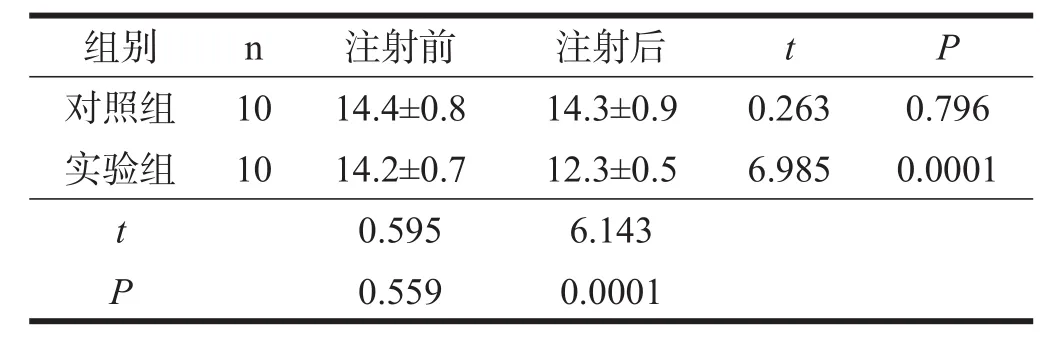
表1 两组用药前后PT比较(s)
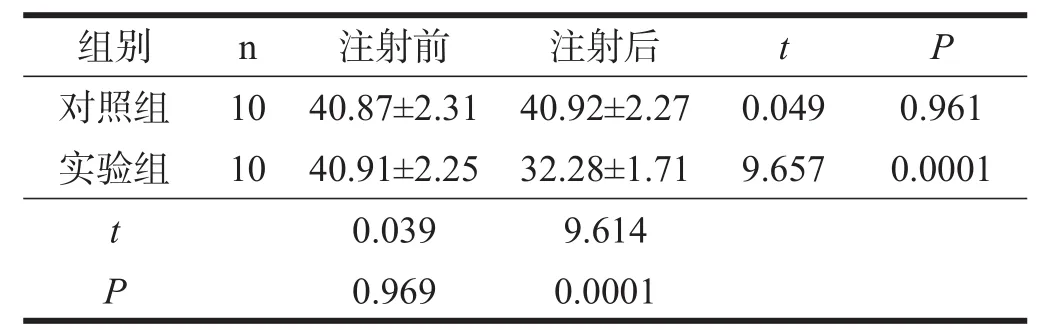
表2 两组用药前后APPT比较(s)
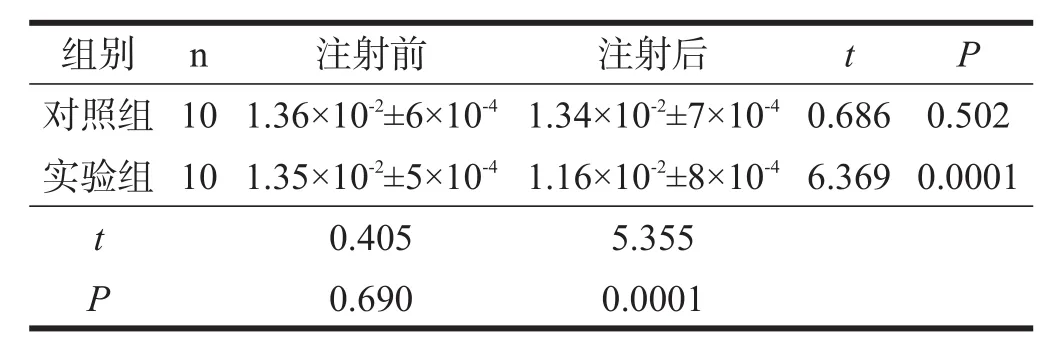
表3 两组用药前后AT-Ⅲ比较(s)
3 讨论
ONFH是一种常见的致残率较高的骨科疾病。1957年,Pietrogrand等首次报道糖皮质激素易引起ONFH,但到目前为止人们还没完全弄清楚其发病机制[1]。因此,建立理想的成人ONFH的动物模型,是研究成人ONFH病因及发病机制十分重要的手段,也是进行治疗的基础。目前ONFH的造模方法主要有:创伤法(损伤股骨颈骨膜、髋关节脱位并且切断圆韧带[2-4]);物理法(如液氮冷冻[5]、微波[6]等);化学法(股骨头内注射乙醇[7]);非创伤法(激素、内毒素或血管内皮细胞生长因子受体抗体诱导[8-12])。实验动物大多为四足动物和两足动物。前者主要包括鼠、兔、犬、猪、绵羊、山羊及马,后者包括鸡、鹅、鸸鹋。
长期使用或短期内间断大量使用糖皮质激素可引起ONFH,已为临床和实验研究证实,人和动物对皮质激素的反应是一致的[13]。但激素应用剂量、时间与骨坏死产生的关系仍不确切;同样应用激素治疗,而ONFH的发生率及病变范围却有差异。曾有人认为在健康的动物单纯应用激素可能不引起骨坏死,但从目前的文献报道来看,这种推测比较武断。也有学者认为并不是单纯激素不能导致骨坏死,而是激素应用的剂量、次数、应用方式(冲击或持续应用)以及动物个体对激素的耐受性不同。
临床上,肾病综合征、感染性休克、妊娠并发症、恶性肿瘤、系统性红斑狼疮等是应用激素较多且较易出现ONFH的疾病,而这些疾病有一个共同特点,即在使用激素前就已经存在前凝血状况。因此,利用施瓦兹曼反应(Schwartzman reaction)首先造成动物的前凝血状况,继而使用大剂量激素造成ONFH模型是符合临床要求的。由于利用施瓦兹曼反应处理的动物死亡率较高,因此在本实验中,我们采用改良施瓦兹曼反应,在大动物体内单次注射大肠杆菌内毒素联合应用甲基泼尼松龙,用药后2个月和4个月,病理结果显示有4髋和6髋发生ONFH,并且无一例动物死亡。说明改良施瓦兹曼反应可以引起ONFH,且死亡率低。
虽然目前ONFH研究已达到分子及基因水平,但其确切的发病机制仍不十分清楚。1992年,Jones正式提出非创伤性骨坏死血管内凝血学说,并在随后的研究中不断加以完善。越来越多的研究表明ONFH的发生与凝血功能异常有关[14-16]。本研究结果显示,应用内毒素和激素后,血浆PT、APTT、AT-Ⅲ明显降低,表明血液处于高凝低纤溶状态。由于血栓前状态的存在,形成骨内微血栓,从而引起一系列的病理变化。血栓形成后,一方面可损害动脉灌注,并且更为严重地损害静脉引流,导致骨内间隔综合征,使骨内静脉压升高,灌注减少,进而加重了股骨头的缺血并导致骨坏死。另一方面,被激活的凝血瀑布反应可诱发组织的炎性反应,加剧局部病变。
虽然说成人ONFH的病因及发病机制尚不完全清楚,但对其病理过程已有较清楚的认识。一般认为,无论什么原因引起成人ONFH,其病理改变都是相似的[17],即先有细胞坏死,随后通过血管再生,新骨形成和死骨(小梁)吸收进行修复。由于骨组织对缺血持续的时间、缺血的范围、缺血的程度以及骨组织对缺血反应能力和状态的不同,其病理变化的进程也有所不同;ONFH的病理改变主要是脂肪及水含量的变化,因此MRI诊断骨坏死具有很强的特异性和敏感性。尽管如此,还必须认识到。MRI信号改变仍然是骨坏死病理变化进展到相当程度的影像表现。因此,若MRI正常,也不能完全排除ONFH[18]。相信随着磁共振技术的发展,其在ONFH诊断中的应用会越来越广泛。
在本研究中,实验组用药后2个月4髋发生ONFH,其病理变化表现为脂肪细胞肥大,骨小梁变细,部分有断裂现象,骨小梁内骨细胞核固缩,胞核小,空陷窝数增多。未见明显修复反应,表明骨坏死处于早期阶段。实验组用药后4个月有6髋发生ONFH,其病理变化表现为骨小梁中断,空陷窝增多,坏死骨小梁周围可见少量成骨细胞,坏死灶可见浆细胞和少量新生血管,部分坏死灶周围见纤维血管组织修复。实验组用药后2个月和4个月MRI未见异常信号,这可能是因为坏死尚处于早期阶段,同时坏死的范围较小、修复反应比较局限。
本研究也存在着一些不足。一方面研究的样本量相对较少,进行统计分析时说服力较弱;另一方面实验组观察的时间点较少,不利于动态观察早期ONFH的病理和影像学变化。此外,四足动物造模的最大限制在于其不能正常负重。因为动物在患肢疼痛情况下常采取保护性肢体回缩,这与人髋关节负重模式有很大的不同。这也是本模型难以造成股骨头晚期塌陷的原因之一。
总之,改良激素法可建立早期ONFH模型,其具有创伤小、造模方法简单、成模时间短、动物死亡率低、其病理特点贴近人ONFH病理演变规律等优点,是一种比较理想的造模方式。
[1]Jones LC,Hungerford DS.The pathogenesis of osteonecrosis[J].Instr Course Lect,2007,56:179-196.
[2]Peled E,Bejar J,Barak M,et al.Core decompression and alendronate treatment of the osteonecrotic rat femoral head:computer-assisted analysis[J].Int J Exp Pathol,2013,94(3):212-216.
[3]Peled E,Bejar J,Zinman C,et al.Prevention of distortion of vascular deprivation-induced osteonecrosis of the rat femoral head by treatment with alendronate[J].Arch Orthop Trauma Surg,2009,129(2):275-279.
[4]Peled E,Davis M,Axelman E,et al.Heparanase role in the treatment of avascular necrosis of femur head[J].Thromb Res,2013,131(1):94-98.
[5]Vélez R,Soldado F,Hernández A,et al.A new preclinical femoral head osteonecrosis model in sheep[J].Arch Orthop Trauma Surg,2011,131(1):5-9.
[6]Li Y,Han R,Geng C,et al.A new osteonecrosis animal model of the femoral head induced by microwave heating and repaired with tissue engineered bone[J].Int Orthop,2009,33(2):573-580.
[7]Zhu ZH,Gao YS,Luo SH,et al.An animal model of femoral head osteonecrosis induced by a single injection of absolute alcohol:an experimental study[J].Med Sci Monit,2011,17(4):BR97-BR102.
[8]Noa M,Más R,Valle M,et al.Effect of D-003,a mixture of high molecular weight aliphatic acids,on glucocorticoid-and lipopolysaccharides(LPS)-induced osteonecrosis[J].Iran J Pharm Res,2012,11(4):1201-1208.
[9]Noa M,Valle M,Mendoza S,et al.Effects of D-003 on lipopolysaccharides-induced osteonecrosis in rabbits[J].Indian J Pharm Sci,2011,73(5):537-542.
[10]Wang L,Wang N,Li M,et al.To investigate the role of the nervous system of bone in steroid-induced osteonecrosis in rabbits[J].Osteoporos Int,2010,21(12):2057-2066.
[11]Han N,Yan Z,Guo CA,et al.Effects of p-glycoprotein on steroid-induced osteonecrosis of the femoral head[J].Calcif Tissue Int,2010,87(3):246-253.
[12]Gao YS,Wang HF,Ding H,et al.A novel rat model of osteonecrosis of the femoral head induced by periarticular injection of vascular endothelial growth factor receptor 2 antibody[J].J Surg Res,2013,183(1):e1-e5.
[13]Seamon J,Keller T,Saleh J,et al.The pathogenesis of nontraumatic osteonecrosis[J].Arthritis,2012,2012:601763.
[14]Guan XY,Han D.Role of hypercoagulability in steroid-induced femoral head necrosis in rabbits[J].J Orthop Sci,2010,15(3):365-370.
[15]Cenni E,Fotia C,Rustemi E,et al.Idiopathic and secondary osteonecrosis of the femoral head show different thrombophilic changes and normal or higher levels of platelet growth factors[J].Acta Orthop,2011,82(1):42-49.
[16]Chotanaphuti T,Heebthamai D,Chuwong M,et al.The prevalence of thrombophilia in idiopathic osteonecrosis of the hip[J].J MedAssoc Thai,2009,92(Suppl 6):S141-S146.
[17]Jackson SM,Major NM.Pathologic conditions mimicking osteonecrosis[J].Orthop Clin NorthAm,2004,35(3):315-320.
[18]Karantanas AH,Drakonaki EE.The role of MR imaging in avascular necrosis of the femoral head[J].Semin Musculoskelet Radiol,2011,15(3):281-300.

