2型糖尿病下肢血管病变患者介入治疗前后缺血动脉内血清超氧化物歧化酶的变化及意义
侯琳,王富军,李艳艳,齐会卿,张玉娜,白磊,孙金
·血管介入Vascular intervention·
2型糖尿病下肢血管病变患者介入治疗前后缺血动脉内血清超氧化物歧化酶的变化及意义
侯琳,王富军,李艳艳,齐会卿,张玉娜,白磊,孙金
目的观察2型糖尿病(T2DM)下肢血管病变(PAD)患者下肢动脉介入治疗前后病变动脉血清中超氧化物歧化酶(SOD)水平的变化,探讨T2DM合并PAD患者体内氧化应激水平及介入治疗对血清SOD的影响。方法选择2011年7月—2012年12月接受介入治疗的T2DM合并PAD患者40例,其中下肢单纯动脉造影者(A组)16例,行下肢动脉造影、球囊扩张及支架植入者(B组)24例(Fontaine分期Ⅱb期和Ⅲ期的患者)。B组中,单纯行下肢动脉造影、球囊扩张者16例(B1组),行下肢动脉造影、球囊扩张且行支架植入者8例(B2组)。门诊健康体检者(C组)20名作为对照组。A、B两组介入术前行常规检查并取静脉血测血脂、糖化血红蛋白(HbA1c)和SOD水平。C组在同样条件下抽取肘静脉血测定上述指标。A、B两组术中取介入前动脉血,术后24 h取静脉血测定各组血清SOD水平。结果A组患者下肢动脉造影无明显狭窄。A、B、C 3组SOD分别为(46.1±3.13)u/m l,(35.37±3.58)u/m l,(60.50±6.99)u/m l,A、B组SOD水平均明显低于C组(t=8.420,P<0.01;t=14.324,P<0.01),A组SOD水平明显高于B组(t=10.092,P<0.01)。A、B、C 3组的踝臂指数(ABI)分别为0.70±0.12、0.58±0.13和1.15±0.07。A、B组ABI均明显低于C组(t=14.749,P<0.01;t=17.392,P<0.01),B组ABI明显低于A组(t=3.027,P<0.05)。SOD与HbA1c呈负相关(r=-0.541,P<0.01)。A、B两组组内静脉血与动脉血SOD比较差异无统计学意义。B1组、B2组介入前动脉血中SOD水平分别为(35.70±3.04)u/m l,(36.07±2.14)u/m l,二者差异无统计学意义;介入前缺血部位动脉血中SOD水平分别为(32.95±3.52)u/m l,(33.59±2.64)u/ml,二者差异无统计学意义,但均较介入前动脉血中SOD水平明显降低(t=2.741,P<0.05;t=2.704,P<0.05);介入后缺血部位动脉血中SOD水平分别为(29.40±5.49)u/ml,(26.68±2.31)u/m l,二者差异无统计学意义,但均较介入前缺血部位动脉血中的SOD水平明显降低(t=2.536,P<0.05;t=5.005,P<0.01)。各部位血中SOD水平B1组B2组间比较差异均无统计学意义。结论静脉血与动脉血中的SOD水平无明显差别;血清中的SOD水平与HbA1c成线性负相关关系;介入术前缺血部位SOD降低,介入术后SOD进一步降低,可能与介入治疗对血管壁损伤导致氧化应激反应增强有关,可能是引起术后再狭窄的危险因素之一。
糖尿病;下肢血管病变;介入治疗;超氧化物歧化酶(SOD)
随着糖尿病发病率的逐年增高,糖尿病下肢血管病变也明显增多,已成为引起糖尿病足导致截肢的主要原因。近年来随着介入技术的成熟与发展,使糖尿病下肢血管病变的治疗取得划时代的进展,但介入治疗后再狭窄仍是影响其远期疗效的重要原因。超氧化物歧化酶(SOD)是人体自生的一种氧自由基清除剂,在血管内皮保护和抗氧化应激方面起着重要作用。有关动脉硬化与氧化应激的关系已有很多研究,但糖尿病下肢血管病变介入治疗前后缺血部位动脉局部氧化应激的变化与术后再狭窄的关系尚少见报道。我:于2007年开展糖尿病下肢血管病变介入治疗取得很好疗效[1]。本研究通过观察介入前后缺血部位动脉血中SOD水平的变化,旨在探讨血管介入治疗对局部氧化应激的影响,为介入术后再狭窄的防治提供理论依据。
1 材料与方法
1.1 病例选择
选择2011年7月—2012年12月在我:内分泌科住:接受介入治疗的2型糖尿病合并下肢血管病变患者40例。其中,下肢单纯动脉造影者(A组)16例,男11例,女5例,年龄60~85岁,平均(67±9)岁;下肢动脉造影、球囊扩张及支架植入者(B组)24例,男18例,女6例,年龄50~83岁,平均(70±11)岁。其中,单纯行下肢动脉造影、球囊扩张者16例(B1组),行下肢动脉造影、球囊扩张且行支架植入者8例(B2组)。选择门诊健康体检者(C组)20例作为对照组,男12例,女8例,年龄55~76岁,平均(64±6)岁。3组在年龄、性别、血压、体重指数等指标具有可比性,见表1。病例入选条件:①符合1999年WHO规定的糖尿病诊断标准;②患者均有下肢血管病变的临床表现(Fontaine分期Ⅱb和Ⅲ期),并经彩色多普勒超声(病变部位狭窄>50%以上或管腔闭塞、无血流通过)、踝臂指数(ABI<0.6)或CT血管造影(双下肢动脉呈不规则狭窄或阶段性的闭塞)证实;③所有病例均除外酮症酸中毒、高渗状态、急性感染、足部湿性坏疽合并感染需清创者、血液系统疾病及严重肝肾疾病等。所有患者于术前完善相关检查,无严重肝肾功能受损及明显心肺功能不全,并常规口服阿司匹林100mg/d,手术当日清晨口服硫酸氢氯吡格雷300mg,术后给予低分子肝素5 000 u,1次/12 h,共7 d;口服硫酸氢氯吡格雷300 mg/d 6个月;长期服用阿司匹林。

表1 A、B、C组患者一般临床资料
1.2 介入手术过程
于局麻下穿刺股动脉,根据患侧股动脉CTA结果所示或动脉搏动情况选择顺行或逆行穿刺,若患肢髂动脉病变较轻,无需处理则行顺性穿刺;若患者髂动脉病变较重,患侧股动脉搏动触及不清或下肢CTA示患肢髂动脉狭窄、闭塞或股深、股浅动脉分叉处有明显狭窄或已形成斑块时则选择逆行穿刺[1]。穿刺成功后置入4~6 F动脉鞘,并给予肝素钠全身肝素化。随后给予对比剂对患肢动脉进行分段造影,以进一步明确病变部位与程度。如果分段造影示股浅动脉及腘动脉血流通畅,随即置入5 F造影导管于腘动脉远端,对膝下动脉进行分段造影,如胫前、胫后及腓动脉显影可,患肢无明显狭窄处,给予拔出导管鞘,并用缝合器缝合动脉。如果分段造影示动脉多处狭窄,可通过专用导引导丝、导管,穿过病变部位至远端,将球囊导引至病变处,缓慢加压使球囊充盈扩张。由于腘动脉及以下动脉直径较小,一般只采用球囊扩张,对股浅动脉及以上的血管球囊扩张后出现血管弹性回缩或痉挛者,可给予支架植入。最后拔出导管鞘,采用压迫穿刺点或动脉缝合器缝合血管以止血。
1.3 标本采集和处理
A、B两组患者于术前晨6∶00平卧位肘静脉取血3 m l(介入前静脉血),测定总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C),糖化血红蛋白(HbA1c)和SOD。C组在同样条件下抽取肘静脉血测定上述指标。A、B两组于手术过程中,动脉鞘置入后取动脉血3 m l(为介入前动脉血),导丝、导管通过狭窄或闭塞部位,于病变动脉远端取血3 ml(为缺血部位介入前动脉血),球囊扩张(支架植入)后,于病变动脉远端取血3 ml(为缺血部位介入后动脉血),术后24 h取静脉血3m l(为介入后24 h静脉血)。取血后立即以3 000×g离心10 min,分离血清,-20℃保存待测。血清SOD水平通过WST-1法测定,试剂由南京建成生物研究所提供,严格按照说明书进行。
2 结果
A组16例患者下肢动脉造影无明显狭窄(临床症状可能由于腰椎管狭窄或糖尿病周围神经病变引起);B组24例患者均手术成功,B1组16例行单纯球囊扩张,B2组8例同时行支架植入术。
2.1 三组血脂检测结果比较
A、B、C血脂检测结果见表2。A、B两组TG、TC、LDL-C均较C组明显增高(均P<0.05)。A、B两组间TC、TG、LDL-C及HDL-C相比差异无统计学意义(P>0.05)。A、B组HbA1c水平均明显高于C组(均P<0.01),A组HbA1c水平低于B组(t= 2.048,P<0.05)。A、B、C 3组的SOD分别为(46.1± 3.13)u/m l,(35.37±3.58)u/ml,(60.50±6.99)u/ml,A组、B组SOD水平均明显低于C组(t=8.420,P<0.01;t=14.324,P<0.01),A组SOD水平明显高于B组(t=10.092,P<0.01)。A组、B组的ABI均明显低于C组(均P<0.01),B组的ABI明显低于A组(P<0.05)。将2型糖尿病合并下肢血管病变患者的HbA1c与SOD进行直线相关分析,二者呈负相关,相关系数为-0.541,差异有统计学意义(P<0.01)。见表3、4,图1。
表2 三组患者血脂变化(±s)

表2 三组患者血脂变化(±s)
注:与A组相比,aP<0.05;与C组相比,bP<0.05
组别TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)A组4.23±0.83 1.84±0.34 1.28±0.45 2.42±0.86 B组4.26±0.57ab1.96±0.49ab1.33±0.33 2.78±0.79abC组3.47±0.41 1.24±0.27 1.48±0.36 1.72±0.51
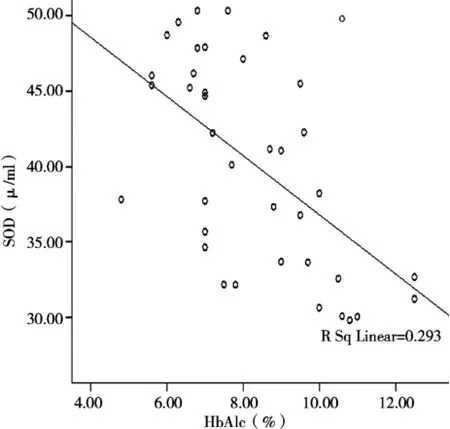
图1 Hb A1c和SOD散点图
表3 3组HbA1c、ABI、SOD水平(±s)
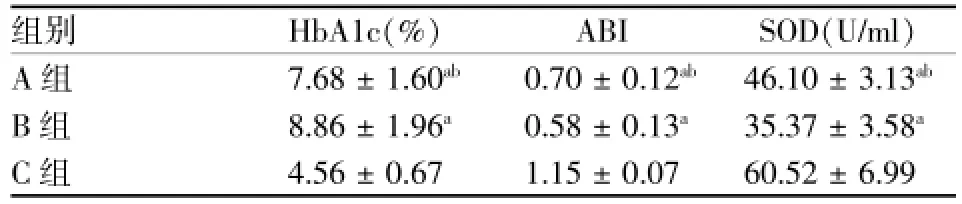
表3 3组HbA1c、ABI、SOD水平(±s)
注:与C组相比aP<0.01;与B组相比abP<0.05
组别HbA1c(%)ABI SOD(U/ml)A组7.68±1.60ab0.70±0.12ab46.10±3.13abB组8.86±1.96a0.58±0.13a35.37±3.58aC组4.56±0.67 1.15±0.07 60.52±6.99
表4 3组动脉血和静脉血中SOD水平(u/ml,±s)

表4 3组动脉血和静脉血中SOD水平(u/ml,±s)
注:与术前静脉血相比aP<0.05
组别静脉血(介入术前)动脉血(介入术中)静脉血(介入术后)A组46.10±3.13 44.00±3.51 43.95±3.80 B组35.37±3.58 34.81±3.22 33.30±2.76a
2.2 A、B两组静脉血与动脉血中SOD水平比较
A、B两组介入前静脉血中的SOD水平分别为(46.10±3.13)u/ml、(35.37±3.58)u/ml,介入前动脉血中的SOD水平分别为(44.00±3.51)u/m l、(34.81±3.22)u/ml,自身静脉血与动脉血SOD比较差异无统计学意义(P>0.05)。见表4。
2.3 B组组内动脉血中SOD水平的对比
B1组、B2组介入前动脉血中的SOD水平分别为(35.70±3.04)u/m l,(36.07±2.14)u/m l,二者差异无统计学意义(P>0.05)。介入前缺血部位动脉血中的SOD水平分别为(32.95±3.52)u/m l,(33.59±2.64)u/ml,二者差异无统计学意义(P>0.05)。但均较介入前动脉血中的SOD水平明显降低(t=2.741,P<0.05;t=2.704,P<0.05)。介入后缺血部位动脉血中的SOD水平分别为(29.40± 5.49)u/ml,(26.68±2.31)u/m l,二者差异无统计学意义(P>0.05)。但均较介入前缺血部位动脉血中的SOD水平明显降低(t=2.536,P<0.05;t= 5.005,P<0.05)。见表5。

表5 B组介入术前动脉血和术后静脉血中SOD水平
3 讨论
氧化应激是指机体在受到各种有害刺激时,体内的活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)生成过多,与抗氧化防御体系失衡,从而导致组织损伤的一种状态。ROS包括超氧阴离子(O2-)、羟自由基(OH·)、过氧化氢(H2O2)等;RNS包括一氧化氮(NO)、二氧化氮(NO2)、过氧亚硝酸基阴离子等[2]。在生理情况下,ROS存在于细胞中,用于维持细胞的正常功能。95%的氧接受4个电子经呼吸链还原为水,产生ATP为机体提供能量,只有0.1%~5%的氧可以通过电子链形成自由基[3]。在机体正常代谢过程中产生的ROS会被清除系统有效的清除掉。机体存在着两种抗氧化体系:一种是酶抗氧化系统,包括SOD、过氧化氢酶、谷胱甘肽过氧化物酶等;另一种是非酶抗氧化体系,包括维生素C、维生素E、a-硫辛酸、铜、锌、硒等微量元素[4]。当机体受到内源或外源因素的影响时,ROS的产生和清除之间失衡,机体内的氧自由基增多,从而能导致机体的氧化应激。活性氧自由基的主要产物是超氧化酶,它是一种高反应性的、有细胞毒性的自由基。SOD是人体内的一种内生性氧自由基清除剂,可将有毒性的自由基歧化为无活性的过氧化氢和氧分子,对细胞起到保护作用[5-6]。Brownlee[7]提出“糖尿病并发症的共同机制”学说,认为高血糖引发的氧化应激对血管内皮细胞的损伤是糖尿病并发症机制中关键性的第一步,无论大血管还是微血管的并发症都是同一发病机制,即氧化应激[7-8]。王清等[9]则通过实验进一步证实了糖尿病患者体内存在氧化应激,且合并下肢血管病变比无血管病变的患者体内氧化应激更严重,并且随着血糖的升高氧化应激会越来越重。本研究显示SOD与HbA1c呈显著负相关,由此可见,糖尿病患者HbA1c升高,红细胞携氧减少,组织缺氧引起体内的氧化应激反应,消耗了SOD,促使血管动脉粥样硬化的形成。糖尿病下肢血管病变患者血清SOD明显低于对照组,也再次证明了糖尿病的血管病变与氧自由基的升高有关。岑锦明等[10]通过观察糖化血红蛋白与冠脉支架术后再狭窄的关系,进一步证实了介入术后再狭窄的发生与SOD升高有关。介入治疗造成的血管损伤,使病变血管局部生成大量的活性氧自由基,而氧自由基大大的消耗了SOD,本文也证实了动脉局部的SOD值的下降与介入损伤造成的局部氧自由基生成增多有关。本文B1组和B2组SOD值无显著性差异,可能与例数较少有关,有待于进一步研究。
介入治疗下肢血管病变的疗效已得到国内外专家的认可[11],但术后的血管再狭窄仍是影响其远期疗效的主要原因。术后再狭窄的病理基础是对局部血管损伤的一种修复反应,是多种细胞因子介导的局部血管的重构,是血管平滑肌迁移、增殖、凋亡及细胞基质堆积的结果[12-13]。我们通过观察糖尿病合并下肢血管病变患者介入前后vWF的变化,探讨了介入对血管内皮功能的影响,为术后早期抗炎,防治术后再狭窄提供了理论依据[14]。介入术后,抗氧化物减少,血管壁活性氧生成增多,过多的ROS对血管产生毒性作用,使氧化还原敏感性转录因子(如NF-kB、活化蛋白-1)活化,促进粘附因子、内皮素、组织因子、血管内皮生长因子和单核细胞趋化蛋白-1等基因表达,最终导致血管细胞增殖和血管通透性的改变,血管内皮舒张功能减弱,血流动力学改变,最后引起血管狭窄或闭塞[15]。由于介入治疗对血管的机械损伤,引起氧化应激,触发再狭窄过程的发生。由此可见,氧化应激在介入术后血管在狭窄的发生中发挥了不可小觑的作用,因此,抗氧化应激是防治术后再狭窄的主要方法之一。术后再狭窄的发生与局部动脉氧化应激明显增加有关,故应在球囊扩张或支架植入后于动脉鞘内注入抗氧化剂、抗凝剂,是否有助于提高介入术后的远期疗效,有待于进一步研究。
[1]王富军,王原,杨艳辉,等.2型糖尿病下肢血管病变介入治疗临床疗效分析[J].临床荟萃,2008,23:1377-1379.
[2]Johansen JS,Harris AK,Rychly DJ,et al.Oxidative stress and the use of antioxidants in diabetes:linking basic science to clinical practice[J].Cardiovasc Diabetol,2005,4:5.
[3]Kowluru RA,Chan PS.Oxidative stress and diabetic retinopathy[J].Exp Diabetes Res,2007:43603.
[4]Birben E,Sahiner UM,Sackesen C,et al.Oxidative stress and antioxidant defense[J].World Allergy Organ J,2012,5:9-19.
[5]Vaziri ND,Dicus M,Ho ND,et al.Oxidative stress and dysregulation of superoxide dismutase and NADPH oxidase in renal insufficiency[J].Kidney Int,2003,63:179-185.
[6]Rahman T,Ismail H,Islam MT,et al.Oxidative stress and human health[J].Adv Biosci Biotechnol,2012,3:997-1019.
[7]Brownlee M.The pathobiology of diabetic comp lications-A unifyingmechanism[J].Diabetes,2005,54:1615-1625.
[8]Buchs AE,Kornberg A,Zahavi M,et al.Increased expression of tissue factor and receptor for advanced glycation end products in peripheral blood mononuclear cells of patients with type 2 diabetesmellituswith vascular complications[J].Exp Diabesity Res,2004,5:163-169.
[9]王清,任淑萍,董营.下肢血管病变与体内自由基[J].中国地方病防治杂志,2008,23:376-377.
[10]岑锦明,熊卿圆,杨希立,等.糖化血红蛋白与冠状动脉支架术后再狭窄的关系[J].介入放射学杂志,2012,21:725-727.
[11]王珏,程英升,朱悦琦,等.PTA、PTA联合马来酸桂哌齐特治疗糖尿病下肢血管病变的临床价值[J].介入放射学杂志,2007,16:811-815.
[12]顾春虎,侯英萍,乔宏庆.冠脉术后再狭窄防治的现状与展望[J].陕西医学杂志,2002,31:338-340.
[13]武国,丁小洁,时德.血管重建术后再狭窄的防治现状[J].中国普外基础与临床杂志,2008,15:418-421.
[14]王富军,赵允,丁海霞,等.2型糖尿病下肢血管病变患者介入治疗前后血管性血友病因子、纤维蛋白变化及其意义[J].临床荟萃,2011,26:64-65.
[15]李晓红,杨红英.氧化应激与糖尿病血管病变的相关性研究进展[J].检验医学与临床,2009,6:373-375.
Serum superoxide dismutase level changes in typeⅡdiabetic patients with lower extrem ity vascu lar disease before and after the interven tional therapy and its clinical significance
HOU Lin,WANG Fu- jun,LI Yan-yan,QIHui-qing,ZHANG Yu-na,BAI Lei,SUN Jin.Department of Endocrinology Fourth Hospital of HebeiMedical University,Shijiazhuang,Hebei,050000,China
WANGFu-jun,E-mail:wangfujun139@126.com
ObjectiveTo observe the changesof serum superoxide dismutase(SOD)levels in typeⅡdiabetic patients with peripheral arterial disease(PAD)before and after interventional therapy,and to investigate the effects of oxidative stress level and interventional treatment on serum SOD level.MethodsDuring the period from July 2011 to December 2012 at authors'hospital,a total of 40 patients with typeⅡ diabetes mellitus complicated by lower limb arterial disease
interventional treatment.In 16 patients only lower limb arterial angiography was performed(group A),while lower limb arterialangiography together with balloon dilation and/or stenting was carried out in 24 patients(group B,with Fontaine stage ofⅡb-Ⅲ).Of the 24 patients in group B,lower limb arterial angiography together with balloon dilation was emp loyed in 16(group B1)and lower limb arterial angiography together with balloon dilation and stenting was adopted in 8(group B2).Twenty healthy clinical subjectswere used as control group(group C).Before interventional treatment,elbow venous blood samples of patients in group A and B were collected to determine serum lipid,HbA1c and SOD levels.The same tests were also carried out in the subjects of group C.During percutaneous lower extremity arterial intervention,through arterial sheath 3 m l arterial blood specimen was collected in all patients of both group A and B before intervention started. Twenty-four hours after the treatment,venous blood specimen was also collected in all patients to determine serum SOD levels.The results were statistically analyzed.ResultsLower limb arterial angiography showed that no obvious arterial stenosis was seen in the patients of group A.The interventional procedures were all successfully completed in all patients of group B.SOD levels of group A,B and C were(46.1±3.13)U/ml,(35.37±3.58)U/m l and(60.50±6.99)U/m l respectively.SOD levels of both group A and B were significantly lower than that of group C(t=8.420,P<0.01;t=14.324,P<0.01).The level of SOD in group A was significantly higher than that in group B(t=10.092,P<0.01).The ankle-brachium indexes(ABI)of group A,B and C were(0.70±0.12),(0.58±0.13)and(1.15±0.07)respectively.ABI of group A and B was significantly lower than that of group C(t=14.324,P<0.01;t=17.392,P<0.01). ABI of group B was significantly lower than that of group A(t=3.027,P<0.05).SOD level bore a negative correlation with HbA1c level(r=-0.541,P<0.01).In both group A and group B,no significant difference in SOD level existed between the venous blood and arterial blood.The preoperative arterial SOD levels in group B1and group B2were(35.70±3.04)U/ml,and(36.07±2.14)U/m l respectively,and the difference between the two groups was not statistically significant.The preoperative SOD levels in the ischemic arterial region in group B1and group B2were(32.95±3.52)U/ml and(33.59±2.64)U/ml respectively,and the difference between the two groupswas not statistically significant although these levelswere significantly lower than the preoperative arterial SOD levels(t=2.741,P<0.05;t=2.704,P<0.05).After the interventional treatment,the SOD levels in the ischemic arterial region in group B1and group B2were(29.40±5.49)U/ ml and(26.68±2.31)U/m l respectively,and the difference between the two groups was not statistically significant although these levels were significantly lower than the preoperative SOD levels in the ischemic arterial region(t=2.536,P<0.05;t=5.005,P<0.01).No statistically significant differences in SOD levels at each corresponding site existed between group B1and group B2.ConclusionNo significant difference in SOD level exists between the venous blood and the arterial blood.Serum SOD level carries a negative linear correlation with HbA1c level.Before interventional treatment,the SOD level in ischemic region is low,which becomes lower after the interventional procedure,whichmay be caused by the enhanced oxidative stress reaction that is resulted from the damage of the vascular wall due to interventional manipulations.The enhanced oxidative stress reaction may play an important role in the occurrence of restenosis.(JIntervent Radiol,2014,23:762-766)
diabetes mellitus;vascular disease of lower extremity;interventional treatment;superoxide dismutase
R528.1
A
1008-794X(2014)-09-0762-05
2013-09-15)
(本文编辑:侯虹鲁)
10.3969/j.issn.1008-794X.2014.09.005
05000河北医科大学第四医院内分泌科
王富军E-mail:wangfujun139@126.com

