高脂饮食诱导的肥胖与肥胖抵抗大鼠肝FAS和ACAT-2的蛋白表达差异
刘 桂, 殷 亮, 王晓慧, 娄淑杰, 史仍飞
(上海体育学院运动科学学院,上海200438)
高脂饮食诱导的肥胖与肥胖抵抗大鼠肝FAS和ACAT-2的蛋白表达差异
刘 桂, 殷 亮, 王晓慧, 娄淑杰, 史仍飞
(上海体育学院运动科学学院,上海200438)
目的:研究高脂饮食饲养的肥胖与肥胖抵抗大鼠的肝脂肪酸合成酶(FAS)和酰基辅酶A:胆固醇酰基转移酶-2(ACAT-2)的蛋白表达水平的差异,以明确这2种酶是否在高脂饮食诱导肥胖的发生及肥胖抵抗中起作用。方法:健康雄性SD大鼠,体重160~180 g,15只喂普通膳食,其余135只喂自制高脂饲料8周。随机选择5只喂普通膳食的大鼠作为对照组,以体重超过普通膳食对照组平均体重的20%作为高脂饮食诱导的肥胖大鼠标准,选择8只为肥胖组(DIO);选择体重最轻的8只为肥胖抵抗组(DIO-R)。大鼠麻醉后,采血检测血浆中TG、TCH、HDL、LDL的含量。处死大鼠后取肝脏,Western blot检测肝FAS和ACAT-2的蛋白表达水平。结果:①135只高脂饮食大鼠中有48只体重超过平均值的20%,达到肥胖标准;②与对照组相比,肥胖组大鼠的体重、肾周脂肪含量显著增加,而肥胖抵抗大鼠显著下降;③与对照组相比,肥胖组大鼠的血浆TG和LDL显著增加,而肥胖抵抗大鼠的血浆TG、TCH显著降低,LDL和LDL/HDL无显著性变化;④与对照组相比,肥胖组大鼠肝FAS和ACAT-2的蛋白水平显著升高,而肥胖抵抗大鼠显著降低。结论:①高脂饮食诱导的肥胖大鼠肝FAS和ACAT-2的蛋白水平显著升高,肥胖抵抗大鼠的肝FAS和ACAT-2的蛋白水平显著降低;②肝FAS和ACAT-2蛋白水平的表达差异可能与高脂饮食大鼠的肥胖易感性有关。
脂肪酸合成酶;酰基辅酶A:胆固醇酰基转移酶-2;肥胖;肥胖抵抗;蛋白表达;差异
Author’s addressSchool of Kinesiology,Shanghai University of Sport,Shanghai200438,China
目前,肥胖症已成为全球发病率迅速增加的一种流行性疾病,全球60亿人口中13亿超重和肥胖,其中半数为肥胖。肥胖对人体健康的危害很大,可引起高脂血症、动脉粥样硬化、冠心病、脂肪肝、糖尿病等肥胖相关疾病,脂代谢的紊乱是这些疾病的始动环节[1]。脂代谢紊乱可发生在脂质代谢的多个环节,包括甘油三酯(TG)的合成、贮存、动员和分解,脂肪酸和胆固醇酯的合成等。多种酶参与了脂代谢过程,其中脂肪酸合成酶(fatty acid synthase,FAS)和酰基辅酶A:胆固醇酰基转移酶-2(acyl coenzyme A:cholesterol acyltransferase-2,ACAT-2)分别是脂肪酸合成和胆固醇酯合成的限速酶,在脂代谢及脂肪在体内的沉积中起重要作用。
FAS主要存在于肝脏、脂肪等组织中,在体内催化单酰辅酶A和丙二酰辅酶A结合成长链脂肪酸,是合成脂肪酸的关键酶,其活性将直接控制体内脂肪酸的合成,从而对机体的脂质代谢起重要作用。当FAS酶活力升高时,动物体内多余的脂肪酸通过酯化作用形成脂肪,增加了脂肪在动物体内的沉积。FAS对肥胖的产生有直接的影响。在高脂饮食诱导肥胖大鼠血清TG水平升高的同时,FAS的mRNA水平也升高[2]。肥胖动物的脂肪组织中FAS的表达增加,且FAS表达水平的升高能显著增加TG在体内的沉积而导致肥胖[3]。最直接的证据是利用转基因技术培育了脂肪细胞中不含FAS的实验鼠,发现体内缺乏FAS的转基因小鼠更能抵抗肥胖[4],而用FAS抑制剂C75处理的小鼠具有明显的减肥效果[5]。
ACAT是细胞内已知的唯一一个催化游离胆固醇与长链脂肪酸形成胆固醇酯的酶,是参与吸收、转运和贮存胆固醇的一种极其重要的酶。ACAT合成的胆固醇酯主要以脂滴的形式储存于胞浆中,故ACAT的基本作用被认为是减少过高的游离胆固醇对细胞的毒性作用[6-7]。ACAT有2种类型即ACAT-1和ACAT-2。ACAT-1在几乎各种组织细胞中都有表达,主要作用是维持细胞内胆固醇的代谢平衡;而ACAT-2只在肝脏和小肠细胞中表达,主要参与胆固醇的吸收和脂蛋白的装配,可直接影响血液中的胆固醇水平[6]。小肠上皮细胞的ACAT-2将胆固醇酯化而维持低浓度的游离胆固醇,利于肠腔中的胆固醇扩散入细胞;而肝ACAT-2参与脂蛋白的装配,是载脂蛋白apoB100分泌所必须的,且与肝细胞合成、装配和分泌极低密度脂蛋白(VLDL)密切相关[6-7]。ACAT-2有助于TG吸收和载脂蛋白的装配[8]。增加肠道ACAT活性,会导致糖尿病大鼠餐后高脂血症[9]。抑制ACAT-2基因表达可以降低胆固醇的吸收能力,从而降低血液中胆固醇的水平[10],这说明ACAT-2基因异常与血脂水平异常存在密切的联系。
多吃、吃过多高脂、高热量的食物是造成肥胖的主要原因之一。在高脂饮食诱导动物肥胖模型的实验中,部分动物发生肥胖(diet-induced obesity,DIO),而有些动物天生喂不胖,为肥胖抵抗(diet-induced obesity resistance,DIO-R)。本研究的目的就是用高脂饮食建立肥胖和肥胖抵抗大鼠模型,研究肝FAS和ACAT-2的蛋白表达水平在肥胖和肥胖抵抗大鼠中是否有差异,从而明确这2种酶是否在高脂饮食诱导的肥胖发生及肥胖抵抗中起作用。
1 实验对象与方法
1.1 实验动物与饲料 清洁级成年雄性SD大鼠150只,体重160~180 g,购于第二军医大学实验动物中心。大鼠均自由饮食、饮水。普通饲料适应性喂养一周后,随机选取15只大鼠继续喂普通饲料(购自上海仕林科技有限公司),其余135只喂自制高脂饲料。高脂饲料参考那立欣等[11]的配方加工而成。配方如下:一般鼠料74.75%、猪油10%、蔗糖5%、蛋黄粉5%、麻油3%、胆酸钠0.25%、食盐2%。普通饲料中脂肪、碳水化合物和蛋白质所占的比例分别为4.0%、64.0%、19.0%,高脂饲料分别为19.2%、52.8%、15.7%。
1.2 主要试剂与仪器 FAS和ACAT-2抗体购自美国Santa Cruz公司,β-actin抗体购自美国Sigma公司,二抗购自上海申能博彩公司;Western blot仪器购自美国Hoefer公司,凝胶成像系统购自美国Bio Rad公司。
1.3 实验方法
1.3.1 建立肥胖和肥胖抵抗大鼠模型 高脂饲料喂养135只大鼠8周后,有48只达到肥胖标准(肥胖标准[12]:体重超过安静对照组体重的平均值20%)。
1.3.2 实验分组 在普通饲料喂养的大鼠中随机选择5只作为对照组(CON)。从48只肥胖大鼠中选择体重较重的40只,分为5组用于本次和其他实验,其中一组作为肥胖组(DIO);高脂饲料喂养的未发生肥胖的大鼠中选择体重最轻的8只作为肥胖抵抗组(DIO-R)。
1.3.3 样本采集 所有大鼠麻醉后,由下腔静脉取血,离心后收集血浆,-80℃冻存。采血后迅速取出大鼠双侧肾周脂肪,4℃生理盐水洗涤,用滤纸吸干后称重,-80℃冻存。同样方法取肝。
1.3.4 指标测定方法 (1)血浆TG、总胆固醇(TCH)、HDL和LDL水平的检测:血浆TG、TCH、LDL、HDL的测试盒均购自南京建成生物公司,按说明书进行检测。
(2)肝FAS、ACAT-2的蛋白水平测定:采用Western blot方法检测。称取50 mg肝,充分剪碎后加入1 000μL裂解液。电动匀浆器匀浆后离心取上清液,用BCA法测得蛋白浓度。调整上样量,使每孔的上样量为50μg。经SDS-PAGE分离(浓缩胶浓度为5%,分离胶浓度为10%)后,用湿转法将蛋白转到PVDF膜上。5%脱脂奶粉封闭1 h后孵育一抗(1:1 000稀释),4℃过夜。TBST洗涤3次后孵育二抗(1:500稀释)1 h。TBST洗涤3次后,ECL发光,暗室内显影、定影。用Gel Doc EZ凝胶成像系统扫描定量各条带的相对灰度值。最后采用LabWorks软件读取积分光密度值。
1.4 统计学分析 数据采用平均数±标准差表示。运用SPSS 17.0软件的单因素方差分析法对3个样本的均数进行比较。显著性水平为P<0.05,非常显著性水平为P<0.01。
2 结果
2.1 高脂饮食诱导的肥胖与肥胖抵抗大鼠体重的变化 如图1所示,实验前各组动物体重无显著性差异。高脂饮食后,与CON组相比,所选择的8只DIO组大鼠体重从第2周起显著增加(P<0.05),而所选择的8只DIO-R大鼠的体重基本无变化。与DIO组比,DIOR组大鼠的体重从第3周起显著降低,且体重差异随着饲喂时间的延长而更加明显。8周高脂饮食后,DIO、DIO-R组大鼠的体重均值分别是CON组的1.34倍和89%(图2)。
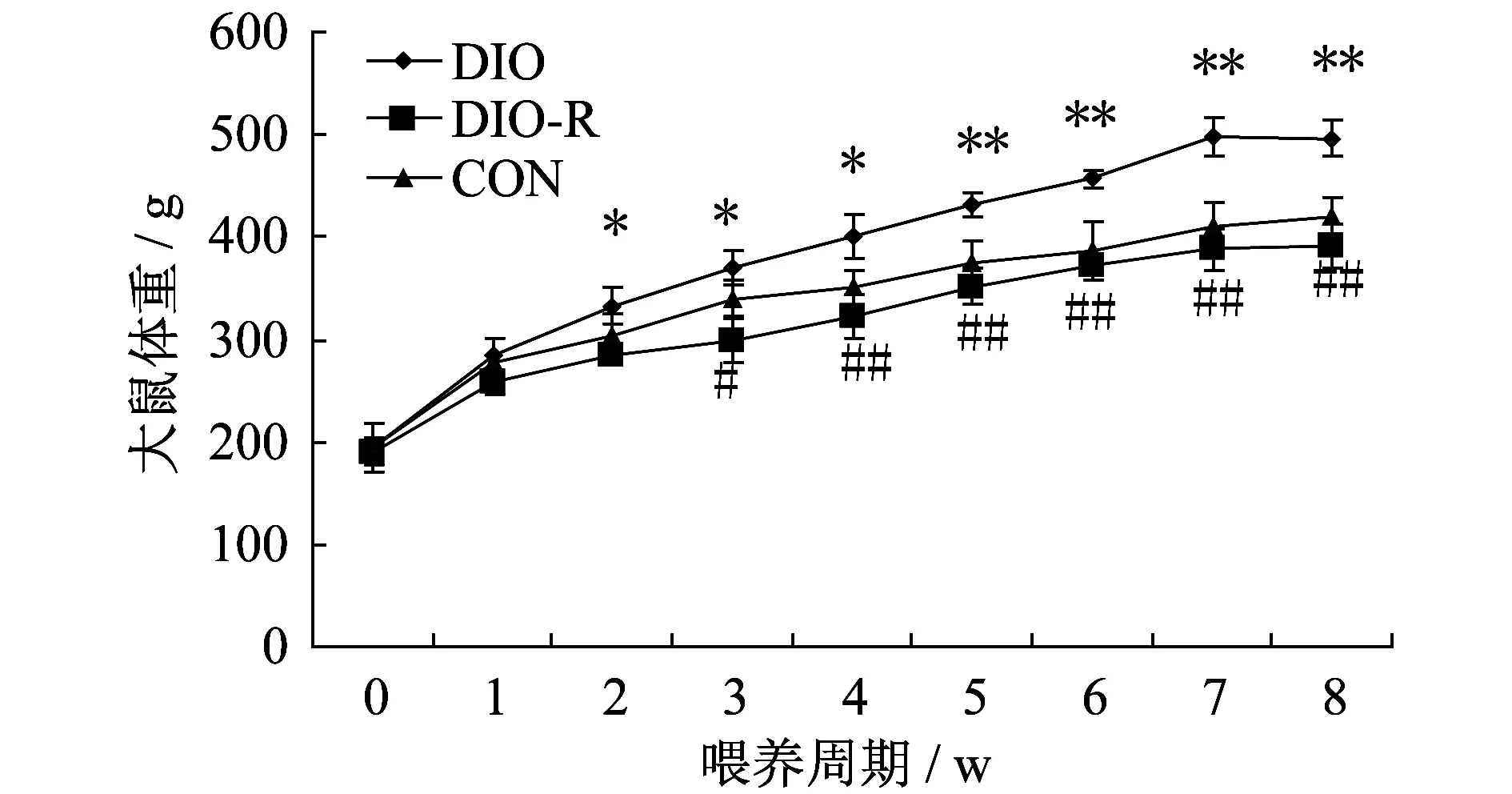
图1 8周高脂饮食后各组大鼠的体重变化Figure 1. Changes of Body Weight of Rats Fed w ith High Fat Diet for 8Weeks
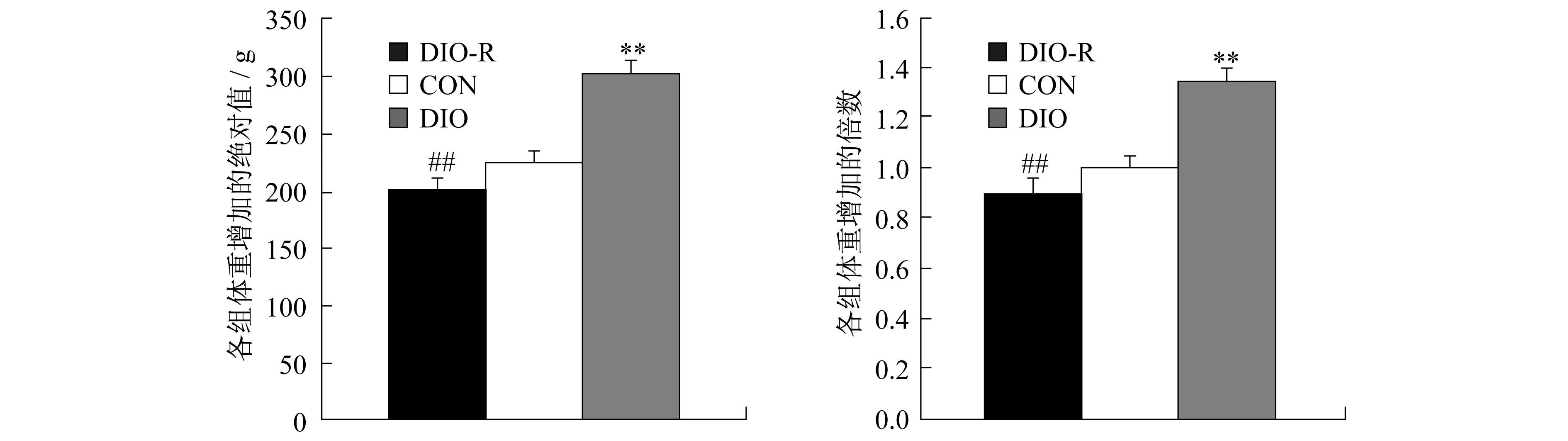
图2 8周高脂饮食后各组大鼠体重增加的绝对值和倍数Figure 2. Absolute and Relative Increases of Rats’Body Weight after 8-Week High Fat Feeding
2.2 高脂饮食诱导的肥胖和肥胖抵抗大鼠肾周脂肪含量的变化 如表1所示,与CON组相比,DIO组大鼠的脂肪含量明显高于CON组,DIO-R组的脂肪含量明显减少。
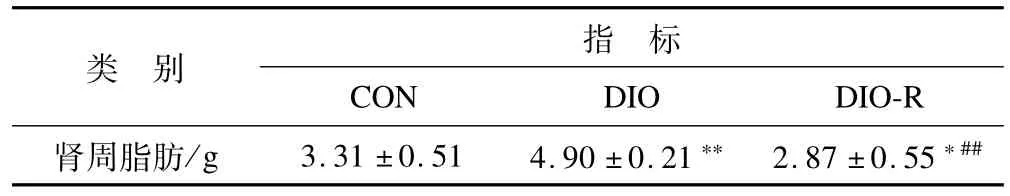
表1 8周高脂饮食后各组大鼠肾周脂肪含量的变化Table 1 Changes of Perirenal Fat Content of Rats after 8-W eek H igh Fat Feeding
2.3 高脂饮食诱导的肥胖和肥胖抵抗大鼠血脂水平的变化 由表2可见,8周高脂饮食后,与CON组比较,DIO组大鼠的血浆TG、LDL水平显著增加,DIO-R组大鼠的血浆TG、TCH显著降低;与DIO组相比,DIO-R组大鼠的血浆TG(P<0.01)、TCH、LDL水平和LDL/HDL均显著降低(P<0.05),其余指标均无显著性差异。
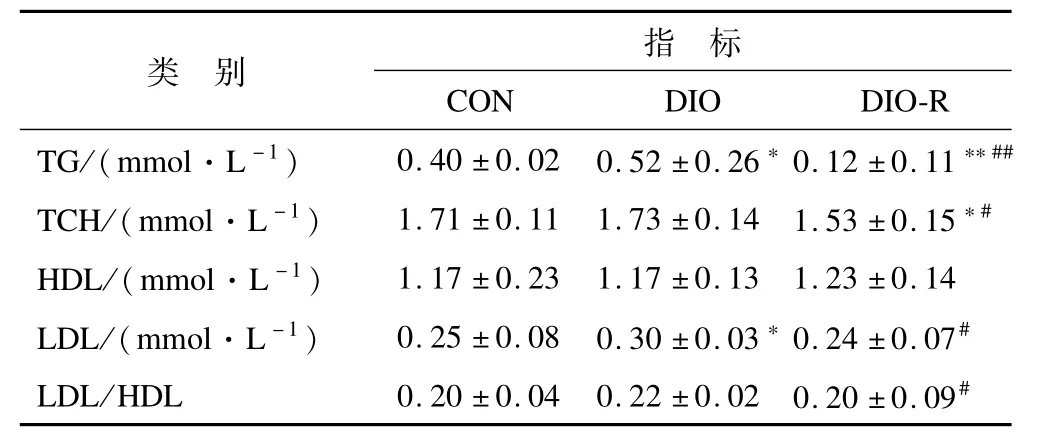
表2 8周高脂饮食后各组大鼠血脂水平的变化Table 2 Changes of Rats’Blood Lipid Indicators after 8-W eek High Fat Feeding
2.4 高脂饮食诱导的肥胖和肥胖抵抗大鼠肝FAS和ACAT-2蛋白表达的差异 图3显示,8周高脂饮食后,与CON组相比,DIO组大鼠的肝FAS、ACAT-2显著升高(P<0.01),而DIO-R组的肝FAS、ACAT-2显著降低(分别为P<0.01,P<0.05)。
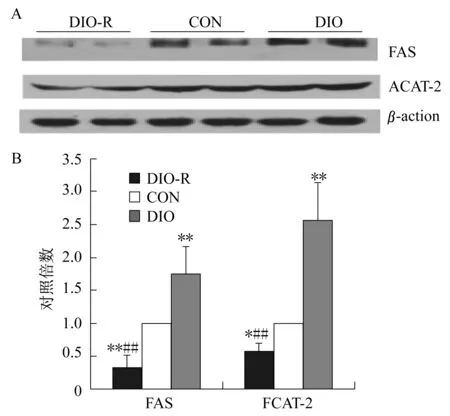
图3 高脂饮食诱导的肥胖与肥胖抵抗大鼠肝FAS和ACAT-2的蛋白表达水平Figure 3. Protein Levels of Hepatic FAS and ACAT-2 in High Fat Diet Induced Obese(DIO)and Obese Resistant(DIO-R)Rats
3 分析与讨论
3.1 高脂饮食诱导的肥胖和肥胖抵抗大鼠模型利用高脂饮食诱导的肥胖和肥胖抵抗模型是肥胖研究中经常采用的模型,它同时考虑了环境(高脂、高能量饮食)和遗传(肥胖发生的易感性)两方面因素,类似人类肥胖发生过程而被广泛使用。本次实验所选择的DIO组大鼠的体重、肾周脂肪含量显著增加,且血浆TG和LDL水平显著升高,而DIO-R组大鼠的体重无明显变化,肾周脂肪和血浆TG和TCH显著降低,表明在相同的高脂饮食条件下,由于不同个体的肥胖易感性(遗传)不同,导致体脂、血脂水平产生显著差异。
3.2 FAS在高脂饮食诱导肥胖和肥胖抵抗中的作用FAS在人的肝脏和脂肪组织中有较高的表达,特别是肝脏,其脂肪酸合成能力较脂肪组织高8~9倍。近年发现,FAS与肥胖密切相关。FAS在肥胖患者的肝脏及脂肪细胞都有较高的表达[2-3]。未研究表明,高脂饮食诱导的肥胖大鼠肝FAS蛋白水平显著升高,而肥胖抵抗大鼠的肝FAS显著降低,提示肝FAS蛋白水平的表达差异可能与高脂饮食大鼠的肥胖易感性有关。该结果与曾凡勇等[13]的研究结果类似,他们在白色脂肪组织中发现肥胖大鼠的FAS升高,而肥胖抵抗的FAS显著降低。FAS的表达水平受摄食成分和激素水平的影响,高脂饮食、胰岛素等激素均可促进FAS的表达,生长激素抑制FAS的表达[14]。为何在同样的高脂饮食下,FAS的表达在DIO和DIO-R大鼠中的区别非常大?推测可能与其血中胰岛素的水平有关。韩春春等[15]的研究证实,胰岛素提高了鹅肝细胞FAS的mRNA水平和蛋白活性,且当高糖和胰岛素共同培养时FAS增加更显著。本次实验的DIO大鼠血胰岛素水平显著增加,推测这可能是其FAS表达增加的原因之一。
对FAS发挥作用的机制进行深入研究发现,FAS的转基因小鼠更能抵制肥胖的原因是因为该小鼠能代谢更多脂肪[2];而FAS抑制剂C75对小鼠的减肥作用是通过减少其进食量和增加能量消耗实现的[16]。因此,抑制FAS的表达成为治疗肥胖的一个热点,研究最多的FAS特异性的抑制剂是小分子C75。C75通过抑制FAS一方面减少脂肪酸的合成,另一方面脂肪酸合成受阻使其底物丙二酰辅酶A浓度升高,可直接作用于下丘脑的进食中枢,通过抑制促进摄食的神经肽Y的分泌而抑制进食,且该作用在肥胖小鼠中的效应比在瘦小鼠中更强[17]。此外,在外周组织如肝脏、脂肪组织中,C75还可提高肉毒碱软脂酰转移酶-1的活性,从而增强脂肪酸的氧化和能量的消耗,实现减肥目的[17-18]。
3.3 ACAT-2在高脂饮食诱导肥胖和肥胖抵抗中的作用 肝细胞的ACAT-2负责生产胆固醇酯,合成、装配及分泌VLDL。Brown等[19]利用反义寡核苷酸技术剔除小鼠肝ACAT-2基因,发现抑制肝脏ACAT-2活性可减少肝中胆固醇酯的生成和apoB及脂蛋白(VLDL、中密度脂蛋白、LDL)的分泌。W ilcox等发现,类黄酮和橙皮素也是通过抑制ACAT-2的表达和活性抑制apoB的分泌[20]。胆固醇的累积是造成动脉粥样硬化最主要的原因,因此想远离动脉粥样硬化疾病,必须将多余的胆固醇清除。研究发现,抑制ACAT-2的基因表达可以降低胆固醇的吸收能力,从而降低血液中胆固醇的水平[10]。ACAT-2缺乏会限制用胆固醇喂养小鼠的胆固醇吸收[21]。目前认为ACAT-2是预防高脂血症、动脉粥样硬化的一个有效靶点[22-23],对其抑制剂的研究也成为一个热点[24]。本文的研究证实高脂饮食诱导的肥胖大鼠肝的ACAT-2蛋白水平显著升高,而肥胖抵抗大鼠的肝ACAT-2显著降低,且血浆胆固醇水平显著降低,提示肝ACAT-2蛋白水平的表达差异可能与高脂饮食大鼠的肥胖易感性有关,且可能与其清除胆固醇的能力不同有关。
4 结论
高脂饮食诱导的肥胖大鼠肝FAS和ACAT-2的蛋白水平显著升高,肥胖抵抗大鼠的肝FAS和ACAT-2的蛋白水平显著降低。
肝FAS和ACAT-2蛋白水平的表达差异可能与高脂饮食大鼠的肥胖易感性有关。
[1] De A lmeida A R,Monte-Alegre S,Zanini M B,et al. Association between Prehypertension,Metabolic and Inflammatory Markers,Decreased Adiponectin and Enhanced Insulinemia in Obese Subjects[J].Nutr Metab,2014(11):25-35
[2] 刘莉,马爽,李岩溪.高脂饮食大鼠脂肪组织SOCS-3及FAS表达[J].中国公共卫生,2009,25(4):428-429
[3] 占敏霞,巫冠中.脂肪酸合成酶与疾病[J].亚太传统医药,2012,8(9):210-211
[4] Lodhi IJ,Yin L,Jensen-Urstad A P,et al.Inhibiting Adipose Tissue Lipogenesis Reprograms Thermogenesis and PPARγActivation to Decrease Diet-Induced Obesity[J].Cell Metabolism,2012,16(2):189-201
[5] Matsuo S,Yang W L,Aziz M,et al.Fatty Acid Synthase Inhibitor C75 Ameliorates Experimental Colitis[J].Mol Med,2014,20:1-9
[6] 姚晓敏,宋保亮,王灿华,等.人酰基辅酶A:胆固醇酰基转移酶(ACAT)[J].上海交通大学学报,2006,24(1):108-105
[7] 马慧元,马丽雅,张权,等.人酰基辅酶A:胆固醇酰基转移酶2研究进展[J].医学综述,2009,15(6):804-807
[8] Katsuren K,Tamura T,Arashiro R.Structure of the Human Acyl-CoA:Cholesterol Acyltransferase-2(ACAT-2)Gene and Its Relation to Dyslipidem ia[J].Biochim Biophys Acta,2001,1531(3):230-240
[9] Hori M,Satoh M,Furukawa K.Acyl-Coenzyme A:Cholesterol Acyltransferase-2(ACAT-2)is Responsible for Elevated Intestinal ACAT Activity in Diabetic Rats[J]. Arterioscler Thromb Vasc Biol,2004,24(9):1689-1695
[10] 彭雪,杨林,李娅楠.大米蛋白对幼鼠血脂及脂质代谢调控因子基因表达水平的影响[J].粮食科技与经济,2012,37(4):42-44
[11] 那立欣,赵丹,宁华,等.减肥功能实验动物模型的改良[J].卫生研究,2010,39(2):162-164
[12] Chandler P,Viana J,Oswald K,et al.Feeding Response to Melanocortin Agonist Predicts Preference for and Obesity from a High-Fat Diet[J].Physiol Behav,2005,85(2):221-230
[13] 曾凡勇,秦锐,郭锡熔.脂肪酸合成酶在高脂饮食诱导的肥胖易感和肥胖抗性大鼠白色脂肪组织中的表达差异[J].临床儿科杂志,2007,25(1):54-57
[14] 岳颖,刘国华,郑爱娟,等.生长动物脂肪代谢关键酶基因表达调控[J].动物营养学报,2012,24(2):232-238
[15] 韩春春,王继文,符自英,等.葡萄糖和胰岛素对鹅肝细胞脂肪酸合成酶活性及转录表达的影响[J].农业生物技术学报,2009,17(4):634-637
[16] 赵励彦,王莉莉,李松.脂肪酸合成酶抑制剂减肥作用机制的研究进展[J].中国药理学通报,2006,22(7):780-784
[17] Tu Y,Thupari JN,Kim E K,et al.C75 A lters Central and Peripheral Gene Expression to Reduce Food Intake and Increase Energy Expenditure[J].Endocrinology,2005,146(1):486-493
[18] Thupari JN,Kim E K,Moran T H,et al.Chronic C75 Treatment of Diet-Induced Obese M ice Increases Fat Oxidation and Reduces Food Intake to Reduce Adipose Mass[J].Am JPhysiol Endocrinol Metab,2004,287(1):E97-E104
[19] Brown JM,Bell T A,Alger H M,et al.Targeted Depletion of Hepatic ACAT2-Driven Cholesterol Esterification Reveals a Non-Biliary Route for Fecal Neutral Sterol Loss[J].J Biol Chem,2008,283(16):10522-10534
[20] W ilcox L J,Borradaile N M,De Dreu L E,et al.Secretion of Hepatocyte ApoB is Inhibited by the Flavonoids,Naringenin and Hesperetin,Via Reduced Activity and Expression of ACAT2 and MTP[J].JLipid Res,2001,42(5):725-734
[21] Repa J J,Buhman K K,Farese R V Jr.ACAT2 Deficiency Limits Cholesterol Absorption in the Cholesterol-Fed Mouse:Impact on Hepatic Cholesterol Homeostasis[J]. Hepatology,2004,40(5):1088-1097
[22] Kim JH,Lee H J,Jeong S J,et al.Essential Oil of Pinus Koraiensis Leaves Exerts Antihyperlipidem ic Effects Via Up-Regulation of Low-Density Lipoprotein Receptor and Inhibition of Acyl-Coenzyme A:Cholesterol Acyltransferase,2012,26(9):1314-1319
[23] A lger H M,Brown JM,Sawyer J K,et al.Inhibition of Acyl-Coenzyme A:Cholesterol Acyltransferase 2(ACAT2)Prevents Dietary Cholesterol-Associated Steatosis by Enhancing Hepatic Triglyceride Mobilization[J].JBiol Chem,2010,285(19):14267-14274
[24] 陆颖菲,高向东,顾觉奋.微生物来源的ACAT抑制剂的研究进展[J].中国新药杂志,2011,20(15):1418-1422
Differential Expression of FAS and ACAT-2 in Livers of High Fat Diet Induced Obesity and ObesityResistant Rat
∥LIU Gui,YIN Liang,WANG Xiaohui,LOU Shujie,SHIRengfei
Objective:It is to investigate the protein levels of fattyacid synthase(FAS)and acyl coenzyme A cholesterol acyltransferase-2(ACAT-2)in livers of high fat diet induced obesity(DIO)and obesity resistant(DIO-R)rats.Methods:15 rats(4 weeks age,160 g-180 g body weight)were fed w ith normal diet while 135 rats matched w ith age and body weight were fed w ith high fat diet for 8 weeks.The rats whose body weight increased more than 20%of themean value of control rats served as DIO rats.EightDIO rats and another eight ratsw ith the lightest body weight from the high fat diet fed rats aswell as five rats fed w ith normal diet were selected to detect the levels of plasma TG,TCH,HDL and LDL as well as protein levels of FATS and ACAT-2 in livers by Western Blot.Results:1. Compared w ith control rats,the body weight and perirenal fat of DIO ratswere significantly increased while decreased significantly in DIOR rats.2.Compared w ith control rats,the plasma level of TG and LDL in DIO rats were significantly enhanced,while significantly reduced plasma TG and TCH were found in DIOR rats.3.Compared w ith control rats,remarkable raise of the protein levels of FAS and ACT-2 in DIO rats livers were shown while an attenuated increase was shown in DIO-R rats. Conclusion:The protein levels of FAS and ACT-2 in the livers of DIO rats increased significantly while decreased obviously in the livers of DIO-R rats,which may be associated w ith the susceptibility of obesity in rats fed w ith high fat diet.
fatty acid synthase(FAS);acyl coenzyme A:cholesterol acyltransferase-2(ACAT-2);obesity;anti-obesity;protein expression;difference
G804.2
A
1000 -5498(2014)06 -0105 -05
2014 -06 -11;
2014 -09 -06
上海市科委地方院校能力建设资助项目(11290503000)
刘桂(1987 -),女,湖北黄冈人,上海体育学院硕士研究生;Tel.:(021)51253520,E- mail:1187336533 @qq.com
王晓慧(1972 -),女,江苏淮安人,上海体育学院运动科学学院教授,博士;Tel.:(021)51253520,E-mail:wangpan96@126.com

