黄芪注射液促进免疫功能低下小鼠T细胞增殖研究※
杨巧红赵自明李琳琳杜标炎谭宇蕙周 联
连至诚1郭玉荣4苏俊芳1张书征1张根水5刘艳玲6
黄芪注射液促进免疫功能低下小鼠T细胞增殖研究※
杨巧红1赵自明2李琳琳3杜标炎1谭宇蕙1周 联1
连至诚1郭玉荣4苏俊芳1张书征1张根水5刘艳玲6
目的观察黄芪注射液对地塞米松(Dex)所致免疫功能低下小鼠T细胞增殖的影响。方法连续腹腔注射给药5天,末次给药后2h称小鼠体重。结果与对照组相比,模型组小鼠胸腺指数、血清与胸腺IL-2的含量均有显著减少(P<0.05),而胸腺PCNA表达面积累积百分比无显著差异(P>0.05)。结论黄芪注射液可抑制Dex所致免疫功能低下模型小鼠的胸腺萎缩,促进免疫功能的恢复。
免疫功能低下;黄芪注射液;地塞米松
黄芪是益气养血的扶正药物。黄芪注射液含有活性较强的黄芪皂苷、黄酮类、多糖类、氨基酸和微量元素,能抗菌、抗病毒、提高机体免疫功能[1-2]。研究表明,黄芪注射液可拮抗结肠癌5-氟尿嘧啶化疗后小鼠CD3、CD4百分率和CD4/CD8比例的降低,促进Th细胞增殖与分泌细胞因子,从而促进T淋巴细胞的增殖与转化、调节T细胞亚群分布,增强细胞免疫功能。本文拟通过复制地塞米松所致免疫功能低下小鼠模型观察黄芪注射液对T细胞增殖促进效应及其与PCNA表达相关性。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级KM小鼠72只,雌雄各半,5周龄,体重20g,由广州中医药大学实验动物中心提供。
1.1.2 药品与试剂 地塞米松磷酸钠注射液(广州白云山天心制药股份有限公司,1ml/支,5mg/ml,批号H44022091,产品批号:071002);黄芪注射液(成都地奥九泓制药厂,10ml×16支/盒,批号Z51021776)。
1.1.3 主要仪器 CO2细胞培养箱(Sanyo公司),96孔细胞培养板(Hyclone公司);MK3型酶联检测仪(荷兰THERMO);IX2-ILL100倒置荧光显微镜(日本奧林巴斯产品);高速冷冻离心机(美国Sigma公司);微孔虑菌器(美国Millopore公司);电子天平、电泳仪、多媒体图像分析仪(Image-pro PLUS5.1,Media Cybernetics公司);5ml玻璃匀浆器等。
1.2 方法
1.2.1 动物分组与给药 72只KM小鼠随机分为对照组、模型组、IL-2组(5IU•kg-1)、黄芪注射液高剂量(HQH,2g•kg-1),黄芪注射液中剂量(HQM,1g•kg-1),黄芪注射液低剂量(HQL,0.5g•kg-1)共 6组,每组12只。除正常对照组外,其余各组小鼠每日腹腔注射Dex(25mg•kg-1),共2天。给药方式:对照组、模型组动物腹腔注射生理盐水各0.2ml•d-1;黄芪注射液高、中、低剂量组分别腹腔注射黄芪注射液2g•kg-1、1g•kg-1、0.5g•kg-1;IL-2组以5IU•kg-1腹腔注射IL-2,共5天。
1.2.2 各组小鼠胸腺指数比较 末次给药后2h称体重,对小鼠行使安乐死,取胸腺称重,计算胸腺指数。
1.2.3 各组小鼠胸腺组织形态学比较 实验结束后对小鼠行使安乐死,取胸腺入10%甲醛溶液内固定过夜,包埋、石蜡切片、苏木素-伊红染色处理,做组织形态学观察。
1.2.4 ELISA比较各组小鼠胸腺匀浆及血清IL-2含量 实验5天后对已行安乐死的小鼠摘取眼球取血液,制备小鼠含药血清,并分离胸腺,制备胸腺匀浆上清液,ELISA法检测IL-2含量参照武汉博士德生物有限公司提供的Mouse IL-2 ELISA kit说明书进行检测。
1.2.5 小鼠胸腺PCNA表达比较
1.2.5.1 Western免疫印迹法比较各组小鼠胸腺PCNA表达 取一半胸腺组织,加0℃ 0.5ml蛋白裂解液匀浆2min,4℃ 12000rpm离心10min,吸取上清液,采用Western免疫印迹观察胸腺PCNA表达。
1.2.5.2 免疫组织化学染色方法检测PCNA表达 参照Caspase-3免疫组织化学实验。用Image-pro plus多媒体图像分析仪,以5个视野平均值作为该样本的测量值。1.3 统计学方法上述统计均由SPSS 15.0完成。所有计量资料以均值加减标准差(±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠胸腺形态学的改变黄芪注射液用药5天后,各组小鼠胸腺病理形态学变化如下图:①对照组:胸腺皮髓质界限较为清晰,皮质较厚,胸腺细胞密集,皮髓质比例约为1.5~2.0;②模型组:皮质变薄,皮质髓质细胞明显减少,皮髓质界限不清晰,网状上皮细胞清晰可见;③IL-2组:皮髓质变薄程度和皮质胸腺细胸减少程度较模型组轻,网状上皮细胞清晰可见;④HQH:皮髓质较模型组明显增厚,皮质胸腺细胞比模型组明显增多,皮髓质界限明显清晰;⑤HQM:皮髓质变薄程度和皮质胸腺细胸减少程度较模型组轻;网状上皮细胞清晰可见;⑥HQL:皮髓质较模型组明显增厚,皮质胸腺细胞比模型组明显增多,皮髓质界限明显清晰,网状上皮细胞显得稀疏。
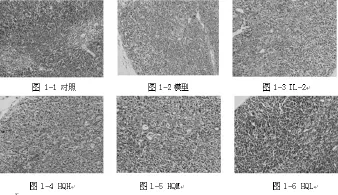
图1
2.2 黄芪注射液对小鼠胸腺指数的影响见表1。
表1 黄芪注射液治疗5天后各组小鼠胸腺指数的变化(±s)
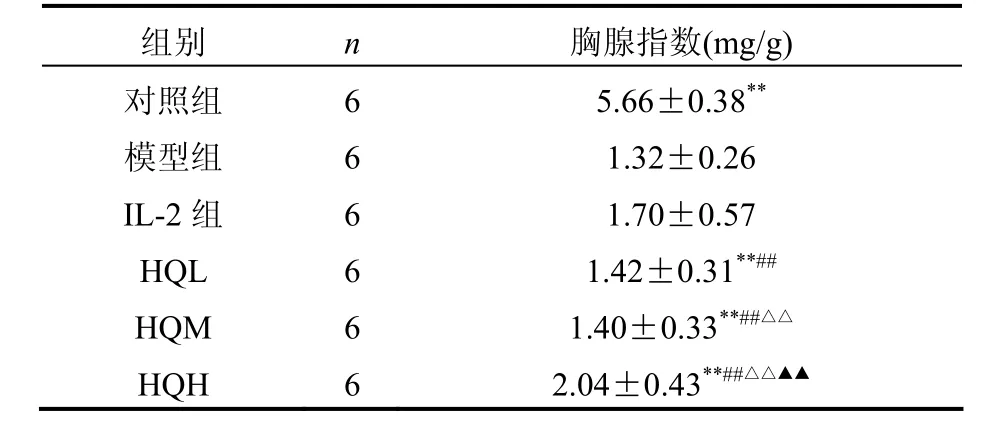
表1 黄芪注射液治疗5天后各组小鼠胸腺指数的变化(±s)
注:与模型组相比,**P<0.01;与IL-2相比,##P<0.01;与HQL比较,△△P<0.01;与HQM比较,▲▲P<0.01
组别 n 胸腺指数(mg/g)对照组65.66±0.38**模型组6 1.32±0.26 IL-2组6 1.70±0.57 HQL 6 1.42±0.31**##HQM 6 1.40±0.33**##△△HQH 6 2.04±0.43**##△△▲▲
2.3 黄芪注射液对各组小鼠血清、胸腺中 IL-2的含量比较见表2。
表2 黄芪注射液治疗5天后各组小鼠血清、胸腺中IL-2含量比较(±s)

表2 黄芪注射液治疗5天后各组小鼠血清、胸腺中IL-2含量比较(±s)
注:与模型组相比,**P<0.01;与IL-2相比,##P<0.01;与HQL比较,△△P<0.01;与HQM比较,▲▲P<0.01
组别 n 血清 胸腺对照组621.72±4.48*135.75 ±11.15**模型组6 18.24±3.35 82.93±11.56 IL-2组6611.32±5.35**451.47±14.61 HQL 647.27±5.01**##211.84±12.28**##HQM 620.93±2.61**##△△170.32±16.62**##△△HQH 620.12±4.04##△△192.24±12.13**##△△▲▲
2.4 黄芪注射液对光镜下各组小鼠胸腺 PCNA表达比较小鼠胸腺淋巴细胞核抗原PCNA阳性细胞细胞核呈棕黄色。与模型组比较,对照组小鼠胸腺PCNA表达面积百分率无明显差异(P>0.05),IL-2组、HQL、HQM、HQH组小鼠胸腺PCNA表达面积百分率有明显差异(P<0.01),与IL-2组比较,HQL组小鼠胸腺PCNA表达面积百分率有明显差异(P<0.01),而HQM、HQH组小鼠胸腺胸腺PCNA表达面积百分率无明显差异(P>0.05)。见表3。
表3 各组小鼠胸腺PCNA阳性细胞面积百分比[(±s),%]
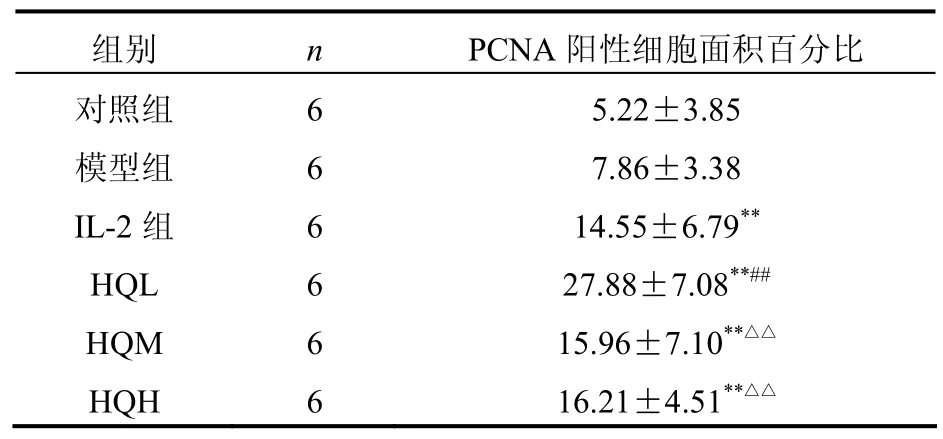
表3 各组小鼠胸腺PCNA阳性细胞面积百分比[(±s),%]
组别 n PCNA阳性细胞面积百分比对照组 6 5.22±3.85模型组 6 7.86±3.38 IL-2组 6 14.55±6.79**HQL 6 27.88±7.08**##HQM 6 15.96±7.10**△△HQH 6 16.21±4.51**△△
3 讨论
胸腺作为重要的免疫器官,是T淋巴细胞发生的场所。在生理条件下未成熟T细胞在胸腺皮质部接受细胞因子刺激信号表达 PCNA等细胞增殖因素,从而促进T细胞增殖,90%成熟TCRα、βT细胞来源于胸腺[3]。研究表明,感染性病变,尤其是急性感染性病变可能会导致胸腺萎缩,从而导致免疫功能降低。因此,本实验采用小鼠腹腔注射地塞米松构建免疫功能低下动物模型,结果表明,Dex腹腔注射后可导致小鼠胸膛萎缩、血清与胸腺IL-2含量降低等免疫功能低下性表现,提示模型复制成功。
黄芪多糖(APS)提取自中草药黄芪,具有强大的提高机体免疫功能作用,APS能诱导 CD4+T细胞产生IL-4、IL-2和IFN-γ,并且能提高CD8+T细胞中IFN-γ表达。在本实验中用黄芪多糖治疗免疫功能低下小鼠5天后,从形态学、胸腺指数、IL-2含量及PCNA表达作为研究的指标。IL-2是免疫调节核心物质,主要活化CD4+T细胞和CD8+T细胞的产生,是所有T细胞亚群的生长因子,与T细胞增殖、分化、凋亡等过程密切相关,可促进B细胞分化与增殖、增强杀伤T细胞、巨噬细胞、NK细胞的免疫活性[4]。本研究结果表明,模型组小鼠血清及胸腺匀浆液中IL-2水平均较正常对照组降低,而 IL-2组和黄芪三剂量组均能不同程度增加免疫功能低下小鼠血清及胸腺 IL-2水平,提示外源性IL-2和黄芪注射液可通过增加IL-2水平,促进胸腺淋巴细胞增殖,拮抗Dex所致胸腺萎缩。
PCNA又称周期素,本研究表明,IL-2组与黄芪注射液三剂量组均可不同程度促进小鼠胸腺PCNA表达,提示IL-2与黄芪注射液均可促进体内胸腺淋巴细胞增殖。为了探讨黄芪注射液的治疗作用是否通过促进胸腺淋巴细胞的增殖而达到,本研究采用免疫组化和 Western-blot实验观察了各黄芪治疗组胸腺细胞PCNA的表达情况。结果表明,各剂量黄芪注射液均提高了模型小鼠胸腺组织中PCNA阳性细胞的比例;Western-blot结果也验证了该结论。上述结果提示,黄芪中的有效成分具有显著促进体内胸腺淋巴细胞增殖的作用。
[1] 刘莎,符州.黄芪的免疫调节作用及其临床应用[J].国际中医中药杂志,2006,28(4):203-206.
[2] 殷平善.黄芪的临床应用及其药理中的整体系统思维[J].时珍国医国药,2006,17(7):1313-1315.
[3] Manley NR,Richie ER,Blackburn CC,et al.Structure and function of the thymic microenvironment[J].Frontiers in bioscience:a journal and virtual library,2011,1(16):2461-2477.
[4] 龚非力.医学免疫学[M].北京:科技出版社,2000.
Astragalus Injection on Proliferation of T cell immune Function of Immunosuppressed mice Yang Qiaohong Zhao Ziming Li Linlin Du Biaoyan Tan Yuhui Zhou Lian Lian Zhicheng
Guo Yurong Su Junfang Zhang Shuzheng Zhang Genshui Liu Yanling
ObjectiveTo observe the effect of astragalus injection of dexamethasone(Dex) proliferation induced immunosuppressed mice T cells.MethodsBesides control group,the other five groups were injected Dex 5 days for immunodeficient mice model,two hours after the final injection,weight recorded.ResultsCompared with the control group, thymus index and IL-2 of serum and thymus homogenate in model group were significantly reduced(P<0.05),but protein expression of PCNA had no significant difference(P>0.05).ConclusionImmunity was impaired in mice exposed to Dex,AI could play an important role in recovering the immune function,the mechanisms would be further researched.
Immunodeficient mice;Astragalus injection;Dexamethasone
R285.5
A
1673-5846(2014)01-0036-03
1广州中医药大学,广东广州 510405
2广东省中医研究所,广东广州 510405
3南方医科大学肿瘤研究所,广东广州 510515
4广西柳州市中医院,广西柳州 545001
5广州医学院,广东广州 510405
6北大第三医院妇科生殖医学中心,北京 100083
广东省中医药管理局项目资助(2007058)
刘艳玲,Email:Liuyanling1958@163.com。

