中药不良反应监测发展状况与案例分析
伍 军林晓亮江丽君王帅帅王志国
中药不良反应监测发展状况与案例分析
伍 军1林晓亮1江丽君1王帅帅2王志国2
背景中药临床应用的安全性受到社会越来越广泛的关注,如何有效加强中药不良反应监测是卫生主管部门、制药企业及医疗机构无法回避的课题。目的剖析中药不良反应监测的现状,并探讨中药不良反应监测今后的发展方向。方法综合涉及中药不良反应监测的数据和文献报告,并以香雪抗病毒口服液不良反应/事件监测研究作为范例进行分析。结果中药不良反应监测有了明显进步,但中药注射制剂与口服制剂之间存在巨大反差,企业对于口服中药制剂临床用药的风险防范意识薄弱,缺乏主动性。结论中药口服制剂的不良反应监测应得到充分重视,而制药企业应加强产品的不良反应监测研究,切实提高社会卫生保障能力和水平。
中药;不良反应;监测;抗病毒口服液
1 中药不良反应监测的重要性
随着传统中医药学与现代技术的不断结合,越来越多的中药品种和剂型进入了市场和临床应用。国家食品药品监督管理总局(CFDA)的数据系统显示,截至2013年10月17日,国产中药的批准记录共有60029条。
临床应用过程中多种中药制剂发生了不良反应和严重不良反应,引起了社会的广泛关注。对中药不良反应及用药安全性缺乏深入研究和全面认识,尤其是含毒性中药材[1]的制剂,大大制约了中药的临床应用。早在2001年,国外就有学者[2]开始对中药的安全性提出质疑。因此,进一步加强中药不良反应监测工作,提高中药临床使用安全性,是卫生主管部门、制药企业及医疗机构必须解决的难题,也是中医药现代化和国际化发展的基础。
2 中药不良反应监测的发展状况
2.1 法制与组织架构建设1999年国家药品不良反应监测中心成立。同年11月,国家药品食品监督管理局联合卫生部颁发了《药品不良反应监测管理办法(试行)》(下列简称“管理办法”),标志着我国药品不良反应监测迈出了规范化管理的重要一步[3]。2004年和 2011年[4],管理办法先后经历了两次修订,进一步完善了药品不良反应监测的法律基础。2011年版管理办法中,在原来自发呈报系统(被动监测)的基础上,首次引入重点监测的概念,相当于国际上现有的主动监测理念[4]。在法规演变的同时,国家不良反应监测的管理组织架构也不断完善,建立了各级不良反应监测机构。
2.2 不良反应监测数据及文献分析
2.2.1 监测数据介绍 回顾 2009~2012年 CFDA发布的年度药品不良反应监测报告[5-8],将药品不良事件监测数据总结如下表1~2。
表1数据显示,我国药品不良反应报告的数量逐年增加,2012年度增长尤为明显,其中,中药不良反应所占比例也呈逐年上升趋势。虽然中药不良反应报告的相对占比仍然较低,但以绝对数量计算,2012年较2009年上升了141.5%。表2数据显示,2009~2012年,虽然医疗机构仍是药品不良反应报告的主力军,但制药企业和个人的报告比例呈上升趋势,说明药企及患者/消费者对不良反应监测的参与度有所提高。
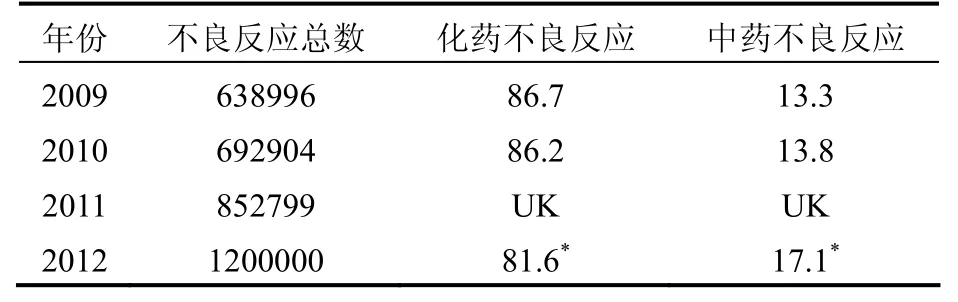
表1 不良反应监测数据(n,%)
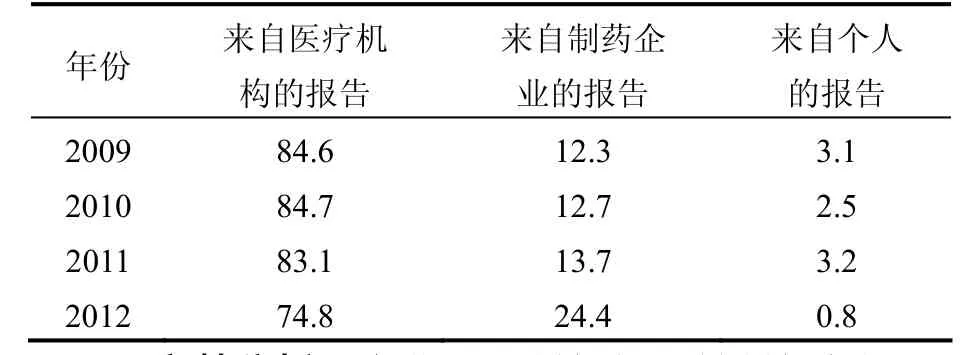
表2 药品不良反应报告来源
2.2.2 文献分析 中药口服制剂与注射制剂之间不良反应监测失衡。2011年国家不良反应监测报告[7]表明,中药注射剂仍是中药制剂中存在安全性隐患较大的剂型。回顾以往的文献报告不难发现,单纯报道中药注射剂不良反应的论文比较多[9-12],而单纯报告口服中药不良反应的文献聊聊无几[13]。2011年,高天等[14]报告新的严重不良反应63.16%(12/19)发生在口服中药制剂;姚苑梅等[15]报道 1768例不良反应事件(ADR)涉及468个中药制剂品种,其中61个中药注射剂品种导致ADR 854例次,占总例数的48.30%,而357种不同剂型的口服中药制剂导致ADR 806例次,占总例数的45.59%。由此可见,虽然口服中药制剂 ADR的发生率相对较中药注射剂低,但由于中药口服制剂的品种多、使用广泛,所以因 ADR所造成的用药安全性问题也很突出。随着对中药注射剂不良反应监测的水平不断提高,中药口服制剂不良反应监测的不足将愈来愈明显。中药口服制剂必须加强科学、系统的不良反应监测工作,才能真正扭转这种失衡的局面,消除社会对中药用药安全性的疑虑。
2.3 制药企业在不良反应监测中的角色转变2011年版管理办法凸显了制药企业在不良反应监测中的作用[4],药品上市后安全性再评价研究需要药企更多的参与。对于新上市的药品,新药监测期Ⅳ期临床试验能够在更大范围的人群中明确药品的安全性。而很多上市多年的中药产品,包装说明书的“不良反应”一栏依然是“暂不明确”,甚至是“无”,这类中药产品上市后的不良反应监测研究亟待加强。表2数据显示,药企在不良反应报告中的占比虽然很小,但呈上升趋势。可以预期,随着管理力度的加大和制药企业对安全性再评价的重要性认识加深,这个百分比会继续升高。
3 案例分析
以下就广州市香雪制药股份有限公司(以下简称“广州市香雪制药”)开展的抗病毒口服液不良反应/事件监测研究为范例,阐述一个上市多年的中药口服制剂如何开展上市后不良反应/事件监测研究。
3.1 背景资料药物组方源于东汉名医张仲景《伤寒论》的名方“白虎汤”和清代《疫诊一得》中的“清瘟败毒饮”。上世纪七十年代初,为了治疗东北大规模的病毒性流行性传染病,由沈阳药科大学主持研制,以“白虎汤”和“清瘟败毒饮”为基础化裁成方。之后,经过广州市香雪制药不断研发和广泛的临床应用验证,香雪抗病毒口服液成为防治流感/感冒的一线用药。2010年,被卫生部发布的《手足口病诊疗指南(2010年版)》列为治疗手足口病用药[16];2013年,被国家中医药管理局编著的《流行性感冒与人感染禽流感诊疗及防控技术指南》列为推荐用药[17]。
目前,抗病毒口服液年销售额达7亿元,是我国治疗感冒中成药中年销售额名列前茅的品种。2012年,香雪抗病毒口服液年销量额超过4亿元。CFDA的数据系统显示,目前全国抗病毒口服液的生产企业有23家,虽然有多家企业销售该产品,但开展产品上市后不良反应/事件研究的企业仅有广州市香雪制药一家。
文献调研显示,抗病毒口服的临床研究[18-27]绝大部分着重观察其临床疗效,而忽视了其不良反应。因此广州市香雪制药开展的该项不良反应/事件监测研究显得弥足珍贵,填补了这方面研究的空白。
3.2 研究设计与结果香雪抗病毒口服液不良反应/事件监测研究采取医院集中监测的设计,在相对固定(2012年5月~2013年1月)的一段时间内,通过医院电子数据采集服用香雪抗病毒口服液患者的资料,包括人口统计学信息、合并疾病、用药史、过敏史、不良反应和不良事件、实验室检验等。采集信息后通过电话随访,以确认用药情况以及是否发生了不良反应/事件,并采集信息以判断不良反应/事件与药物的关联性。在完成了信息采集和随访工作后,对采集到的数据进行处理和统计分析。该研究开展之前得到研究单位的伦理委员会批准[28]。
研究期间从5家研究中心共入组了10089例患者。入组患者最常见的病种是呼吸道疾病,例如上呼吸道感染、感冒、急性支气管炎;其次是传染病和寄生虫病,例如病毒性皮疹、疱疹性咽峡炎、手足口病等[29]。
10089例患者共计发生了不良事件258例,严重不良事件32例。经过因果关系评估,判定与药物的关系是“可能有关”的是94例,不良反应发生率为0.93%(94/10089)。与药物相关的严重不良事件为0,严重不良反应率为0%[29]。根据国际医学科学组织委员会(CIOMS)推荐的不良反应发生率分级[30],该研究药品的不良反应发生率属于偶见范围。根据器官系统分类,94例不良反应分布见表3;不良反应严重程度分布见表4[29]。
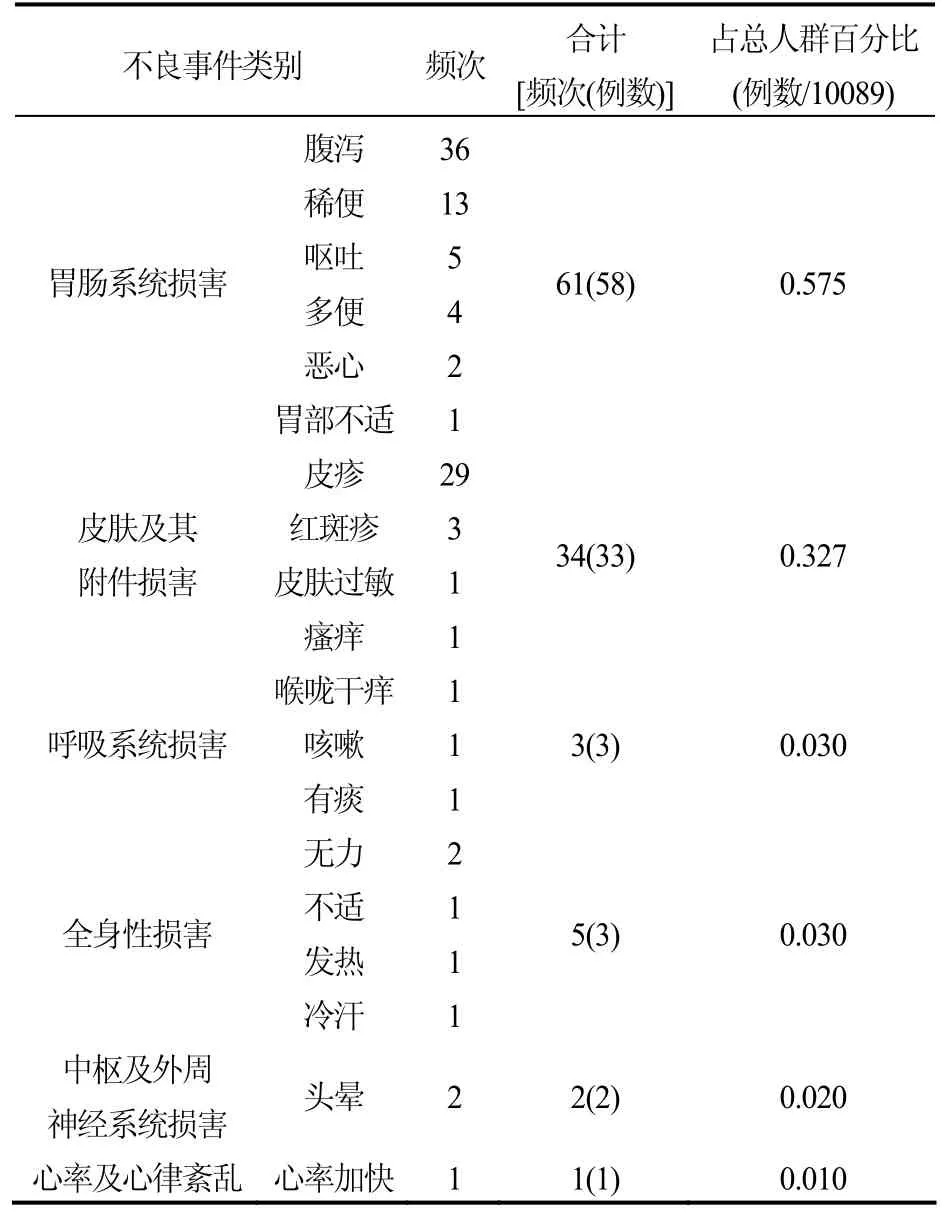
表3 药物不良反应的器官系统分类

表4 不良反应严重程度(以频次计)(n,%)
3.3 案例的意义常用的口服药物由于使用患者人群非常大,有必要明确其临床应用的安全性。香雪抗病毒口服液不良反应/事件监测研究,为口服中药制剂的不良反应监测树立了成功的典范。另外,在数据采集、挖掘、分析和评价方面,该项研究也起到了示范作用。在全国23家抗病毒口服液生产企业中,广州市香雪制药是目前唯一一家完成该产品不良反应/事件监测研究的企业,通过严谨、系统的不良反应监测研究,既丰富了香雪抗病毒口服液的科学内涵,也提高了产品临床用药的安全性。
4 讨论
从 1999年第一版管理办法公布至今已经历了14年,中国药品不良反应监测走过不少弯路,也取得了长足的进步。随着制药行业的发展以及患者需求的增加,中药不良反应监测工作应从简单的信息收集,转变为完整的药物警戒体系,进行安全性信号的采集、评价和风险防范。这个体系不仅包括药监部门和医院,也包括制药企业和个人;不仅要覆盖中药注射制剂,也应该重视中药口服制剂,使不良反应监测更加全面,为患者提供更大的用药安全保障。
随着中药制剂应用普及,用药人群不断扩大,中药制剂的不良反应监测理应得到卫生主管部门的关注,尤其是一直被忽视的中药口服制剂的不良反应监测。同时,中药制造企业也应在中药不良反应监测中承担更多的社会责任,对本企业生产的药品进行有效的监测,并及时汇报、公布药品安全性信息。
[1] 周廷智.含毒中药的合理应用与不良反应[J].医学理论与实践,2012,25(23):2977-2978.
[2] Christie Aschwanden.Herbs fox health,but how safe are they?[J].The World Health Organization The International Journal of Public Health,2001,79:691-692.
[3] 张力,杨晓晖,曹立亚,等.关于我国中药不良反应监测工作现状和发展的思考[J].中国中西医结合杂志,2005,25(7):581-584.
[4] 王丹,杜晓曦.药品不良反应报告和监测管理办法解读及对中药不良反应监测的意义[J].中国中药杂志,2012,37(18):2686-2688.
[5]国家食品药品监督管理局.2009年国家药品不良反应监测年度报告[EB/OL].(2010-06-01).http://www.sda.gov.cn/WS01/CL0051/ 48201.html.
[6] 国家食品药品监督管理局.2010年国家药品不良反应监测年度报告(简写版)[EB/OL].(2012-05-31).http://www.sda.gov.cn/WS 01/CL0051/60952.html.
[7] 国家食品药品监督管理局.2011年国家药品不良反应监测年度报告[EB/OL].(2012-05-31).http://www.sda.gov.cn/WS01/CL0051/ 72190.html.
[8] 国家食品药品监督管理局.2012年国家药品不良反应监测年度报告[EB/OL].(2012-05-31).http://www.gov.cn/gzdt/2013-03/14/ content-2353964.htm.
[9] 马姝丽.中药注射剂 85例不良反应分析[J].中国医药指南, 2012,10(19):328-329.
[10] 周晶鑫.6例参麦注射液不良反应分析[J].中国药物警戒, 2012,9(11):693-695.
[11] 李震,王书芬.99例中药注射剂不良反应分析[J].中国当代医药,2012,19(33):135-136.
[12] 武为宝,武培璐,文良东.对 306份中药注射剂不良反应监测报告的分析[J].中国医药指南,2012,10(30):258-259.
[13] 王爱梅.口服中药汤剂所致的不良反应临床分析[J].中医临床研究,2013,5(5):18-19.
[14] 高天,黄文志,向燕,等.90例中药严重(新的严重)不良反应分析[J].中药与临床,2011,2(1):39-41.
[15] 姚苑梅,徐玉红.1768例中药制剂不良反应报告分析[J].中国药物警戒,2011,8(9):566-569.
[16] 广州市香雪制药股份有限公司.香雪抗病毒口服液临床试验研究者手册(不良反应/事件监测分析研究)[S].广东.
[17] 国家中医药管理局突发公共事件中医药应急专家委员会.流行性感冒与人感染禽流感诊疗及防控技术指南[M].北京:中国中医药出版社,2013:232-234.
[18] 刘永富.病毒唑配和抗病毒口服液治疗小儿手足口病的疗效观察[J].包头医学院学报,2007,23(6):639-640.
[19] 董巧丽,柏金秀,杨小巍,等.抗病毒口服液治疗手足口病普通病例的疗效观察[J].儿科药学杂志,2012,18(6):27-29.
[20] 林苏,余家姮.抗病毒口服液治疗小儿外感病毒性疾病 61例[J].福建中医药大学学报[J].1996,6(2):15.
[21] 霍玲玲、冯建科,王小龙,等.清开灵口服液联合抗病毒口服液及利巴韦林注射液治疗手足口病的疗效观察[J].甘肃医药,2013, 32(2):100-102.
[22] 薛晓凤.抗病毒口服液治疗上呼吸道感染 168例[J].光明中医,2012,27(4):725.
[23] 柯炳峰.四种治疗病毒性感冒方案的成本-效果分析[J].广西医学,2008,30(9):1376-1378.
[24] 冯卫文.思密达、抗病毒口服液、山莨菪碱联合治疗小儿腹泻60例[J].广西医学,2007,29(6):948.
[25] 潘俊辉,杨辉,喻清和,等.SARS病例密切接触者抗病毒口服液防治流行病学调查[J].中国处方药,2003(8):13-14.
[26] 麻列波,徐润香,姚黎明.更昔洛韦合并抗病毒口服液治疗小儿疱疹性咽峡炎的临床观察[J].海峡药学,2011,23(4):151-152.
[27] 冯海荣.抗病毒口服液治疗原发性疱疹性口炎疗效观察[J].河北中医,2003,25(5):342-343.
[28] 广州市香雪制药股份有限公司.抗病毒口服液的不良反应/事件监测分析研究方案.广东.
[29] 广州市香雪制药股份有限公司.抗病毒口服液的不良反应/事件监测研究总结报告.广东.
[30] CLOMSⅢ Report.Guidelines for preparing Core Clinical Safety Information on Drugs,Second Edition Report of CIOMS Working Groups III and V including New Proposals for Investigator’s Brochures[J].Geneva,1999.
Progression in Monitoring of Adverse Reactions on TCM Products and A Case Study
Wu Jun Lin Xiaoliang Jiang Lijun Wang Shuaishuai Wang Zhiguo
BackgroundSince more and more concern is raised regarding clinical safety of TCM products,effective and enhanced monitoring on adverse reactions of TCM products has become an inevitable subject for health authorities,pharmaceutical companies and medical institutes.ObjectiveTo analyze current status and to explore the future of monitoring on adverse reactions of TCM products.Methodsdata and literature reports concerning adverse reactions monitoring of TCM products were reviewed and summarized,and an adverse reactions/events monitoring study as conducted by Guangzhou Xiangxue Pharmaceutical was analyzed as a paradigm.ResultsSignificant progress has been made in the monitoring of adverse reactions to TCM products.There is,however,huge difference between injectable and orally administered products in the monitoring.Pharmaceutical companies are hardly aware of the clinical risks with orally administered TCM products and thus are not initiative.ConclusionAdequate attention should be given to the monitoring of adverse reactions to orally administered TCM products,while pharmaceutical companies should strengthen adverse reactions monitoring study on their products,so as to substantially improve protection for public health.
Traditional Chinese Medicine;Adverse Veaction;Monitor;Kangbingdu Koufuye
R286
A
1673-5846(2014)01-0022-04
1广州市香雪制药股份有限公司,广东广州 510663
2广州海博特医药科技有限公司,广东广州 510620

