NaCl对瓦斯水合物相平衡的影响
张保勇,于 跃,吴 强,高 霞,张 强
(1.黑龙江科技大学安全工程学院,黑龙江哈尔滨 150022;2.中国矿业大学煤矿瓦斯治理国家工程研究中心,江苏徐州 221008;3.瓦斯等烃气输运管网安全基础研究国家级专业中心实验室,黑龙江哈尔滨 150022;4.黑龙江科技大学建筑工程学院,黑龙江哈尔滨 150022)
NaCl对瓦斯水合物相平衡的影响
张保勇1,2,3,于 跃1,3,吴 强1,3,高 霞4,张 强1,3
(1.黑龙江科技大学安全工程学院,黑龙江哈尔滨 150022;2.中国矿业大学煤矿瓦斯治理国家工程研究中心,江苏徐州 221008;3.瓦斯等烃气输运管网安全基础研究国家级专业中心实验室,黑龙江哈尔滨 150022;4.黑龙江科技大学建筑工程学院,黑龙江哈尔滨 150022)
相平衡条件及其影响因素对瓦斯水合物的快速大量生成具有重要指导意义,利用高压可视瓦斯水合实验装置并结合图解法研究了3种质量分数NaCl溶液(0.5%,2.0%和3.5%)体系中瓦斯混合气(CH4-C3H8-CO2-N2-O2)水合物相平衡条件。结果表明:NaCl改变了瓦斯水合物形成相平衡条件,致使相平衡条件更加苛刻;相同温度条件下,9组实验瓦斯水合物形成相平衡压力较纯水体系升高0.50~2.98 MPa。基于水合离子电离平衡理论建立了瓦斯水合物相平衡NaCl影响机理假说模型,认为NaCl电离出的Na+和Cl-强电场作用对水分子产生作用力,破坏了瓦斯气体分子周围水团簇结构形成。
瓦斯水合物;NaCl溶液;相平衡;水分子簇
国家《能源中长期发展规划纲要(2004—2020年)》确定,我国将坚持以煤炭为主体的能源战略,瓦斯气作为煤炭伴生气体,对煤矿安全生产构成严重威胁;同时,瓦斯气又是一种优质高效清洁能源,然而2012年我国煤矿瓦斯利用率仅为41.6%,其余直接排放到大气中,不仅造成能源大量浪费和经济损失,而且严重污染生态环境。基于此,吴强等提出利用瓦斯水合机理分离煤矿瓦斯新思路[1-3]。其技术应用关键是如何使瓦斯水合物在更温和条件(即相平衡条件)下快速大量生成。相平衡条件是瓦斯水合物技术应用基础[4],是驱动力条件确定[5]、动力学规律探寻[4]、促进剂优选[6]等研究工作的依据。因此,对其影响规律研究具有重要的科学意义。
瓦斯水合物形成相平衡条件的影响因素较多,主要包括气体组分体积分数[7]、液体构成[8-9]以及介质添加作用[10-11]等,国内外学者针对溶液离子构成对纯甲烷水合物相平衡条件的影响开展了相关研究工作。Yang等[12]认为NaCl会降低气体水合物稳定性,可能促进甲烷水合物形成;宋永臣等[9]研究表明,Mg2+,Ca2+,Na+,K+四种阳离子对甲烷水合物相平衡抑制作用逐渐减弱,而,Cl-三种阴离子均有明显抑制作用;孙始财等[13]对氯盐溶液中甲烷水合物高压分解条件研究后认为,离子静电作用降低了水的活度,从而导致水合物分解温度降低;Yang Mingjun等[7,14]所得实验数据表明卤素离子(F-,Cl-, Br-,I-)可降低体系相平衡温度,但离子成分对其影响不大;Liu Changling等[15]发现不同离子均抑制了甲烷水合物生成。综上所述,氯盐溶液离子对纯甲烷水合物相平衡有重要影响,然而对于复杂煤矿瓦斯混合气体水合物相平衡条件影响研究工作鲜见报道。
本文拟利用高压可视瓦斯水合实验装置并结合图解法研究不同质量分数NaCl溶液(0.5%,2.0%和3.5%)体系中瓦斯气体水合物相平衡条件,以期获得相平衡条件变化规律,为瓦斯水合固化分离技术实现工业化应用提供参考。
1 实 验
1.1 实验系统
实验室自主设计的煤矿瓦斯水合实验装置如图1所示。该装置主要由150 mL透明高压反应釜、精密恒温液浴槽、气体进样增压系统和数据采集系统等组成。反应釜有效容积150 mL,承压极限20 MPa,温度使用范围为-10~50℃,釜两端为耐高压金属固定装置,密封圈为氟胶材料;精密恒温液浴槽有效容积305 L,恒温范围-15~90℃,可精确调控温度,恒温波动误差范围±0.1℃;高精度压力传感器测量精度为±0.01MPa,耐高压温度传感器测量精度±0.01℃。

图1 瓦斯水合实验装置示意Fig.1 Experimental setup for hydration experimental of coal mine gas
1.2 实验体系
实验所用试剂主要有蒸馏水、NaCl晶体以及3种不同组分体积分数的瓦斯气样,其中蒸馏水为实验室自制;NaCl晶体购自上海天利化工有限公司;瓦斯气样由哈尔滨黎明气体有限公司配制,气样组分包括:G1为φ(CH4)=85%,φ(CO2)=5%,φ(C3H8)= 5%,φ(N2)=2%,φ(O2)=3%;G2为φ(CH4)= 70%,φ(CO2)=5%,φ(C3H8)=10%,φ(N2)=12%, φ(O2)=3%;G3为φ(CH4)=55%,φ(CO2)=5%, φ(C3H8)=15%,φ(N2)=22%,φ(O2)=3%。具体初始条件见表1。

表1 瓦斯水合物相平衡实验初始条件Table 1 Parameters of experimental systems for gas hydrate phase equilibrium experiments
2 实验结果与讨论
2.1 相平衡条件的确定
采用图解法研究瓦斯水合物相平衡条件,该方法适用于全封闭高压反应釜,对于测定多元混合物在电解质溶液中生成条件时误差相对较小[16-17]。根据相平衡图解法进行实验操作,此方法的关键在于找到水合物开始生成、生成结束以及开始分解点,据此,利用软件绘制出体系温度-压力变化曲线,得到相平衡点。整个过程需要充足的时间,以克服在分解时瓦斯水合物的自保效应。实验过程中典型p-T曲线如图2所示,该曲线是对反应体系2-1数据处理后绘制而成。
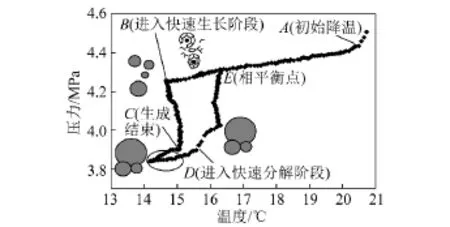
图2 瓦斯水合反应过程温度-压力曲线Fig.2 p-T curve of hydration reaction
图2曲线能够准确显示出瓦斯水合的不同阶段,实验初始时记作A点;其后每降低2℃等待足够长时间,随温度的下降,压力逐渐下降,此过程气体首先在溶液中达到过饱和,而后气体分子溶于液相形成亚稳态团簇结构并聚集凝结直至形成稳定晶核,随即进入晶核快速生长时期(图2中B点开始),该阶段晶核将快速生长成具有宏观规模的水合物晶体进入快速生长阶段,当压力逐步趋于稳定,水合物生长基本结束。为进一步确定水合物是否完全生成,继续降低温度发现压力紧随温度的下降而下降,逐渐升高温度并等待足够长时间,随温度的上升,压力逐渐上升,D点压力上升,水合物开始分解,但压力上升速度缓慢,这与分解吸热和铠甲效应有关;当压力升至初始阶段交点处得到曲线交点E,此时温压条件即为相平衡点。利用相同方法可得到其他相平衡条件,获得的相平衡参数见表2。
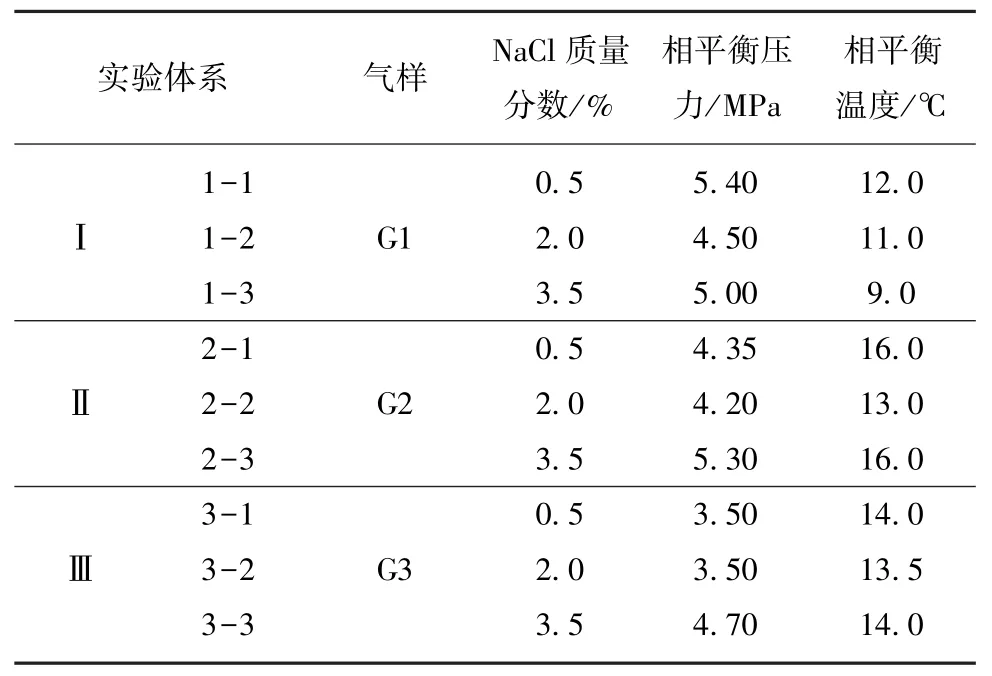
表2 相平衡实验结果Table 2 Experimental results of phase equilibrium
对应生成和分解阶段的典型图像如图3所示,实验初始压力为4.5 MPa,初始温度为20℃,待温度达到15.8℃时反应釜内有白色絮状固体出现,即可视化晶体(图3(a));当温度降至15.1℃,压力为4.27 MPa,水合物开始以白色冰片状大量生成(图3(b));当压力稳定在3.89 MPa,温度为15.1℃,水合物生成结束,水合物基本充满整个反应釜(图3(c));水合物完全融化前最后形态即相平衡临界状态如图3(d)所示。

图3 水合物生成与分解过程Fig.3 Formation and dissociation process of hydrates
2.2 NaCl对瓦斯水合物相平衡条件的影响
为分析NaCl溶液对相平衡条件影响,需要以空白体系相平衡条件作为参照,为此,需利用相平衡热力学模型预测纯水体系相平衡条件。对于纯水体系,相平衡约束条件为

式中,Δμw,H为水在空水合物晶格与水合物相中之间的化学位差,J/mol;Δμw,L为水在空水合物晶格与水相中之间的化学位差,J/mol。
Sloan引入水合物相中水的活度系数表征水合物的非理想性,采用三层球模型提出了相平衡热力学预测模型,即
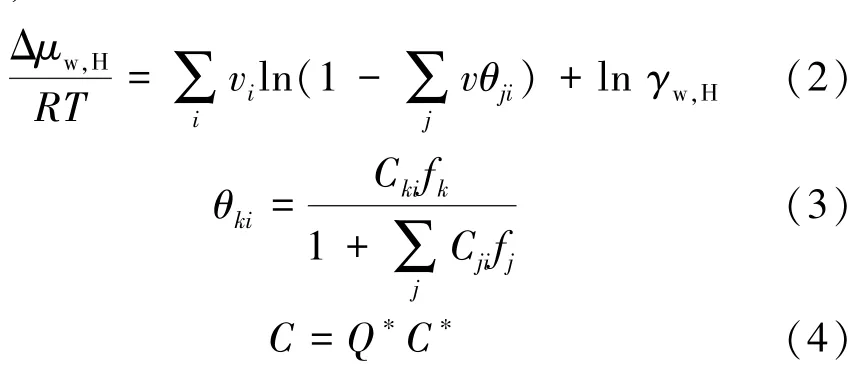
式中,R为通用气体常数;T为温度,K;vi为i型孔穴百分数;θji为j类客体分子在i型孔穴中的占有率;ln γw,H为活度系数项;f为气体组分的逸度;C为Langmuir常数;C∗为考虑外层水分子对孔穴中客体分子势能影响后的Langmuir常数;Q∗为修正系数。
基于Sloan提出的van der Waals-Platteeuw改进模型计算出纯水体系相平衡理论条件,将本文NaCl添加实验体系瓦斯水合物相平衡值与计算值进行对比分析,见表3。
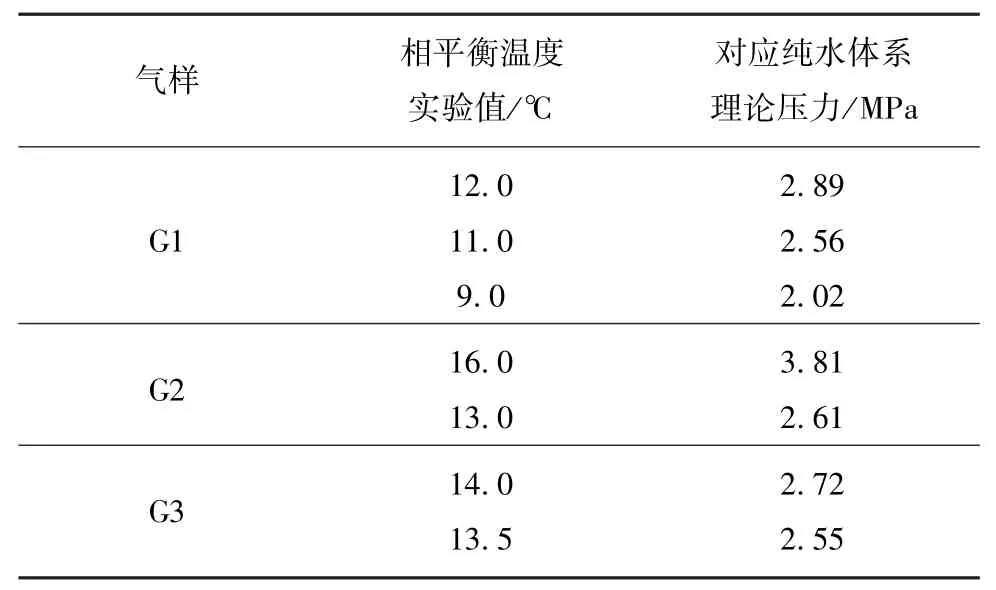
表3 纯水体系相平衡条件Table 3 Phase equilibrium conditions in pure water system
由此,获得瓦斯水合物相平衡温度-压力条件三维坐标系(图4),与纯水体系相比,同等温度条件下3种质量分数NaCl溶液达到相平衡所需压力均有大幅度的增加,然而,由于体系存在3个变量且各变量敏感性未知,故无法确定相平衡压力与NaCl的浓度关系是否完全为单调相关,但是实验测得的9组相平衡条件对比纯水体系均有明显变化,且趋势全部相同,即添加NaCl体系相平衡条件均比纯水体系苛刻。9组实验相较于纯水体系相平衡压力最低升高0.54 MPa,最高升高2.98 MPa。同时,从G2,G3两种气样实验结果中可发现明显的单调相关趋势,即气样G2在温度16℃下的纯水、0.5%及3.5%NaCl溶液体系中达到相平衡所需压力分别为:3.81,4.35, 5.30 MPa;气样G3在温度14℃下的纯水、0.5%及3.5%NaCl溶液体系中达到相平衡所需压力分别为2.72,3.50,4.70 MPa,压力均明显递增。由此可见,瓦斯水合反应体系中NaCl的加入提高了水合物形成热力学条件。

图4 不同溶液体系相平衡条件Fig.4 Phase equilibrium conditions of different solution systems
2.3 瓦斯组分对相平衡条件的影响
考虑到NaCl溶液体系中瓦斯气体组分浓度对相平衡热力学条件的影响,绘制了以瓦斯气样为研究对象的二维坐标系,结合Sloan的相平衡预测模型的预测结果对不同NaCl质量分数条件下的相平衡曲线进行了二项式拟合,如图5所示。

图5 不同瓦斯气样水合物相平衡条件Fig.5 Phase equilibrium conditions of different sample of gas hydrate
从图5可知,不同质量分数NaCl溶液体系中,同等压力达到相平衡所需的温度由低到高依次为G1, G2,G3,而G1,G2,G3的C3H8含量分别为5%,10%和15%,说明气体成分的变化影响反应体系相平衡热力学条件,气样的改变(CH4体积分数逐渐降低、C3H8体积分数逐渐升高)使体系相平衡条件逐渐趋于温和,而相平衡条件的改变归因于CH4体积分数的降低或C3H8体积分数的升高还需进一步研究。
3 NaCl对相平衡影响机理分析
为探索NaCl对瓦斯气体水合物相平衡条件的影响机理,基于气体水合物形成理论,提出如下NaCl对瓦斯水合物相平衡影响机理假说。
平衡态下瓦斯气体的体积分数或溶解度决定了瓦斯水合物生成及稳定所需的最小气体体积分数[18-19],以便多余的瓦斯气体在一定条件下能够形成瓦斯水合物。气体在水中的溶解过程包括扩散溶解过程和溶剂化作用两个阶段[5,20],该过程中水分子围绕气体分子定向排列形成结构相对稳定的分子簇,在晶核形成过程中充当着基本构造单元的角色,分子簇的形成打破了传统意义上的溶解平衡,从而使甲烷等组分气体“过度”溶解于液相中,营造出一个“过饱和”环境。
分子簇的形成建立起水合物形成的基础环境(图6(a))。然而,NaCl作为一种电解质,其电离后生成Na+和Cl-,二者对水分子产生一种相互作用力(图6(b)),被水分子包围形成水合钠离子和水合氯离子,破坏了围绕在气体分子周围的水的团簇结构的形成(图6(c))。因此,NaCl形成的电解质溶液会降低气体分子溶解量。
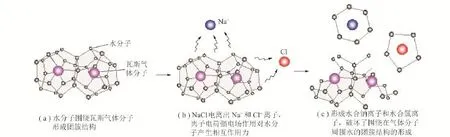
图6 NaCl对瓦斯水合物相平衡影响模型Fig.6 Phase equilibrium influence model of NaCl on mine gas hydrate
在NaCl溶液体系中,瓦斯气体分子首先以分子扩散的形式溶解于液相并被水分子簇松散包围,形成极不稳定的类笼型结构,并不断与周围大分子簇碰撞,直至形成结构相对稳定的笼型结构[21],由于离子电荷强电场作用改变了体系原有的电离平衡[13],降低了气体分子与水分子的接触机会,减少了水分子簇的碰撞,进而影响瓦斯气体分子周围水分子簇的稳定形成,为抵消Na+和Cl-产生的这种“阻力能”,建立瓦斯水合物形成的基础环境,需要给体系提供一定程度的“驱动力”来平衡这种作用力,进而改变了水合物形成的相平衡条件。Na+和Cl-含量越高,需要克服的“阻力能”就越大,因此,瓦斯水合物形成热力学条件与纯水体系相比存在较大差异。
通过热力学理论也可得出上述实验结果:瓦斯水合物相平衡热力学条件描述的是在温度平衡(热平衡)和压力平衡(力平衡)的基础上,水在水合物相及水在富水相中的化学势相等这一状态[21]。同时为确定化学位,Sloan采用三层球模型所提出的相平衡热力学预测模型引入了水合物相中水的活度系数,(式(2))。水的活度aw也表示为
aw=γwxw(5)
式中,γw为水的活度系数;xw为溶液中水的摩尔分数。
纯水中,水的活度和活度系数均为1,但在NaCl溶液中,电离出的离子产生离子电荷强电场作用,吸引水分子聚集在Na+和Cl-周围形成水合离子,降低了气体在水中的溶解度,改变了体系自由能及各组分的活度系数[7],致使水的活度系数以及水的活度降低,导致体系热力学条件变化,进而影响了体系中瓦斯水合物生成相平衡条件。
4 结 论
(1)通过对3种组分瓦斯气体在质量分数分别为0.5%,2.0%以及3.5%的NaCl溶液体系中生成水合物所需的热力学条件比较发现:NaCl改变了瓦斯水合物形成相平衡条件,致使相平衡条件更加苛刻,9组实验相较于纯水体系相平衡压力最低升高0.54 MPa,最高升高2.98 MPa。
(2)通过对不同组分体积分数的瓦斯气体生成水合物相平衡条件比较发现,气体成分的变化影响反应体系相平衡热力学条件,气样的改变(CH4体积分数逐渐降低、C3H8浓度逐渐升高)致使体系相平衡条件逐渐趋于温和,而相平衡条件的改变归因于CH4体积分数的降低或是C3H8体积分数的升高还需进一步研究。
(3)基于水合离子电离平衡理论探讨了NaCl对瓦斯水合物相平衡条件影响机理,认为NaCl电离出的Na+和Cl-强电场作用对水分子产生作用力,破坏了瓦斯气体分子周围水团簇结构形成。
目前NaCl溶液体系瓦斯混合气水合物相平衡热力学研究较少,因此要进一步揭示其作用规律需要进一步更广泛的理论和实验研究。
本文同时获得国家自然科学基金(51404102, 51174264)及黑龙江省普通高等学校青年学术骨干支持计划项目资助,特此致谢。
参考文献::
[1] Wu Qiang,He Xueqiu.Preventing coal and gas outburst using methane hydration[J].Journal of China University of Mining&Technology,2003,13(1):7-10.
[2] 吴 强,李成林,江传力.瓦斯水合物生成控制因素探讨[J].煤炭学报,2005,30(3):283-287.
Wu Qiang,Li Chenglin,Jiang Chuanli.Discussion on the control factors of forming gas hydrate[J].Journal of China Coal Society,2005, 30(3):283-287.
[3] 张保勇,吴 强.表面活性剂在瓦斯水合物生成过程中动力学作用[J].中国矿业大学学报,2007,36(4):478-481.
Zhang Baoyong,Wu Qiang.Dynamic effect of surfactant on gas hydrate formation process[J].Journal of China University of Mining& Technology,2007,36(4):478-481.
[4] Sun Changyu,Li Wenzhi.Progress in research of gas hydrate[J].Chinese Journal of Chemical Engineering,2011,19(1):151-162.
[5] 陈孝彦,何小社,何晓霞,等.天然气水合物生成动力学机理的研究[J].西安交通大学学报,2004(1):85-88.
Chen Xiaoyan,He Xiaoshe,He Xiaoxia,et al.Study on kinetics of natural gas hydrate formation[J].Journal of Xi’an Jiaotong University,2004(1):85-88.
[6] Wang Shuli,Wei Mingjiao,Li Entian,et al.Experimental investigation on promoting effect of composite promoting agents on natural gas hydrate formation[J].China Petroleum Processing and Petrochemical Technology,2012,14(1):20-24.
[7] Yang Mingjun,Song Yongchen,Liu Yu,et al.Influence of pore size, salinity and gas composition upon the hydrate formation conditions [J].Chinese Journal of Chemical Engineering,2010,18(2):292-296.
[8] Vikash Kumar Saw,Iqbal Ahmad,Ajay Mandal,et al.Methane hydrate formation and dissociation in synthetic seawater[J].Journal of Natural Gas Chemistry,2012,21(6):625-632.
[9] 宋永臣,杨明军,刘 瑜,等.离子对甲烷水合物相平衡的影响[J].化工学报,2009,60(6):1362-1366.
Song Yongchen,Yang Mingjun,Liu Yu,et al.Influence of ions on phase equilibrium of methane hydrate[J].CIESC Journal,2009, 60(6):1362-1366.
[10] 魏厚振,颜荣涛,韦昌富,等.含天然气水合物沉积物相平衡问题研究综述[J].岩土力学,2011,32(8):2287-2294,2306.
Wei Houzhen,Yan Rongtao,Wei Changfu,et al.Summary of researches for phase-equilibrium of natural gas hydrates in bearing sediments[J].Rock and Soil Mechanics,2011,32(8):2287-2294, 2306.
[11] 吴保祥,雷怀彦,段 毅,等.沉积物体系中甲烷水合物平衡温度、压力条件实验模拟[J].石油勘探与开发,2004,31(4):22-24,28.
Wu Baoxiang,Lei Huaiyan,Duan Yi,et al.Experimental simulation on equilibrium temperature and pressure of methane hydrate in sediment systems[J].Petroleum Exploration and Development,2004, 31(4):22-24,28.
[12] Yang Dinghui,Xu Wenyue.Effects of salinity on methane gas hydrate system[J].Science in China Series D:Earth Sciences,2007, 50(11):1733-1745.
[13] 孙始财,刘昌岭,业俞光,等.氯盐溶液中甲烷水合物高压分解条件及影响因素[J].物理化学学报,2011,27(12):2773-2778.
Sun Shicai,Liu Changling,Ye Yuguang,et al.Dissociation conditions and influencing factors of methane hydrate in chloride salt solution under high pressure[J].Acta Phys.Chim.Sin.,2011, 27(12):2773-2778.
[14] Yang Mingjun,Song Yongchen,Liu Yu,et al.Effects of halogen ions on phase equilibrium of methane hydrate in porous media [J].Int.J.Thermophys,2012,33:821-830.
[15] Liu Changling,Ye Yuguang,Sun Shicai,et al.Experimental studies on the P-T stability conditions and influencing factors of gas hydrate in different systems[J].Science China Earth Sciences,2013, 56(4):594-600.
[16] Marshall D R,Saito S,Kobayashi R.Hydrates at high pressures: Part 1,methane-water,argon-water,and nitrogen-water systems [J].AIChE J.,1964,10(2):202.
[17] Shroeter J P,Kobayashi R,Hildebrand M A.Hydrate decomposition conditions in the system hydrogen sulfide-methane-propanep[J].Ind.Eng.Chem.Fundam,1983,22:361-364.
[18] 刘昌岭,陈 强,业渝光,等.多孔介质中甲烷水合物生成的排盐效应及其影响因素[J].石油学报,2006,27(5):56-60.
Liu Changling,Chen Qiang,Ye Yuguang,et al.Salt removing effect and affecting factors for forming methane hydrate in porous media [J].Acta Petrolei Sinica,2006,27(5):56-60.
[19] 苏 正,陈多福.海洋环境甲烷水合物溶解度及其对水合物发育特征的控制[J].地球物理学报,2007,50(5):1518-1526.
Su Zheng,Chen Duofu.Calculation of methane hydrate solubility in marine environment and its constraints on gas hydrate occurrence [J].Chinese Journal of Geophysics,2007,50(5):1518-1526.
[20] 陈光进,马庆兰,郭天民.气体水合物生成机理和热力学模型的建立[J].化工学报,2000,51(5):626-630.
Chen Guangjin,Ma Qinglan,Guo Tianmin.A new mechanism for hydrate formation and development of thermodynamic model[J].CIESC Journal,2000,51(5):626-630.
[21] 陈光进,孙长宇,马庆兰.气体水合物科学与技术[M].北京:化学工业出版社,2007.
Effect of NaCl on the phase equilibrium of mine gas hydrate
ZHANG Bao-yong1,2,3,YU Yue1,3,WU Qiang1,3,GAO Xia4,ZHANG Qiang1,3
(1.Department of Safety Engineering,Heilongjiang University of Science and Technology,Harbin 150022,China;2.National Engineering Research Center for Coal&Gas Control,China University of Mining&Technology,Xuzhou 221008,China;3.National Central Laboratory of Hydrocarbon Gas Transportation Pipeline Safety,Harbin 150022,China;4.School of Architecture and Civil Engineering,Heilongjiang University of Science and Technology,Harbin 150022, China)
Phase equilibrium conditions and its influencing factors are especially significant for the rapid generation of gas hydrate.Using visual and high pressure-resisting experimental setup and graphical method,this paper investigated the phase equilibrium conditions of mine gas hydrate formed by gas samples in three different concentrations of NaCl solution.The results show that NaCl could change the phase equilibrium condition and make it more demanding.At the same temperature,the phase equilibrium pressure increases from 0.50 to 2.98 MPa than that in pure water during nine experiments.The hypothesis model of influence mechanism of NaCl on the phase equilibrium was established based on hydrated ion ionization equilibrium theory.This paper concludes that the strong electric field of Na+and Clionized from NaCl produces an interaction on water molecules.This interaction will destroy the clusters structure of water molecules that surrounds gas molecules.
mine gas hydrate;NaCl solution;phase equilibrium;water clusters
TD712
A
0253-9993(2014)12-2425-06
2013-12-13 责任编辑:张晓宁
国家自然科学基金资助项目(51334005,51274267,51104062)
张保勇(1982—),男,安徽霍邱人,副教授,博士。E-mail:zhangbaoyong2002@163.com。通讯作者:于 跃(1987—),Tel:0451-88036392,E-mail:yy_gfkhtd@163.com
张保勇,于 跃,吴 强,等.NaCl对瓦斯水合物相平衡的影响[J].煤炭学报,2014,39(12):2425-2430.
10.13225/j.cnki.jccs.2013.1845
Zhang Baoyong,Yu Yue,Wu Qiang,et al.Effect of NaCl on the phase equilibrium of mine gas hydrate[J].Journal of China Coal Society, 2014,39(12):2425-2430.doi:10.13225/j.cnki.jccs.2013.1845

