白纹伊蚊唾液腺serpin1基因的可变剪接分析与原核表达
程金芝,孙 宇,陈 璐,刘 鉴,吴家红
白纹伊蚊是一种重要的医学昆虫,吸血不仅造成宿主严重的过敏反应,而且还可以传播多种疾病。在中国,它是登革热与登革出血热的重要媒介。其唾液组分蛋白具有抗凝血、抗炎和免疫调控的功能[1]。已有的研究结果提示每一种蚊虫唾液组分中约含有100个蛋白分子参与了上述功能。根据对约10种蚊虫唾液腺转录组学分析,提示Serpin家族成员广泛分布于蚊虫唾液组分,然而至今仅有少数蛋白成员的作用得到证实。
丝氨酸蛋白酶抑制剂(Serine Protease Inhibitor,Serpin)是一类蛋白质超家族,它们不仅广泛存在于动物、植物以及病毒体内[2-3],还存在于细菌和古细菌体内[4-5]。研究发现Serpin家族成员参与调控蛋白酶介导的一系列生命进程,包括凝血、纤维蛋白溶解、补体激活、炎性介质反应及组织重建过程。Serpin是一种单蛋白质,由3个β折叠,8~9个α螺旋和一个环状结构区RCL(reactive center loop)构成。蛋白质分子量一般为40~50kDa,由350~500个氨基酸组成。大多数serpin具有抑制丝氨酸蛋白酶的功能,但也有一些能抑制其他种类的蛋白酶,例如,鳞状细胞癌抗原-1能够抑制半胱氨酸蛋白 酶[6],拟 南 芥 serpin-1能够抑制 名 为 metacaspase-9的半胱氨酸蛋白酶[7]。另外还有一些serpin缺乏蛋白酶抑制功能,而是执行一些其他功能,例如,激素转运、充当分子监控类蛋白或储存蛋白[8-9]。Serpin在功能上的不同与其结构有着密切联系。
2007年Arca等[10]率先采用分子生物学方法构建了白纹伊蚊唾液腺cDNA文库,从中识别出3条具有信号肽的丝氨酸蛋白酶抑制剂基因家族成员,但具体功能未验证,鉴于serpin家族成员功能多样性,为探讨该蛋白在蚊虫吸血与传病中的作用,本研究对Aalbserpin1基因进行了克隆和生物信息学分析,并表达获得重组蛋白,为进一步研究Aalbserpin1蛋白的功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 白纹伊蚊 白纹伊蚊广州株由中国军事医学科学院微生物流行病研究所媒介生物学与控制研究室惠赠,本室常规养殖,温度(25±2)℃,相对湿度(80±5)%,光照14h/d,羽化后喂食糖水。
1.1.2 主要试剂和仪器 TRIzol试剂和DNA酶Ⅰ试剂盒购自Invitrogen公司,逆转录试剂盒(PrimerScript RT Reagent Kit)、荧光定量PCR试剂盒(SYBR Premix Ex TaqⅡ)、pMD18-T载体、BamHⅠ和XhoⅠ限制性内切酶、Primer STARTM HS DNA Polymerase、DNA标志物DL2000购自大连TaKaRa公司,其他试剂均为国产分析纯产品。荧光定量PCR仪(7300型)为美国ABI公司产品。
1.1.3 载体和宿主菌 pET28a(+)载体,E.coliDH5α,E.coliOrigami(DE3)为本室常规保存。
1.2 方法
1.2.1 引物设计和合成 根据白纹伊蚊罗马株Serpin1基因序列(GenBank登录号为 AY826096.1),设计引物 Aalbserpin1-F1和Aalbserpin1-R,用于白纹伊蚊广州株全长基因扩增。Aalbserpin1-F和 Aalbserpin1-R,用于构建原核表达系统的基因扩增。Aalbserpin1-F2和Aalbserpin1-R2用于实时荧光定量PCR反应;rsp5F和rsp5R用于实时荧光定量PCR内参基因扩增。引物由上海英骏(Invitrogen)公司合成,引物序列见表1。
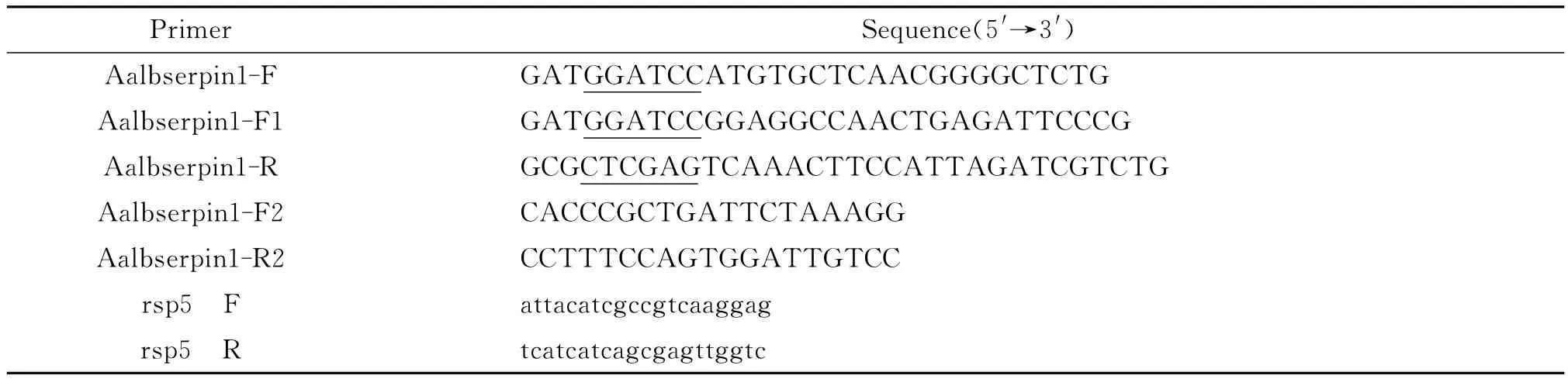
表1 引物序列Tab.1 Sequencing primers
1.2.2 RNA抽提 实验分3组,解剖5d龄未吸血雌蚊唾液腺(SG组)、中肠(MG组)和脂肪体(FB组)。将3组样品分别置于500μL TRIzol中,电动匀浆器充分匀浆并振荡混匀,加100μL氯仿旋涡振荡15s,室温放置5min,4℃12 000×g离心15min,取上层水相加入等体积异丙醇,室温静置30min,4℃12 000×g离心15min,弃上清。加冰预冷的75%乙醇1mL,充分洗涤沉淀,4℃7 500×g离心5min,弃上清,空气干燥5min,将沉淀溶于1μL水中,1.2%琼脂糖凝胶电泳和紫外分光光度计检测获得总RNA的质量和浓度。取总RNA 3μL,DNaseⅠ1μL(1U/μL),室温孵育15min,加入1μL 25mmol/L乙二胺四乙酸(EDTA),65℃孵育10min,终止反应,去除DNA后即得总RNA。
1.2.3 逆转录反应 将上述3组雌蚊的组织总RNA分别行逆转录,反应体系为:总RNA 500ng,5×PrimeScript缓冲液2μL,PrimeScript酶混合物0.5μL,寡核苷酸多聚T引物(OligodT)和随机6碱基引物(Random 6mers)各0.5 μL,加无RNA酶水(RNase Free dH2O)至总体积为20μL。反应条件:37℃30min,85℃5s。反应完成后将3组cDNA置于-20℃保存备用。
1.2.4 Aalbserpin1全长基因的克隆 以SG组的cDNA为模板。用Aalbserpin1-F1和Aalbserpin1-R引物扩增Aalbserpin1全长基因,PCR产物经胶回收后,克隆入pMD18-T载体,并对PCR鉴定阳性克隆子测序。
1.2.5 生物信息学分析 用DNAStar5.0软件对测得序列进行分析,并与GenBank上获取的其它物种序列进行同源性比较,采用ExPASy Proteomics Server(http://cn.expasy.org/tools)的相关软件分析蛋白的相对分子质量(Mr)、等电点和信号肽等。
1.2.6 重组质粒pET28a-Aalbserpin-1_2的构建与表达以pMD18-T-Aalbserpin-1_2为模板,进行 PCR 扩增、产物纯化回收。用BamHⅠ和XhoⅠ酶对目的基因和pET28a进行双酶切,回收纯化后用T4连接酶16℃连接过夜,转入E.coliDH5α感受态细胞,挑取单菌落进行菌液PCR、酶切和测序鉴定。将测序正确的重组质粒pET28a-Aalbserpin-1_2转化至E.coliOrigami(DE3)中,挑选阳性单菌落在SOC液体培养基中以IPTG诱导表达后,离心收集菌体,制备成电泳样品并行12%SDS-PAGE电泳分析。
1.2.7 重组蛋白的纯化 对阳性克隆进行大量诱导表达,离心收集菌体、超声裂解后离心收集上清并过滤,参照Ni-IDA Agarose说明书进行蛋白纯化,收集蛋白洗脱液,SDSPAGE电泳分析目的蛋白。
1.2.8 实时荧光定量PCR 取SG组、MG组和FB组cDNA进行荧光定量PCR扩增,每组6个重复。反应体系:2×SYBR Premix Ex TaqⅡ10μL,Aalbserpin1-F2和 Aalbserpin1-R2(10μmol/L)以及rsp5F和rsp5R各0.8μL,50×ROX Reference Dye 0.4μL,cDNA模板1μL,反应条件:95℃30s;95℃5s,60℃34s,共40个循环。
1.2.9 数据分析 采用绝对定量法,对各个基因所得的CT值进行计算(以rsp5为内对照[11]),对其结果进行分析,采用Grahpad Prism 3.03进行统计学分析并制图。
2 结 果
2.1 PCR扩增 PCR扩增白纹伊蚊广州株Aalb-serpin-1基因,如图1所示,在约1 300bp处获得一特异性扩增片段,大小同预期的结果相符。
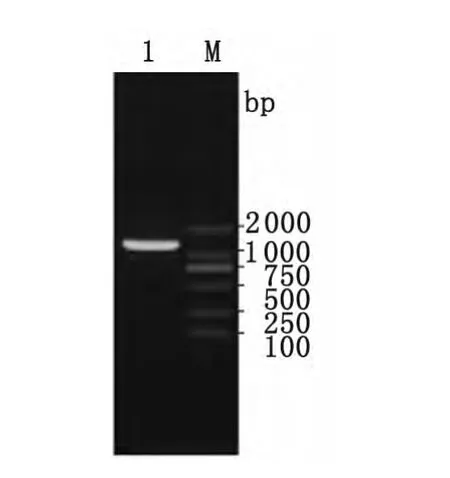
图1 白纹伊蚊Aalbserpin-1基因PCR扩增产物M:DNA 标志物;1:Aalbserpin-1基因Fig.1 PCR amplification of the Aalbserpin-1gene of Aedes albopictus
2.2 序列分析 测序结果显示,白纹伊蚊广州株Aalbserpin-1基因获得2个转录本(Alboserpin1_1和 Alboserpin1_2),Alboserpin1_1的基因序列为1 260bp,编码419氨基酸;Alboserpin1_2的基因序列为1 332bp,编码443氨基酸,后者较前者多了24个氨基酸。将2个转录本与白纹伊蚊罗马株(Gen-Bank登录号为AY826096.1)进行氨基酸序列比对分析,结果显示Alboserpin1_2多出的24个氨基酸为NLLTNRIVSQSSYRRVAIYDFISG,插入在第362位氨基酸处,如图2所示。故推测这24个氨基酸是Aalbserpin-1基因在mRNA水平的可变剪接子。

图2 Aalbserpin-1的序列比对与分析Fig.2 Sequences alignments and analysis of Aalbserpin-1
2.3 Aalbserpin-1的生物信息学分析结果 将所获得的两个转录本Aalbserpin-1进行生物信息学分析。ProtParam软件分析显示该Aalbserpin-1_1蛋白质分子量为47 506Da,等电点5.11,Aalbserpin-1_2 蛋白质分子量为50 242Da,等电点5.75。用InterProScan分析两个转录本的一级结构,结果均含有Serpin结构域,Aalbserpin-1_2的可变剪接子正好位于于其功能活性中心环(RCL)起始端。Signal P4.0信号肽分析显示,两者均具有1个信号肽序列,位于1~18位氨基酸之间。Aalbserpin-1_2在NCBI上行BLASTp分析,结果显示,与白纹伊蚊罗马株的相似性为90%,与埃及伊蚊Serpin 1氨基酸序列(GenBank登录号为XM_001656512.1)相似性为74%,与致倦库蚊Serpin1氨基酸序列(Gen-Bank登录号为 XM_001862101.1)相似性只有32%,推测这个Serpin蛋白是伊蚊所特有的。
2.4 pET28a-Aalbserpin-1_2原核重组质粒的鉴定用BamHⅠ和XhoⅠ双酶切pET28a-Aalbserpin-1_2表达载体,琼脂糖凝胶电泳结果显示,获得约1 300bp的条带,见图3。测序结果表明,pET28a-Aalbserpin-1_2表达载体构建成功。
2.5 pET28a-Aalbserpin-1_2载体诱导表达及分离纯化 将重组质粒pET28a-Aalbserpin-1_2转化到大肠杆菌 Origami(DE3)中诱导表达后,SDS-PAGE电泳结果显示,在Mr 50 000Da处有明显表达条带,见图4(泳道4,5,6),与目的蛋白预期相对分子质量基本相符,通过亲和层析获得纯化蛋白,见图4(泳道7)。
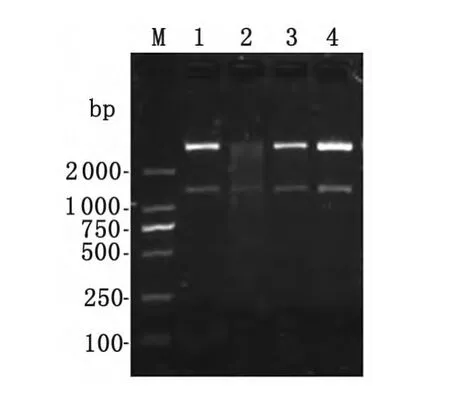
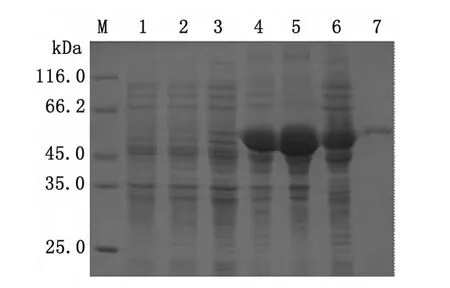
图4 重组Aalbserpin-1_2质粒的表达及纯化产物SDSPAGE电泳分析M:蛋白标志物,1:未诱导pET-28a(+),2:诱导pET-28a(+),3:pET-28a(+)-Aalbserpin-1_2未诱导,4:pET-28a(+)-Aalbserpin-1_2诱导,5:pET-28a(+)-Aalbserpin-1_2诱导上清,6:pET-28a(+)-Aalbserpin-1_2诱导沉淀,7:pET-28a(+)-Aalbserpin-1_2纯化产物Fig.4 SDS-PAGE analysis of the recombinant Aalbserpin-1_2 expression product and purified productM:Protein molecular Marker;1:BL21cell containing pET-28a(+)without IPTG induction;2:BL21cell containing pET-28a(+)with IPTG induction;3:BL21cell containing pET-28a(+)-Aalbserpin-1_2without IPTG induction;4:BL21cell containing pET-28a(+)-Aalbserpin-1_2with IPTG induction;5:supernatants of lysate of BL21cell containing pET-28a(+)-Aalbserpin-1_2with IPTG induction;6:sediments of lysate of BL21cell containing pET-28a(+)-Aalbserpin-1_2with IPTG induction;7:the purified product of pET-28a(+)-Aalbserpin-1_2recombinant.
2.6 不同组织Aalbserpin-1基因表达差异 实时荧光定量PCR检测Aalbserpin-1_2基因在唾液腺(SG)、中肠(MG)、脂肪体(FB)中的表达差异。将结果进行统计学分析并绘制成图,如图5所示,对有可变剪接的Aalbserpin-1_2基因的检测发现,Aalbserpin-1_2在唾液腺(SG)、中肠(MG,P>0.05)丰富表达,脂肪体低表达(FB,P<0.05)。
3 讨 论
昆虫是地球上出现最早、种类最多的动物群体,在长期的进化过程中形成了独特的先天性免疫防御体系。由于昆虫体内没有高等动物所具有的淋巴细胞和免疫球蛋白,因此,分解异物的酶,特别是蛋白酶及调控昆虫体内蛋白酶作用的蛋白酶抑制剂便引起了人们的高度关注。在昆虫体内,serpin参与生命过程中许多重要的环节,如Kanost等从烟草天蛾幼虫血液中纯化了四种丝氨酸蛋白酶抑制剂,其中一种对猪胰肽酶和牛胰凝乳蛋白酶有抑制作用,两种对胰凝乳蛋白酶有特异性的抑制作用,另外一种对胰蛋白酶的活性有特异的抑制作用[12-13]。黑腹果蝇serpin27A、28D,烟草天蛾serpin3、冈比亚按蚊serpin2与黑化反应有关。黑化反应是节肢动物防御系统中的一个重要组成部分,而在这个系统中,丝氨酸蛋白酶介导的级联反应是PPO被激活是关键环节[14]。除了调控PPO的级联激活外,有研究还发现,果蝇属的serpin43Ac与Toll介导的先天性免疫反应有关[15]。此外,有研究显示serpin在媒介与病原相互关系中也扮演重要作用。如按蚊属的serpin10在中肠上皮细胞累积,与疟原虫的传播有关[16]。斯氏按蚊和冈比亚按蚊的serpin6与清除其体内的病原有着明显的关系[17]。
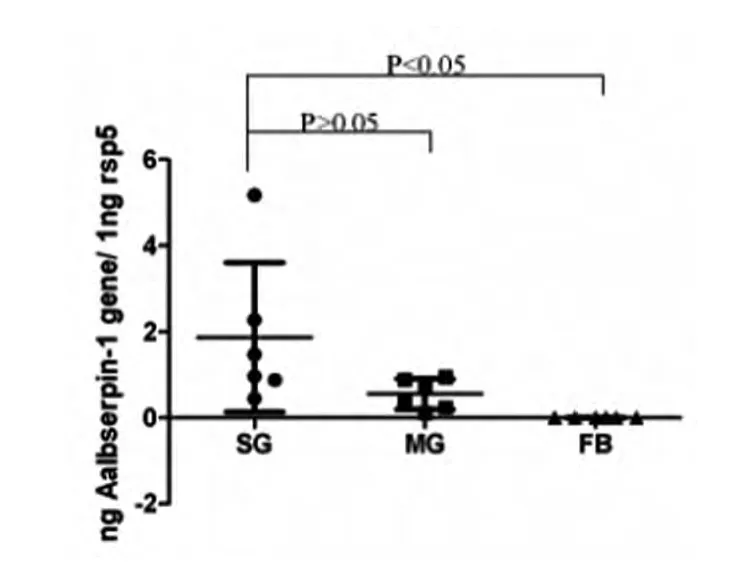
图5 Aalbserpin-1_2基因不同组织表达差异(n=6)Fig.5 Aalbserpin-1_2gene expression in different tissues(n=6)
本研究以白纹伊蚊罗马株Aalbserpin-1序列信息设计引物,从白纹伊蚊广州株唾液腺中成功获得该序列。测序显示有两个转录本,同源比对分析Aalbserpin-1_1与罗马株 Aalbserpin-1序列相似性为95%,而Aalbserpin-1_2与两者相比多出了24个氨基酸(NLLTNRIVSQSSYRRVAIYDFISG),故考虑其为可变剪接子。可变剪接是指从1个mRNA前体中通过不同的剪接方式(选择不同的剪接位点组合)产生不同的mRNA剪接异构体的过程,使机体调节基因表达和产生蛋白质组多样性的重要机制[18]。为深入研究 Aalbserpin-1_2基因,成功构建了Aalbserpin-1_2原核表达载体,经IPTG诱导表达,采用镍柱纯化体系对融合蛋白进行了纯化,行SDS-PAGE分析,纯化蛋白分子量大小与预测的相符,为Aalbserpin-1_2蛋白质功能的研究奠定了基础。
已有的研究显示唾液腺是蚊虫传播病原生物的器官,中肠是蚊虫中病原增殖的器官,脂肪体是蚊虫的免疫器官,这3个组织在蚊虫传病中发挥了重要的作用,因此选择这三个组织采用实时荧光定量PCR技术,在对可变剪接子处设计特异性引物,进行了不同组织表达谱的分析。结果显示,唾液腺的表达量与中肠表达量之间的差异不具有统计学意义,与脂肪体的表达量之间的差异具有统计学意义,说明Aalbserpin-1_2在唾液腺与中肠中均有表达,这个结果却与前期研究的不同组织表达谱中显示的在唾液腺中特异性高表达[19]的结果存在差异,推测Aalbserpin-1_1可能优先在白纹伊蚊唾液腺内表达,因此可变剪接是否会对蛋白功能产生影响需进一步研究。
[1]Wu JH.Antihemostatic activity and immune modulation of mosquito saliva[J].Chin J Vector Biol Ctrl,2008,19(5):481-483.(in Chinese)吴家红.蚊虫唾液组分的抗凝血活性及其对宿主的免疫调控作用[J].中国媒介生物学及控制杂志,2008,19(5):481-483.
[2]Suminami Y,Nawata S,Kato H.Biological role of SCC antigen[J].Tumour Biol,1998,6(19):488-493.DOI:10.1159/000030042
[3]Vercammen D,Belenghi B,van de Cotte B,et al.Serpine1ofArabidopsis thalianais a suicide inhibitor for metal caspase 9[J].Mol Biol,2006,4(364):625-636.DOI:10.1016/j.jmb2006.09.010
[4]Dafforn TR,Della M,Miller AD.The molecular interactions of heat shock protein 47(Hsp47)and their implications for collagen biosynthesis[J].Biol Chem,2001,52(276):49310-49319.DOI:10.1074/jbc.M108896200
[5]Huntington JA,Stein PE.Structure and properties of ovalbumin[J].J Chromatogr B Biomed Sci Appl,2001,1(756):189-198.DOI:10.1016/S0378-4347(01)00108-6
[6]Gettins PGW.Serpin structure,mechanism,and function[J].Chem Rev,2002,12(102):4751-4803.DOI:10.1021/cr010170+
[7]Irving JA,Pike RN,Lesk AM,et al.Phylogeny of the serpin superfamily:implications of patterns of amino acid conservation for structure and function[J].Genome Res,2000,12(10):1845-1864.DOI:10.1101/gr.147800
[8]Cabrita LD,Irving JA,Pearce MC,et al.Aeropin from the extremophile Pyrobaculum aerophilum bypasses the serpin misfolding trap[J].Biol Chem,2007,37(282):26802-26809.DOI:10.1074/jbc.M705020200
[9]Kang S,Barak Y,Lamed R,et al.The functional repertoire of prokaryote cellulosomes includes the serpin superfamily of serine proteinase inhibitors[J].Mol Microbiol,2006,6(60):1344-1354.DOI:10.1111/j.1365-2958.2006.05182.x
[10]Arca B,Lombardo F,Francischetti IM,et al.An insight into the sialome of the adult female mosquitoAedes albopictus[J].Insect Biochem Mol Biol,2007,37(2):107-127.DOI:10.1016/j.ibmb.2006.10.007
[11]Wu JH,Cheng JZ,Sun Y,et al.Selection of control genes in Real-time qPCR analysis of gene expression inAedes albopictus[J].Chin J Zoonoses,2011,27(5):432-435.(in Chinese)吴家红,程金芝,孙宇,等.白纹伊蚊基因表达定量PCR内参基因的选择[J].中国人兽共患病学报,2011,27(5):432-435.
[12]Jiang H,Kanost MR.Characterization and functional analysis of 12naturally occurring reactive site variants of serpin-1fromManduca sexta[J].J Biol Chem,1997,2(272):1082-1087.DOI:10.1074/jbc.272.2.1082
[13]Tong Y,Kanost MR.Manduca sexta serpin-4and serpin-5inhibit the prophenoloxidase activation pathway:a cDNA cloning,protein expression,and characterization[J].J Biol Chem,2005,15(280):14923-14931.DOI:10.1074/jbc.M500531200
[14]Scherfer C,Lemaitre B.Drosophila Serpin-28Dregulates hemolymph phenoloxidase activity and adult pigmentation[J].Developmental Biol,2008,323:189-196.DOI:10.1016/j.ydbio.2008.08.030
[15]Garrett M,Fullaondo A.Identification and analysis of serpinfamily gene by homology and synteny across the 12sequenced Drosophilid genomes[J].Genomics,2009,2(10):489-501.DOI:10.1186/1471-2164-10-489
[16]Danielli A,Kafatos FC.Cloning and characterization of four A-nopheles gambiae serpin Isoforms,differentially induced in the midgut by Plasmodium berghei invasion[J].Biol Chem,2003,6(278):4184-4193.DOI:10.1074/jbc.M208187200
[17]Abraham EG,Pnto SB,Ghosh A,et al.An immune-responsive serpin,SRPN6,mediates mosquito defense against malaria parasites[J].PNAS,2005,45(102):16327-16332.DOI:10.1073/pnas.0508335102
[18]Zhang TJ.Review of bioinformatics data analysis in alternative splicing[J].China J Bioinformatics,2012,10(1):61-64.(in Chinese)章天骄.可变剪接的生物信息数据分析综述[J].生物信息学,2012,10(1):61-64.DOI:10.3969/j.issn.1672-5565.2012.01.13
[19]Wu JH,Cheng JZ,Chen L,et al.Expression of the genes of Adenosine Deamianse,C-lectin an Serpin in the salivary gland ofAedes albopictus[J].Chin J Parasitol Parasit Dis,2010,28(3):190-193.(in Chinese)吴家红,程金芝,陈璐,等.腺苷脱氨酶、C型凝集素及丝氨酸蛋白酶抑制剂基因在白纹伊蚊唾液腺中的表达[J].中国寄生虫学与寄生虫病杂志,2010,28(3):190-193.

