小麦淀粉合成酶基因实时荧光定量PCR检测方法的建立及其应用
谭彩霞,封超年,郭文善,朱新开,李春燕,彭永欣
(1.金陵科技学院,江苏 南京 210038;2.扬州大学农学院,江苏 扬州 225009)
小麦淀粉合成酶基因实时荧光定量PCR检测方法的建立及其应用
谭彩霞1,封超年2,郭文善2,朱新开2,李春燕2,彭永欣2
(1.金陵科技学院,江苏 南京 210038;2.扬州大学农学院,江苏 扬州 225009)
利用荧光定量PCR技术,对小麦淀粉合成酶基因(AGPase 1、GBSSI、SSSIII、SBEI)进行了定量检测,分别建立了这4种淀粉合成酶基因和内参基因18s的Ct值与模板量之间的标准曲线和线性回归方程。运用所建立的方法对小麦籽粒4种淀粉合成酶基因在灌浆期间的表达变化情况进行了定量分析。
小麦;淀粉合成酶基因;荧光定量PCR
小麦籽粒中淀粉约占粒重的65%~80%,其含量多少直接关系到粒重与产量的高低[1]。籽粒中淀粉主要是由一系列淀粉合成酶催化而成的,这些酶主要包括ADP-葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase polypetide,AGPase)、可溶性淀粉合成酶(soluble starch synthase,SSS)、颗粒结合型淀粉合成酶(granule-bound starch synthase,GBSS)、淀粉分支酶(starch branchingenzyme,SBE)[2]。淀粉合成酶又是由相应的编码基因先转录成m RNA,然后再经过翻译而成的。与淀粉合成相关的关键酶基因主要有4种,即腺苷二磷酸葡萄糖焦磷酸化酶基因(AGPase)、束缚态淀粉合成酶基因(GBSSI)、可溶性淀粉合成酶基因(SSS)、淀粉分支酶基因(SBE)。每一种酶基因含有多种同工酶基因,如AGPase基因含有大、小亚基2种基因;GBSS基因在不同组织中含有GBSSI和GBSSII两种基因;SSS的同工酶基因则可分为三大类:SSSI、SSSII和SSSIII;SBE基因主要分为两大类:SBE(A)和SBE(B)。这些同工酶基因在小麦中已基本被定位和克隆出来[3],为研究淀粉合成酶基因在小麦整个灌浆期间的表达变化规律、不同小麦品种之间淀粉合成酶基因表达差异以及不同栽培措施对小麦淀粉合成酶基因表达的影响创造了有利的条件。本试验以AGPase 1、GBSSI、SSSIII以及SBEI这4种淀粉合成酶基因为研究对象,建立了实时荧光定量PCR检测方法,并以此方法检测淀粉合成酶基因在小麦籽粒灌浆过程中的表达变化规律,旨在为淀粉合成酶基因定量检测提供一种快速、准确的方法。
1 材料与方法
1.1 试验材料
供试品种为淮麦18,氮肥运筹比例设基肥∶壮蘖肥∶拔节肥为5∶1∶4。基肥于播种前施用,壮蘖肥于越冬期施用,拔节肥于叶龄余数1.5时施用,磷(P2O5)、钾(K2O)肥施用量90 kg·hm-2,磷、钾肥运筹为基肥和拔节肥各占50%。人工条播,行距为30 cm,小区面积为3 m×4 m=12 m2,重复3次,随机区组排列。
1.2 主要试剂和仪器
Trizol Reagent、DNase I购自Invitrogen公司,逆转录试剂盒、实时荧光定量PCR试剂购自Ta KaRa公司,引物由上海生工技术公司合成,其它化学试剂为分析纯。主要仪器为Rotor-Genem7000荧光定量PCR仪,Eppendorf超低温离心机,以及紫外/可见分光光度计等。
1.3 引物的设计与合成
利用premier 5.0引物设计软件,根据美国国立生物技术信息中心(NCBI)公布的AGPase1、GBSSI、SSSIII、SBEI m RNA基因序列,设计特异性引物(其引物序列见表1)。引物由上海生物工程有限公司合成。
1.4 籽粒胚乳总RNA的提取
小麦开花期用记号笔标记同一天开花的麦穗中上部颖花,花后每5 d每个小区取10个麦穗,剥取籽粒,在液氮中速冻30 min后,迅速转移到-70℃超低温冰箱中。采用冷酚法提取小麦籽粒胚乳总RNA[4]。采用DNA酶去除RNA中的DNA分子,以防止DNA污染。
1.5 籽粒胚乳总RNA的定量
测定260、280 nm处的吸光值,计算A260/A280的值,估算总RNA的纯度,通过A260的值分别对不同生育期的总RNA进行定量。
1.6 cDNA的合成
取各样本RNA 2μg按PrimeScript TMRT Reagent Kit试剂盒(TaKaRa公司日本)操作方法:在一个经DEPC处理过的离心管中加入总RNA 2μL,Mix×I 1μL,oligd T 1μL,Ramdom 6 mers 1μL,加DEPC处理的灭菌水至20μL。混合后37℃反转录反应20 min,85℃10 seconds对消除转录酶的活性,反转录后的cDNA贮存于-70℃冰箱。
1.7 标准曲线的制定与结果计算
1.7.1 标准曲线的制作 在样品扩增的同时,以试验中不同处理的cDNA模板混合样进行系列稀释制作标准曲线。在本试验中把不同生育时期的cDNA模板混合按10的倍数进行稀释。以AGPase1、GBSSI、SSSIII、SBEI的特异引物和18 s的内参引物进行扩增来获得标准曲线,纵坐标为临界循环值Ct,横坐标为稀释浓度的对数值(Log值)。
1.7.2 定量分析 在Microsoft Excel软件上对PCR中给出的Ct值进行统计分析。以18s为对照基因,校正PCR模板的拷贝数。相对量采用方法计算,即ΔCt目标基因=Ct(目标基因)-Ct(同一样本18s);而相对倍数(relative quantification(目标基因)。

表1 用于分析目标基因表达的引物序列Table 1 Primer sequence of the target genes for analyzing expression levels
2 结果与分析
2.1 RNA纯度和完整性分析
所提取的总RNA经紫外分光光度计检测,A260/280比值均在1.9~2.1之间,经1%甲醛变性凝胶检测鉴定,28s r RNA和18s r RNA条带清晰可见,无明显降解(图1)。
2.2 淀粉合成酶基因和对照基因的标准曲线
淀粉合成酶基因表达量是相对于18s参照物的量而言的。经过稀释的浓度系列的cDNA标准模板与阈值(Ct值)的关系曲线见图2。AGPase 1、GBSSI、SSSIII、SBEI和18s标准曲线的斜率分别为-3.156、-3.667、-3.595、-3.745、-3.305,线性相关系数分别为0.998 9、0.998 4、0.999 1、0.999 9、0.999 5,标准曲线的相关系数均大于0.98,说明扩增效率较好,可用于准确定量。
2.3 检测基因表达的特异性
由图3可知,在荧光强度发生变化的拐点处(熔点,Tm=85℃)可以清楚地看到一个单一的峰,其余的地方没有杂峰。表明扩增的产物为目的产物且特异性非常好,试验中未出现引物二聚体和污染现象。
2.4 检测基因表达的重复性
本试验每个浓度的试验样本采用4个重复,重复样本间Ct值的差异在0.13~0.20范围内。图4表明,曲线的重复效果、稳定性很好。在扩增前期,特别是在threshold(荧光临界值)附近,相同样品的曲线基本上是重叠的。扩增后期曲线略有分散,但符合S型,不影响定量。
2.5 小麦灌浆期间籽粒淀粉合成酶基因表达变化动态
由图5可知,4种淀粉合成酶基因表达在小麦整个灌浆期间呈单峰曲线变化趋势,花后5 d左右开始表达,5~15 d相对表达量呈线性上升趋势,至花后15 d达最大值,之后急剧下降,30 d达最低值。

图1 总RNA完整性检测Fig.1 Testing of the total RNA integrity
3 结论与讨论

图2 4种淀粉合成酶基因及18s的标准曲线Fig.2 The standard curves of the four starch synthase genes and 18s
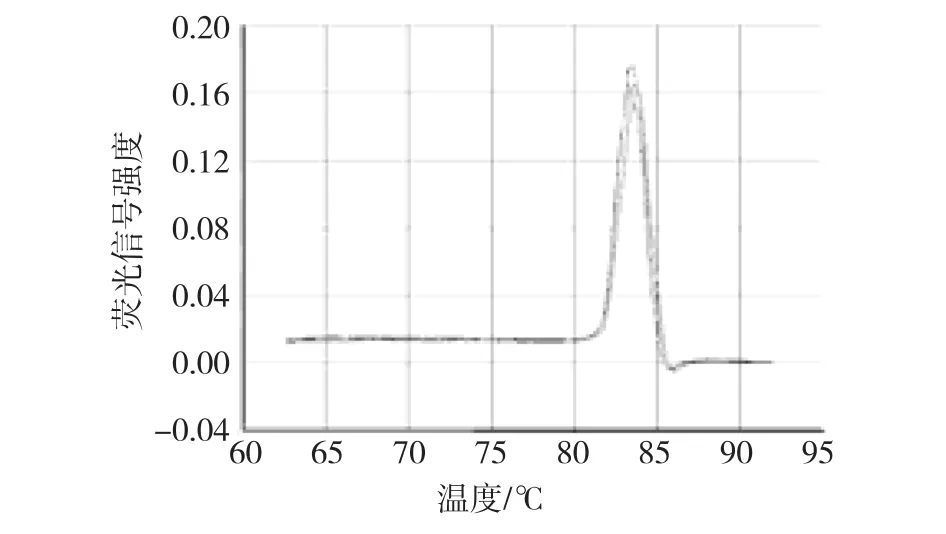
图3 4种淀粉合成酶基因及18s的溶解曲线Fig.3 The melt curves and Amp/Cycele curves of the four starch synthase genes and 18s

图4 4种淀粉合成酶基因及18s的荧光曲线Fig.4 The cycele curves of the four starch synthase genes and 18s
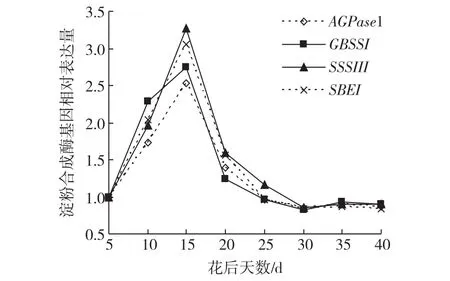
图5 淮麦18淀粉合成酶基因在灌浆期间的表达情况Fig.5 The expression of starch synthase gene after anthesis in wheat Huaimai 18
在植物基因表达分析中,常常用到的是RT-PCR、Northern blot、基因芯片等半定量技术,基因表达量较低时往往难以得到理想的结果,而实时荧光定量PCR能检测到每一轮的荧光信号的强度并且自动记录到电脑软件中[5]。实时荧光定量PCR技术从原理上主要分为两类:一是荧光染料嵌合法;二是荧光探针法。探针类是利用与靶序列特异杂交的探针来指示扩增产物的增加,其特异性强,但其定量时容易受酶活性的影响、探针成本较高等使其无法普及应用;目前比较常用的有染料类如SYBR GreenⅠ则是利用与双链DNA小沟结合发光的理化特征指示扩增产物的增加[5]。其简单易行,成本较低,只需合成序列特异引物,可用于不同的模板,但是对扩增的特异性要求高,可通过摸索优化反应条件,建立标准曲线,用融解曲线和凝胶电泳证实等可以解决此方法的不足[6]。本试验中用到的就是SYBR Green荧光嵌合法。
在荧光定量PCR技术中,有一个很重要的概念—Ct值。C代表Cycle,t代表threshold,Ct值的含义是:每个反应管内的荧光信号到达设定的域值时所经历的循环数。每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,Ct值越小。通常采用已知不同浓度的标准品所产生的Ct值建立标准曲线,最后将样品的Ct值代入标准曲线方程求出待测样品的浓度[7]。本试验中4种淀粉合成酶基因和18s的标准曲线斜率较大且相关系数均在0.99以上,是比较理想的标线,可用于对起始模板量的计算。
对于模板量的定量方法分2种:即绝对定量和相对定量。绝对定量指用已知的标准曲线来推算未知的样本量,但其标准品的稳定保存很难获得成功[8]。而相对定量是分别测定目的基因和参比基因的量,再求出参比基因和目的基因相对量。本试验中所使用的方法就是相对定量PCR,用来检测m RNA表达量简单方便[5]。
SYBR GreenⅠ染料是一种DNA结合染料,它的最大优点就是能与所有的双链DNA结合,所以一旦反应体系中出现非特异扩增,那它就会影响到定量结果的可靠性与重复性[9]。本试验从循环条件,引物浓度和退火温度3个方面对实时荧光定量PCR条件进行了优化,成功地建立起检测淀粉合成酶基因的实时荧光定量PCR方法,从小麦籽粒中扩增到4种淀粉合成酶基因和18s基因扩增曲线Ct值有很好的线性关系,呈明显的S型,而且在平台期几乎重合,说明获得的扩增曲线合理;溶解曲线分析显示出,PCR产物在拐点处(熔点,Tm=85℃)有单一的特异峰,峰的形状也较锐利,没有引物二聚体及非特异扩增产物,说明设计的引物有良好的特异性。评价标准曲线的优劣有两个指标:即相关系数和斜率,相关系数反映标准曲线的直线性,理想值应大于0.98,越接近1,说明直线性越好,定量越准确[10],本试验的标准曲线的相关系数均在0.99~1之间,表明试验的结果可信度高,误差小。
利用建立的SYBR Green实时荧光检测方法定量检测4种淀粉合成酶基因在小麦籽粒灌浆期间的表达情况,发现4种淀粉合成酶基因表达均呈单峰曲线变化趋势,花后5 d左右开始表达,15 d达到最大值,之后急剧下降,此结论与前人研究结果(如Anderson等[11]认为AGPase基因mRNA量在开花后15 d达到最高水平,此后表达迅速下降;KENT F等[12]研究表明,GBSS和SSS基因在花后5 d开始表达,15 d达到最大值,之后表达骤降。)基本一致。
[1]郭天财,岳艳军,查菲娜,等.2种穗型冬小麦灌浆期籽粒糖含量及淀粉积累的动态变化[J].河南农业科学,2006(4):17 -20
[2]王自布,银永安,曹连莆,等.淀粉含量不同的两类小麦品种籽粒淀粉积累及关键酶活性的变化[J].麦类作物学报,2010, 30(2):259-265
[3]谭彩霞,封超年,陈静,等.作物淀粉合成关键酶及其基因表达的研究进展[J].麦类作物学报,2008,28(5):912-919
[4]郑霏琴,王宗阳,高继平.水稻籽粒胚乳总RNA的提取[J].植物生理学通讯,1993,29(6):438-440
[5]代晓燕,苏以荣,魏文学,等.烟草Nt-syr1基因实时荧光定量PCR检测方法[J].中国烟草科学,2008,29(3):20-24,28
[6]徐楠楠,胡桂学.实时荧光定量PCR技术的研究进展及应用[J].专论与综述,2011(11):24-26
[7]尹兵.实时荧光定量PCR的原理及应用研究进展[J].科技信息,2010(17):30,59
[8]赵焕英,包金风.实时荧光定量PCR技术的原理及其应用研究进展[J].中国组织化学与细胞化学杂志,2007,16(4):492 -497
[9]CHRIS H,PHILIPPA L,SEVERINE T,et al.Melting Curve Analysis of Feline Calicivirus Isolates Detected by Realtime Reverse Transcription PCR[J].Journal of Virological Methods,2002,106:241-244
[10]侯林,姜丽娟,孙文静.中国卤虫actin基因的实时荧光定量PCR方法的建立和优化[J].辽宁师范大学学报:自然科学版,2006,29(4):466-469
[11]Anderson J M,R Larson,D Landencia,et al.Molecular Characterization of the Gene Encoding a Rice Endosperm-specific ADP-glucose Pyrophosphorylase Subunit and its Developmental Pattern of Transcription[J].Gene,1991,97:199-205
[12]KENT F,McCUE.Starch-branching Enzymes sbe 1 and sbe 2 from Wheat(Triticum aestivum cv.Cheyenne):Molecular Characterization,Developmental Expression,and Homoeologue Assignment by Differential PCR[J].Plant Molecular Biology Reporter,1999,20:191a-191m
(责任编辑:谭彩霞)
The Establishment and Application of a Real-time Quantitative PCR Assay for Detection of Wheat Starch Dynthase Genes
TAN Cai-xia1,FENG Chao-nian2,GUO Wen-shan2,ZHU Xin-kai2,LI Chun-yan2,PENG Yong-xin2
(1.Jinling Institute of Technology,Nanjing 210038,china;2.Yangzhou University,Yangzhou 225009,China)
Starch synthase genes(AGPase 1、GBSSI、SSSIII、SBEI)in wheat grains is quantitatively detected by rea1-time fluorescent quantitative PCR.The four starch synthase genes and endogenous gene(18s)are amplified respectively.The standard curve of Ct value amplified by the AGPase 1、GBSSI、SSSIII、SBEI genes or 18s gene vs amounts of the DNA template is generated and a linear regression equation is obtained consequently.The expressions of AGPase 1、GBSSI、SSSIII、SBEI during the wheat grouting are quantitively analyzed by the established method.
wheat;starch synthase genes;real-time quantitative PCR
S512.1
A
1672-755X(2014)03-0048-05
2014-05-11
国家自然科学基金资助项目(31071340);江苏省“六大人才高峰”项目(07-G-008);江苏高校省级重点实验室开放课题(K10006)
谭彩霞(1977-),女,江苏泰兴人,副教授,博士,主要从事作物栽培与生理学研究。

