四氟硼酸四乙基铵对超级电容电池性能的影响
汪红梅,刘胜奇,刘素琴,刘建生,李永坤
四氟硼酸四乙基铵对超级电容电池性能的影响
汪红梅1,2,刘胜奇1,刘素琴1,刘建生3,李永坤3
(1. 中南大学化学化工学院,长沙 410083;2. 长沙理工大学化学与生物工程学院,长沙 410014;3. 广州天赐高新材料股份有限公司,广州 510760)
研究了四氟硼酸四乙基铵(Et4,NBF4)添加到LiPF6基电解液(碳酸乙烯酯(EC)+碳酸二甲酯(DMC)+碳酸甲乙酯(EMC)(质量比为1∶1∶1)对(LiMn2O4+活性炭(AC))/Li4Ti5O12超级电容电池电化学性能的影响.线性扫描(LSV)、循环伏安(CV)及电池充放电等测试结果表明:Et4NBF4盐改变了复合电解液中离子对的结构,提高了复合电解液的高电压稳定性和电导率.在实验条件下,随着复合盐电解液中Et4NBF4含量的增加,电池放电容量也增加,含有Et4NBF4与LiPF6物质的量的比为4∶1的电解液的电池电化学性能最好,在4C倍率下循环5,000周后,容量还有86.8,mA·h,保持率为95.8%.
四氟硼酸四乙基铵;复合盐;超级电容电池;(LiMn2O4+AC)/Li4Ti5O12
超级电容电池综合了超级电容器高功率密度和锂离子电池的高能量密度的优点,具有超长的循环寿命,从一出现就受到了学术界的普遍关注.然而,人们对于此新型能源器件的研究主要集中在电极材料的选择和复合方式上[1-5],很少研究应用于此体系的电解液,一般直接引用锂离子电池LiPF6电解液[2-4]或者锂盐溶于双电层电容器用的溶剂而组成的电解液[1,5]. 在超级电容电池中,双电层电容与锂离子电池采取内结合的方式,由于受单一锂盐溶解度的影响,电解液中自由移动离子数目受限制,使得此器件的双电层电容部分的容量得不到较好的发挥,致使整体的能量密度低,难以达到实际应用的要求[4].使用传统锂盐也会产生一些副产物,如HF、LiF、POF3,在经历一定循环后,它们会破坏电极结构,导致电池性能急剧下降[6-7].因此,急需寻找与超级电容电池匹配的电解液来提高电池性能[8-9].
四氟硼酸四乙基铵(Et4,NBF4)因具有较高的电导率以及良好的热稳定性和耐高压性能,已被广泛应用于超级电容器[10].最近也有报道将其用于非水溶剂的锂离子电池作为添加剂[11].Et4,NBF4比LiPF6溶解性好,能为双电层电容器提供更多的自由电荷,还能在电极表面形成比较稳定且性能优良的固液界面(SEI)膜,保护电极不被电解液腐蚀,防止正极材料中金属离子的溶出[12-14],且含Et4,NBF4电解液体系下的电荷存储密度和有效表面利用率更高,电容性能更优[15].
考虑到电解液中需要锂盐满足电池中锂离子电池部分的储能需要,笔者添加Et4,NBF4盐到LiPF6基混合溶剂电解液中,探讨了Et4,NBF4盐不同添加量对超级电容电池(LiMn2O4+活性炭(AC))/ Li4Ti5O12电化学性能的影响.
1 实 验
1.1 电解液制备
实验用电解质盐分别为电池级LiPF6(Kantodenka Company Limited,Japan)和Et4,NBF4(Stella Chemifa Corporation Osaka,Japan),溶剂为电池级碳酸乙烯酯(ethylene carbonate,EC)、碳酸二甲酯(dimethyl carbonate,DMC)和碳酸甲乙酯(ethyl (methyl) carbonate,EMC).溶剂均采用精馏结合分子筛吸附的方法提纯至纯度99.95%(质量分数).采用气相色谱仪分析(GC-14C,Shimadzu).电解液的配制及电池的装配均在充满高纯氩气的手套箱中进行. 共配制6种电解液,溶剂均为EC+DMC+ EMC(质量比为l∶1∶1),其中4种混合盐中的LiPF6浓度均为0.2,mol/L,分别加入0.2,mol/L、0.4,mol/L、0.6,mol/L和0.8,mol/L的Et4NBF4;另外2种分别为1,mol/L纯的LiPF6和Et4NBF4.电解液水含量与酸含量分别经过梅特勒-托利多卡尔费休(Karl Fisher)水分测定仪(DL32)与卡尔费休电位滴定仪(798,GPT Titrino)的测定,含量均在20×10-6以下.1.2 电化学性能测试
电解液的电导率采用电导率测定仪(DDS-307A,上海精科),温度范围为0~55,℃,恒温控制采用高低温实验控制箱(GDW-110,L,江苏无锡).
线性扫描(LSV)采用Pt为工作电极,锂片为对电极和参比电极,从开路电压到6,V,扫描速度为1,mV/s.循环伏安(CV)测试是在以(LiMn2O4+ AC)(2.8~4.8,V)或Li4Ti5O12(0.8~2.8,V)为工作电极,锂片用作对电极和参比电极的三电极体系下进行的.依次以0.1,mV/s和0.5,mV/s 2个扫描速度测试.仪器均采用电化学工作站(CHI650B,上海辰华).
采用LiMn2O4和AC的复合正极(LiMn2O4、AC、SP导电剂和PVDF黏结剂的质量比为20∶60∶10∶10)以及Li4Ti5O12负极(Li4Ti5O12、SP导电剂和PVDF黏结剂的质量比为80∶10∶10),组装成063048型号的方形电池,电解液用量为3.2,g.采用电池程控测试仪(BS-9300R,广州擎天),在室温下对(LiMn2O4+AC)/Li4Ti5O12以4C倍率的恒流充电至2.8,V,恒流放电至0.8,V,循环5,000周.
2 结果与讨论
2.1 电解液的电导率
电解液的离子电导率是影响电池和电容器应用性能的重要指标之一.图1为添加不同浓度的Et4NBF4盐到LiPF6基电解液中电导率随温度的变化曲线.由图1可知,电解液的电导率随温度的升高而增加;同一温度下,含有2种混合盐(LiPF6和Et4NBF4)的电解液体系,随着Et4NBF4盐浓度增加其电导率增大,这主要归功于单位体积自由移动的离子数目增加;对于总盐浓度相同(1,mol/L)的3种电解液,(0.2,mol/L,LiPF6+0.8,mol/L Et4NBF4)电解液的电导率大于纯LiPF6盐电解液,原因是Et4NBF4盐的溶解性优于LiPF6盐,添加Et4NBF4改变了LiPF6基溶液中离子对的结构,使混合电解液中溶剂分离离子对增加[16],自由移动的离子数目增加,从而提高电解液的电导率.但当温度低于15,℃时,纯Et4NBF4的电解液的电导率低于混合盐的电解液,推测是低温时,在此混合溶剂体系中,Et4NBF4比LiPF6的溶解度低,且体系黏度高等原因导致的.

图1 不同电解液的电导率随温度的变化曲线Fig.1 Ion conductivity of electrolyte at different temperatures
2.2 电解液的电化学稳定性
图2为Pt电极分别在浓度为1,mol/L 3种电解液(LiPF6、Et4NBF4、LiPF6+Et4NBF4)中的线性扫描(linear sweep voltammetry,LSV)曲线.当电位从开路电压正向扫描时,含LiPF6基电解液直到4.4,V时氧化电流才开始增大.然而,含混合盐的电解液直到5.1,V才开始发生氧化反应. 推测原因是添加Et4NBF4盐改变了电解液离子对的相互作用和存在状态,使其自由移动的离子或离子对耐高压性增加.
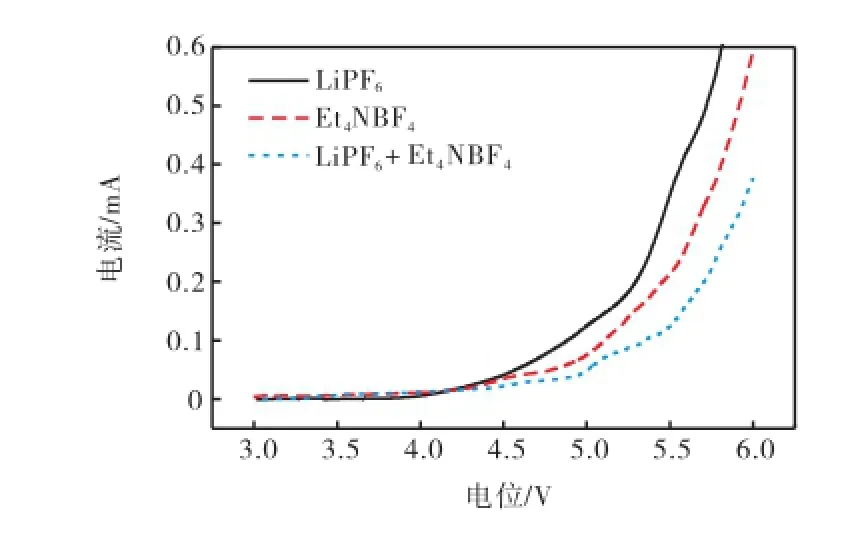
图2 扫描速度为1 mV/s时不同电解液的线性扫描曲线Fig.2 LSV curves of different electrolytes at the scan rate of 1,mV/s
以上实验表明:添加Et4NBF4盐能提高纯LiPF6锂盐电解液的耐高压性,增强电解液的电化学稳定性.
2.3 (LiMn2O4+AC)/Li4Ti5O12电池循环性能
图3为063048型(LiMn2O4+AC)/Li4Ti5O12电池在室温下使用4种不同浓度的混合电解液在4C倍率下恒流循环的稳定性.在相同0.2,mol/L,LiPF6基电解液中,随着电解液中Et4NBF4浓度的增加,电池放电容量也增加,其循环稳定性也增强.含0.8,mol/L Et4NBF4的电池循环稳定性最好,循环5,000周后,容量还有86.8,mA·h,保持率为95.8%;而含0.2,mol/L Et4NBF4的电池容量保持率只有57%.
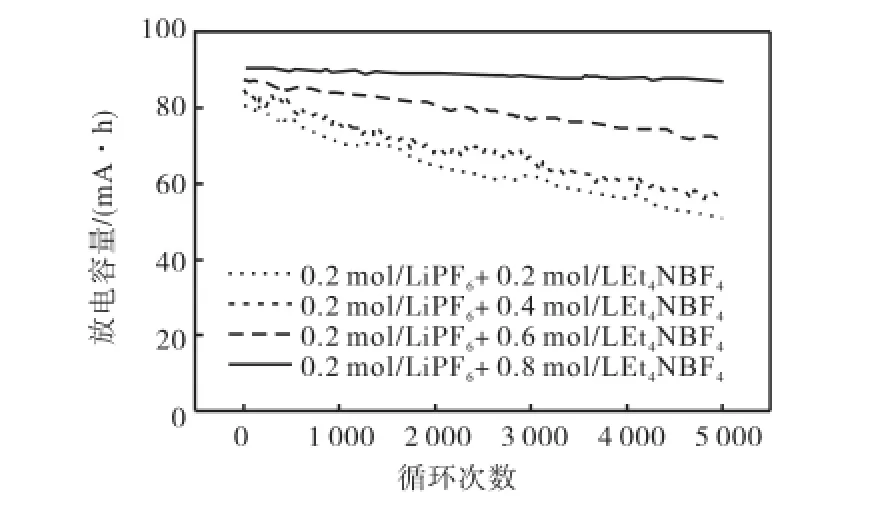
图3 超级电容电池(LiMn2O4+AC)/Li4Ti5O12在4C倍率下的恒流循环稳定性Fig.3 Galvanostatic cyclic stability of super-capacitor battery(LiMn2O4+AC)/Li4Ti5O12at 4C rate
在超级电容电池中,锂离子电池与超级电容器采用内结合的方式结合在一起.往LiPF6基电解液中添加Et4NBF4,电解液中单位体积的自由移动的离子增加,加快离子迁移速度,有利于双电层的形成.当Et4NBF4浓度为0.8,,mol/L时,此时电解液的电导率最大,超级电容电池中锂离子电池的储能部分与超级电容器的储能部分得到较大程度地发挥,从而使用此混合盐电解液的电池容量最大.
图4为恒流4C倍率下,(LiMn2O4+AC)/ Li4Ti5O12在混合盐电解液中不同循环次数充放电循环曲线.分析图4可知,在(LiMn2O4+AC)/Li4Ti5O12体系中,两种储能方式,即静电双电层储能和锂离子嵌入-脱嵌的储能同时进行,具有协同作用.活性炭电极上的静电双电层的储能主要发生在充放电的开始和结束阶段,而锂离子在正、负极材料上嵌入-脱嵌的储能主要在充放电中间阶段[5].

图4 恒流4C倍率下(LiMn2O4+AC)/Li4Ti5O12在混合盐电解液中不同循环次数的充放电循环曲线Fig.4Charge and discharge curves and the corresponding charge-discharge cycle curves for the system (LiMn2O4+AC)/Li4Ti5O12in blend salts electrolyte at 4C rate
2.4 循环伏安特性
为了进一步获得超级电容器电池在混合盐电解液中充放电倍率性能,图5给出了扫速速度为0.1,mV/s和0.5,mV/s时(LiMn2O4+AC)/Li和Li4Ti5O12/Li 2个半电池在不同配比混合盐电解液中的循环伏安曲线.
由图5(a)和(b)可以看出,当以0.1,mV/s的扫描速度对(LiMn2O4+AC)电极进行首次正向扫描时,在3.1,V左右出现电解液与试样颗粒表面发生氧化反应形成SEI膜的氧化峰,其峰强度和峰面积随着电解液中Et4NBF4含量的增加而增大,在负向扫描中则无此类型的峰出现.可能是Et4NBF4促进了正极表面的成膜过程[11].在3.7,~4.4,V之间有2对氧化还原峰,且两峰电流所对应电位值分别位于3.95,V和4.10,V附近,这两对峰的产生是由于在LiMn2O4的正尖晶石型结构中,占据一定位的Li+根据彼此之间的相互作用可分为等量的2类,半数Li+嵌入(或脱出)时,总是先进入(或离开)其中一套亚晶格,另一半Li+嵌入(或脱出)时,离子间的排斥能增大(或减小),因此在循环伏安曲线上出现2个氧化峰和2个还原峰.4组峰的峰面积也有类似的变化规律.虽然电解液中锂盐浓度相同,但随着Et4NBF4浓度的增加,电解液的电导率增加,锂离子的迁移速度加快,有利于锂离子的脱嵌.

图5 不同扫描速度下(LiMn2O4+AC)/Li和Li4Ti5O12/Li的循环伏安曲线Fig.5 CVs of both half cells,(LiMn2O4+AC)/Li and Li4Ti5O12/Li at different scan rates
由图5(a)和5(b)可知,当扫描速度由0.1,mV/s增加到0.5,mV/s时,响应电流增大,锂离子在LiMn2O4电极上嵌入-脱嵌的特征双峰对应的电位几乎不变.表明添加Et4NBF4的电解液能提高以LiMn2O4为正极电池充放电倍率稳定性.
从图5(c)和5(d)可以看出,当扫描速度由0.1,mV/s增加到0.5,mV/s时,Li4Ti5O12负极的氧化还原电位漂移比较大,但是随电解液中Et4NBF4的含量的增加其变化减小,Li4Ti5O12氧化还原电位的对称性和可逆性得到提高.这与混合盐电解液中电导率增加趋势基本一致,可能是Li4Ti5O12比LiMn2O4电极导电性差,导致电解液电导率的变化对锂离子在LiMn2O4电极上嵌入-脱嵌比在LiMn2O4影响大.
以上分析表明:随着LiPF6基电解液中Et4NBF4含量增加,(LiMn2O4+AC)/Li4Ti5O12超级电容器电池的放电容量和倍率的稳定性得到提高,这与上述电池循环性能结果是一致的.
3 结 论
本文探讨了在同浓度的LiPF6基电解液中,添加不同量Et4NBF4盐对超级电容电池(LiMn2O4+ AC)/Li4Ti5O12电化学性能的影响.研究结果表明:
(1)随着Et4NBF4盐浓度的增加,不仅增加了LiPF6基电解液的离子电导率,还提高了复合盐电解液的耐高压性能.
(2)(LiMn2O4+AC)/Li4Ti5O12超级电容电池的容量随LiPF6基电解液中Et4NBF4含量的增加而增加,其电池的循环稳定性也得到增强.当使用电解液中Et4NBF4与LiPF6物质的量的比为4∶1,即含0.8,mol/L Et4NBF4和0.2,mol/L LiPF6,电池在4C倍率恒流循环稳定性效果最好,5,000周后,容量还有86.8,mA·h,保持率为95.8%.
(3)Et4NBF4盐加入LiPF6基电解液是一种很有前途的超级电容电池电解液,有关此混合盐电解液中Et4NBF4盐与LiPF6含量的优化有待进一步深入研究.
[1] Pasquier A D,Plitz I,Gural J,et al. Power-ion battery:Bridging the gap between Li-ion and supercapacitor chemistries[J]. Journal of Power Sources,2004,136(1):160-170.
[2] Chen Feng,Li Rengui,Hou Min,et al. Preparation and characterization of ramsdellite Li2,Ti3O7as an anode material for asymmetric supercapacitors[J]. Electrochimica Acta,2005,51(1):61-65.
[3] Hu Xuebu,Huai Yongjian,Lin Ziji,et al. A (LiFePO4-AC)/Li4Ti5O12hybrid battery capacitor[J]. Journal of the Electrochemical Society,2007,154(11):A1026-A1030.
[4] Hu Xuebu,Deng Zhenghua,Suo Jishuan,et al. A high rate,high capacity and long life(LiMn2O4+AC)/ Li4Ti5O12hybrid battery-supercapacitor[J]. Journal of Power Sources,2009,187(2):635-639.
[5] Cericola D,Novak P,Wokaun A,et al. Hybridization of electrochemical capacitors and rechargeable batteries:An experimental analysis of the different possible approaches utilizing activated carbon,Li4Ti5O12and LiMn2O4[J]. Journal of Power Sources,2011,196(23):10305-10313.
[6] Liu Jun,Chen Zonghai,Busking Sara,et al. Lithium difluoro(oxalato)borate as a functional additive for lithium-ion batteries[J]. Electrochemistry Communications,2007,9(3):475-479.
[7] Amine K,Liu J,Kang S,et al. Improved lithium manganese oxide spinel/graphite Li-ion cells for highpower applications[J]. Journal of Power Sources,2004,129(1):14-19.
[8] 郭营军,晨 辉,其 鲁. 锂离子电池电解液研究进展[J]. 物理化学学报,2007,23(增):80-89.
Guo Yingjun,Chen Hui,Qi Lu. Progress in electrolyte solutions for lithium-ion battery [J]. J Acta Phys-Chim Sin,2007,23(Suppl):80-89(in Chinese).
[9] Xiao A,Yang L,Lucht B L. Thermal Reactions of LiPF6with Added LiBOB[J]. Electrochemical Solid-State Letters,2007,10(11):A24l-A244.
[10] Cericola D,Kötz R,Wokaun A. Effect of electrode mass ratio on aging of activated carbon based supercapacitors utilizing organic electrolytes[J]. Journal of Power Sources,2011,196(6):3114-3118.
[11] 李凡群,赖延清,张治安,等. 石墨负极在Et4NBF4+LiPF6/EC+PC+DMC电解液中的电化学行为[J]. 物理化学学报,2008,24(7):1302-1306.
Li Fanqun,Lai Yanqing,Zhang Zhi’an,et al. Electrochemical behaviors of Et4NBF4+LiPF6/EC+PC+ DMC electrolyte on graphite electrode[J]. J Acta Phys-Chim Sin,2008,24(7):1302-1306(in Chinese).
[12] Tsunekawa H,Tanimoto S,Marubayashi R,et al. Capacity fading of graphite electrodes due to the deposition of manganese ions on them in Li-ion batteries [J]. Journal of the Electrochemical Society,2002,149(10):A1326-A1331.
[13] Saitoh M,Sano M,Fujita M,et al. Studies of capacity losses in cycles and storages for a Li1.1Mn1.9O4positive electrode[J]. Journal of the Electrochemical Society,2004,151(1):A17-A22.
[14] Li Wentao,Lucht B L. Inhibition of solid electrolyte interface formation on cathode particles for lithium-ion batteries[J]. Journal of Power Sources,2007,168 (1):258-264.
[15] 成 果,孙刚伟,宋文华,等. 有机电解液对双电层电容器性能影响[J]. 华东理工大学学报:自然科学版,2010,36(2):222-227.
Cheng Guo,Sun Gangwei,Song Wenhua,et al. Effect of organic electrolytes on properties of electrochemical double-layer capacitor[J]. Journal of East China University of Science and Technology:Natural Science Editon,2010,36(2):222-227(in Chinese).
[16] Kosuke Izutsu. Electrochemistry in Nonaqueous Solutions[M]. Japan:Wiley-VCH Publishers,2002.
(责任编辑:田 军)
Effect of Tetraethylammonium Tetrafluoroborate on the Performance of Super-Capacitor Battery
The effect of blended salts(Et4NBF4and LiPF6)added to the ethylene carbonate+dimethyl carbonate+ ethyl(methyl)carbonate(mass ratio of EC,DMC and EMC is 1∶1∶1)on super-capacitor battery system consisting of LiMn2O4/activated carbon(AC)as the cathode,and Li4Ti5O12as the anode was investigated. The electrochemical performance of the batteries was tested by linear sweep voltammetry(LSV),cyclic voltammetry(CV) and chargedischarge tests. The results indicate that Et4NBF4salt charges the structure of ion-pairs,and improves the highvoltage stability and conductivity of composite salts electrolyte. With the addition of Et4NBF4,more free ions are provided,and the capacity of the super capacitor battery increases. It is also found that the battery shows best electrochemical performance with the mole ratio of Et4NBF4and LiPF6being 4∶1,the discharge capacity is 86.8,mA·h and the capacity retention is 95.8% after 5,000 cycles at 4C rate.
Et4,NBF4;blended salts;super-capacitor battery;(LiMn2,O4+AC)/Li4,Ti5,O12
O646
A
0493-2137(2014)02-0163-05
10.11784/tdxbz201205049
2012-05-19;
2012-07-21.
广东省教育部产学研结合资助项目(2009B090300389).
汪红梅(1971— ),女,博士研究生,副教授,wanghm123@126.com.
刘素琴,sqliu2003@126.com.
Wang Hongmei1,2,Liu Shengqi1,Liu Suqin1,Liu Jiansheng3,Li Yongkun3
(1. College of Chemistry and Chemical Engineering,Central South University,Changsha 410083,China;2. School of Chemical and Biological Engineering,Changsha University of Science and Technology,Changsha 410014,China;3. Guangzhou Tianci Materials Technology Company Limited,Guangzhou 510760,China)

