子宫内膜癌鞘氨醇激酶-1与1-磷酸鞘氨醇的表达和意义
黄金智,卫月,郭润民
(1.广东医学院附属医院妇产科,湛江 524001;2.广东医学院附属医院心血管内科,湛江 524001)
近年来研究[1]发现,鞘脂在恶性肿瘤的进展和转移中有重要作用,其中鞘磷脂的代谢产物神经酰胺、神经鞘氨醇和 1-磷酸鞘氨 醇 (sphingosine-1-phosphate,S1P)参与调节细胞的增殖、存活和凋亡,发挥着十分重要的作用。鞘氨醇激酶(sphingosine kinase,SphK)是控制鞘脂代谢平衡的关键酶,其中SphK1在多种实体肿瘤中均有表达,且其基因具有癌基因的特征。它主要通过SphK1/S1P信号通路促进肿瘤细胞生长,保护其免受凋亡,使其产生放化疗耐受的作用,因而抑制SphK1活性对抗肿瘤有重要意义[1,2],然而 SphK1/S1P信号通路在人子宫内膜癌的具体生物学作用及机制尚不清楚。因此,本研究拟探讨SphK1/S1P信号通路在人子宫内膜癌的变化和可能作用,现报道如下。
1 资料与方法
1.1 临床资料
选取2009年7月~2013年12月在广东医学院附属医院妇产科就诊的子宫内膜癌患者,子宫内膜癌的诊断经诊断性刮宫和病理检查确诊。正常子宫内膜和血浆标本23例(control组),正常子宫内膜取自行子宫全切手术的子宫肌瘤患者的瘤旁组织,其中增生期12例,分泌期11例。子宫内膜癌标本和血浆标本52例(EMC组),取自行子宫全切手术的子宫内膜癌患者,按照2009年FIGO手术病理分期,其中Ⅰ期31例,Ⅱ期11例,Ⅲ~Ⅳ期10例;组织学分级,G1级24例,G2级16例,G3级12例;无肌层浸25例,浅肌层浸润16例,深肌层浸润11例。两组一般资料比较差异无统计学意义。本研究经医院伦理委员会审核通过,患者均签署知情同意书。
1.2 材料与试剂
SphK1抗体购自美国Cell Signaling Technology公司,组织SphK1激酶活性定量检测试剂盒购自上海哈灵生物科技有限公司,S1P ELISA测定试剂盒购自上海前尘生物科技有限公司。
1.3 双抗体夹心ELISA法检测S1P的表达
取子宫内膜癌和正常子宫组织,加入10倍预冷的裂解液,在电动组织匀浆机冰上匀浆30s,以12 000r/min离心30min,取上清即为组织匀浆液。取100μL组织匀浆液或血浆加入预先用S1P抗体包被的酶标板中,37℃孵育90min,然后吸出培养基,加入S1P抗体继续孵育60min,经TBS漂洗3次,加入生物素标记的二抗,反应30min,采用TMB法显色,经终止液终止反应后,用酶标仪(λ=450nm)记录各孔的吸光度(A)。取3孔标准化处理后的A值平均数,按标准曲线计算S1P的表达(单位:pmol/mL)。
1.4 Western blot法检测SphK1的表达
取子宫内膜癌和正常子宫组织,加入10倍预冷的裂解液,在电动组织匀浆机冰上匀浆30s,以12 000r/min离心30min,取上清,采用二喹啉甲酸(BCA)法进行蛋白定量。总蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移到聚偏二氟乙烯(PVDF)膜上,用5%脱脂奶粉封闭1h,随后加入SphK1抗体(1∶2 000)4℃过夜,用TBST洗3次,每次10min,用辣根过氧化物酶(HRP)标记的二抗室温孵育1.5h,TBST(Tris-Buffered Saline with Tween Solution)洗10min,3次,将PVDF膜用发光试剂增强化学发光(ECL)显色,暗室曝光到X光片上,用ImageJ 1.41o软件进行半定量分析。
1.5 SphK1酶活性的测定
取子宫内膜癌和正常子宫组织,依照产品说明书准备好待测样品后,取缓冲液到新的酶标板中,依次加入酶促液、反应液、底物液,放进37℃培养箱里静置3min,加入5μL待测样品,上下倾倒数次,混匀后即刻放进酶标仪检测,样品SphK1酶活性读数为:λ=340nm 读数0min-λ=340nm 读数5min(单位:pmol S1Pmin/mg蛋白质)。
1.6 统计学方法
采用SPSS 13.0统计学软件进行数据处理和分析,计量资料以均数±标准差(±s)表示,两组比较采用两样本t检验,计数资料以率表示,两组比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 S1P在子宫内膜癌患者血浆和子宫内膜的表达
与正常对照组比较,子宫内膜癌患者血浆S1P的水平显著升高(P<0.01);与正常子宫内膜组织比较,S1P在子宫内膜癌的表达明显增加(约为1.7倍)(P<0.01)(见图1A和1B)。
2.2 子宫内膜癌和正常子宫内膜SphK1表达和酶活性的比较
与正常子宫内膜组织比较,SphK1在子宫内膜癌的表达显著上调(P<0.01)(图2A和2B)。采用组织SphK1激酶活性定量检测试剂盒测定子宫内膜癌和正常子宫内膜SphK1酶活性,子宫内膜癌SphK1酶活性约是正常子宫组织的2.6倍(P<0.01)(见图2C)。
3 讨论
S1P是细胞膜磷脂的代谢产物,可作为细胞内信号转导的第二信使,也可通过细胞表面的S1P受体发挥生物学作用,参与调节细胞的增殖、分化、迁移和凋亡等,还可介导血管生成、炎症反应等生理病理过程。S1P由SphK1磷酸化鞘氨醇生成,而SphK1/S1P信号通路在肝癌、大肠癌等多种恶性肿瘤的发生发展中具有重要作用。研究结果[3-5]提示,SphK1是一种癌基因,主要存在于细胞浆中,其表达与乳腺癌、结肠癌、肺癌、卵巢癌、胃癌、肾癌和直肠癌等肿瘤的恶性程度以及预后相关,可作为肿瘤恶性程度分级的一个指标。然而,目前有关SphK1/S1P信号通路在子宫内膜癌发病中的作用少见报道。
以往研究[5-8]证实,肿瘤细胞神经酰胺和 S1P共同控制细胞的存活或凋亡,对肿瘤的发生发展和转移浸润有重要作用。本研究结果显示,与正常对照组相比,子宫内膜癌患者血浆S1P的水平显著升高(P<0.01),S1P在子宫内膜癌的表达明显增加(约为1.7倍)(P<0.01)。该结果提示,子宫内膜癌可能发生鞘脂代谢紊乱和SphK1/S1P信号通路异常,S1P表达升高可能是子宫内膜癌发生和恶化进展的重要机制之一。当然,没有测定神经酰胺来反映鞘脂代谢是本文的局限性,而S1P在子宫内膜癌发病中的作用及机制有待进一步研究。
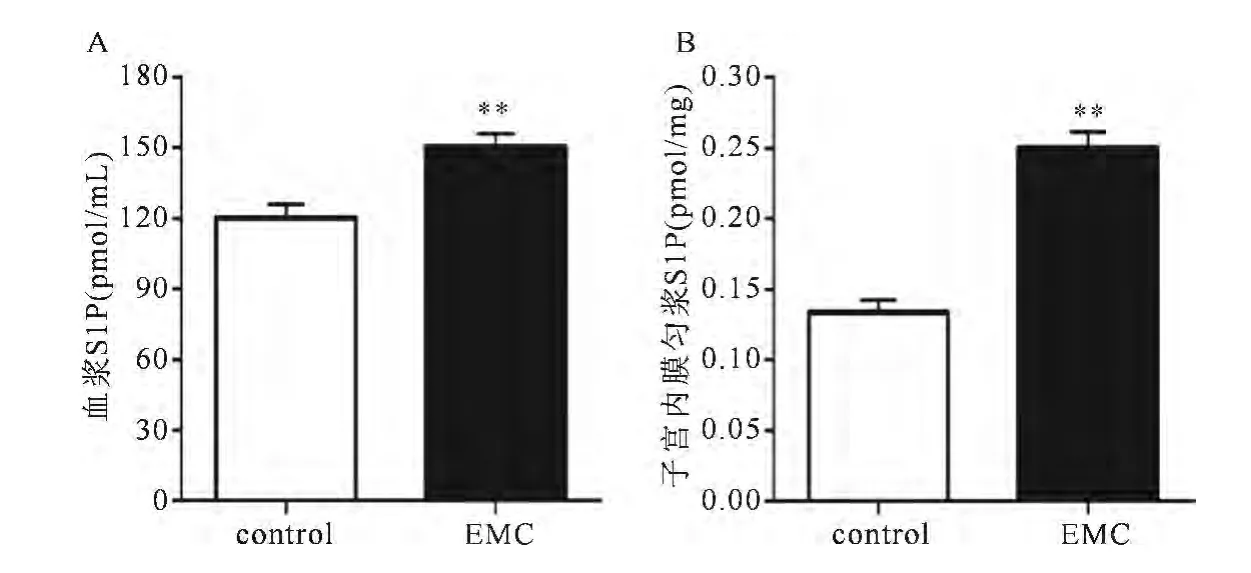
图1 S1P在子宫内膜癌患者血浆和子宫的表达
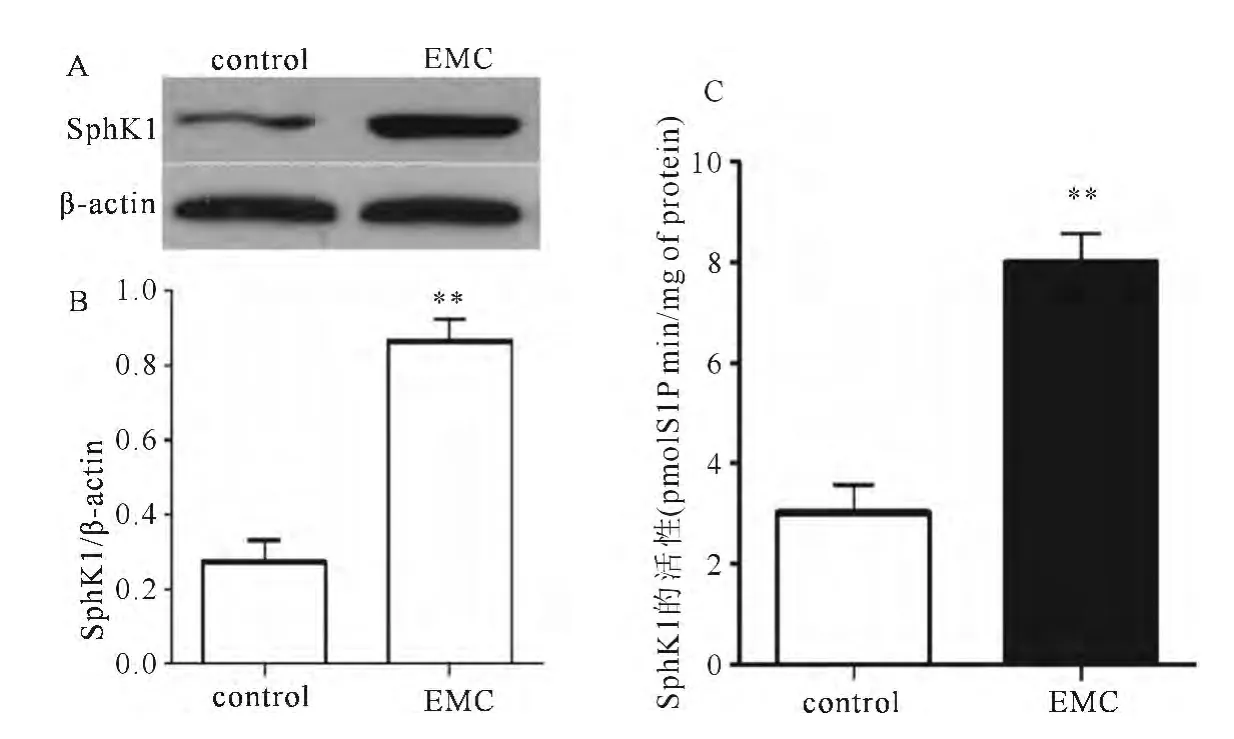
图2 子宫内膜癌患者子宫内膜SphK1的表达和酶活性
新近体内外研究[9,10]证实,SphK1酶的表达与活性可以作为多种恶性肿瘤恶性程度和预后的检测指标之一,抑制SphK1酶可以促进肿瘤细胞凋亡,提高化疗药物的敏感性。本文进一步的研究结果显示,子宫内膜癌SphK1酶活性约是正常子宫组织的2.6倍,提示子宫内膜癌患者S1P水平升高的原因可能是SphK1酶被显著激活,SphK1/S1P信号通路的激活可能是子宫内膜癌的重要发病机制之一,抑制该通路有可能作为治疗子宫内膜癌的靶标。总之,本研究表明子宫内膜癌患者子宫内膜局部SphK1/S1P信号通路被激活,阻断该通路有可能延缓子宫内膜癌的恶性进展。因此,深入研究SphK1/S1P信号通路在子宫内膜癌发病中的详细作用及分子机制,以及与子宫内膜癌恶性程度和预后的关系,都将有助于阐明子宫内膜癌的发病机制和拓展新的防治策略。
[1]綦湘毅,阳学风.神经酰胺在肿瘤发生发展中作用的研究进展[J].肿瘤药学,2014,4(1):15-20.
[2]肖敏,李琛,袁汉尧,等.鞘氨醇激酶2与蛋白激酶D参与调控丁酸钠诱导的人肝癌细胞凋亡[J].第三军医大学学报,2014,36(3):262-266.
[3]史福军,黄宗海,厉周,等.鞘氨醇激酶促进胃癌细胞SGC-7901转移和侵袭[J].第三军医大学学报,2014,36(1):25-28.
[4]李梦婷,黄杰安,周巧,等.鞘氨醇激酶1对结肠癌细胞血管生成拟态的影响及其机制[J].世界华人消化杂志,2012,20(33):3211-3217.
[5]张彩霞,何红伟,邵荣光.鞘氨醇激酶与肿瘤[J].药学学报,2013,48(7):971-978.
[6]刘诗权,黄杰安.鞘氨醇激酶在胃癌中的研究进展[J].中国医药指南,2013,11(18):68-70.
[7]何勇勇.鞘氨醇激酶1对肝癌门静脉癌栓患者预后影响的研究[D].苏州大学,2012.
[8]张丽志,温克.1-磷酸鞘氨醇对恶性肿瘤生物学行为调控的研究进展[J].肿瘤,2012,32(11):936-939.
[9]于杨,秦树存.脂质活性信号分子鞘氨醇-1-磷酸及其生物学特性[J].生理科学进展,2011,42(2):151-154.
[10]彭萍,吴璇,关婷,等.1-磷酸-神经鞘氨醇干预化疗对荷瘤小鼠卵巢功能和抑瘤效果的影响[J].南方医科大学学报,2012,32(3):383-386.

