丹参酮I抑制小鼠B16黑色素瘤细胞研究
张 蕾,陈 璐,李蒙蒙,金王东,王飘逸,单乐天*
(1. 浙江科技学院 生物与化学工程学院,浙江 杭州 310023;2. 浙江省农产品化学与生物加工技术重点实验室,浙江 杭州 310023;3. 浙江中医药大学,浙江 杭州 310053)
恶性肿瘤的发病率和死亡率日益升高,严重威胁人类的生命健康,在我国城乡居民主要死亡原因中已经高居第一位[1]。而在恶性肿瘤中,黑素瘤作为一种恶性程度相对较高的肿瘤近年来的发病率呈现增长的态势。黑色素瘤又名恶性黑瘤,多发于皮肤,也有起源于眼、鼻腔等处,早起可发生转移,一般多见于肺和脑。在治疗方面以手术切除为主要的治疗方法,配合化疗、放疗和免疫治疗,但是都存在较大的不良反应。因此,采用副作用相对小并且疗效高的生物治疗方法受到临床研究者的广泛重视。
近年研究发现,许多中药单体或复方能够发挥抗癌抑癌的功效[2]。丹参是常用的活血化瘀中药之一,在临床上长期被用于心脑血管疾病的治疗,近年来在抗肿瘤活性方面成为研究的热点,但其具体作用机制仍未完全阐明。丹参为双子叶唇形科鼠尾草属植物丹参的干燥根及根茎,其主要功效为活血调经、祛瘀止痛、凉血消痈、清心除烦、养血安神。已有研究表明丹参对心血管和消化系统均有作用,例如对脑损伤和肺损伤的保护,抗高血压以及调节血脂等[3]。Zheng等[4]采用丹参酒精提取液对人结肠癌细胞(HT-29)、直肠癌细胞(HRT-18)及肝癌细胞(HepG2)进行体外实验结果表明, 对上述癌细胞均有抑制作用。已有报道表明[5~7],在这些脂溶性成分中,丹参酮IIA等有确切的抗肿瘤效果,表现在对肿瘤细胞的细胞周期,细胞增殖和凋亡方面。但是对于丹参酮I的抗肿瘤作用的研究报道较少,为了进一步研究,本实验将以B16黑色素细胞为载体,对丹参酮I的抗肿瘤作用进行实验研究。
1 实验材料
1.1 药物及试剂
丹参酮I(纯度90%)南京泽朗医药公司;胎牛血清(赛默飞世尔生物化学制品有限公司,批号NWJ0473);胰蛋白酶-EDTA消化液(Beijing Solarbio Science & Technology Co., Ltd.);改良型的RPMI1640培养液(赛默飞世尔生物化学制品有限公司,批号NYH095 1);磷酸盐缓冲液(赛默飞世尔生物化学制品有限公司,批号NYA0786),MTT,DMSO购自北京拜尔迪生物技术公司;细胞凋亡检测试剂盒,青链霉素混合液(Beijing Solarbio Science & Technology Co., Ltd.)。
1.2 细胞株
黑色素瘤细胞(B16细胞),购自北京中科院细胞资源库。
1.3 实验仪器
SW-CJ-1F层流超净工作台(苏州安泰空气技术有限公司);AXiovert200荧光倒置显微镜,多功能酶标仪(Thermo Scientific,USA);超低温冰箱(Thermo, USA);DK-S12型恒温水浴锅(上海森信实验仪器有限公司);Thermo Scientific CO2细胞培养箱(Thermo, USA);MM-2(ZW-A)微量振荡器(金坛市梅香仪器有限公司)。
2 实验方法
2.1 细胞培养液的制备
将使用前的1640培养液加入青链霉素混合液(青霉素10 000 U/mL和链霉素10 000 U/mL),并且使青链霉素混合液的浓度占培养基的1%,再取过膜后的胎牛血清加入到先前配好的1640培养液中,使血清的浓度占总浓度的10%,最后配成适合小鼠黑色素瘤B16细胞生长的培养液。
2.2 细胞的培养和传代
从-80℃冰箱取出冻存的B16细胞迅速投入37℃恒温水浴锅中,摇晃使其尽快解冻后置于10 mL离心管,加入适量培养液,重悬细胞,弃上清,加培养液混匀。将B16细胞培养在含10%FBS、1%青链霉素的1640培养基的培养瓶中,置于37℃、5%CO2及相对饱和湿度的恒温培养箱中培养,观察细胞的贴壁状况,每隔2 ~ 3 d视情况更换培养液。待细胞贴壁并且细胞密度达到瓶底面积的80% ~ 90%后进行传代培养。
传代前先弃去原来的培养液,加入2 ~ 3 mL的PBS溶液,轻轻摇晃漂洗细胞后倾去。然后加入适量0.25%胰蛋白酶,室温下(或37℃)消化2 ~ 3 min后,用吸管吸出消化液。接着在培养瓶中加入3 mL培养液,终止消化。用吸管反复吹打瓶壁上的细胞层,轻轻吹打混匀,制成单细胞悬液,按1:2或1:3分配,接种到2 ~ 3个培养瓶内,再向各瓶补加培养液4 mL继续培养。每隔2 ~ 3 d 换培养液,传代之第二代后,去对数生长期的细胞用于实验。
2.3 药物配制
称取800 μg丹参酮I,取适量的DMSO溶解,加入含有10%的胎牛血清的1640培养液进行稀释,并把溶液分为3个浓度:5、4、3 μg/mL为对照组。
2.4 细胞显微观测
将B16细胞接种于6孔培养板中,密度控制在1×105/孔左右,培养24 h等细胞贴壁后,置于倒置显微镜下观察B16细胞形态学的变化并拍照;并与0 μg/mL丹参酮I和3 μg/mL丹参酮I的培养基培养同等时间下的B16细胞形态进行对照比较。
2.5 MTT法检测丹参酮I对B16细胞的抑制作用
取处于对数生长期的B16细胞,用 0.25%胰蛋白酶消化回收制成单细胞悬液,统计细胞数量,将细胞密度调整到(4 ~ 5)×103/mL接种到96孔板,用不含胎牛血清的培养液培养24 h后换含药的培养液。空白对照组给予等体积PBS;实验组分加入不同浓度的丹参酮I,其浓度分别为5、4、3 μg/mL,阴性对照组为含0 μg/mL丹参酮I,每个浓度设5个复孔。分别设24、48、72 h 3个时间点培养后,弃去培养液,加入事先配好的5 g/L的MTT液(20 μL/孔),避光在37℃、5%CO2及相对饱和湿度的恒温培养箱中培养4 h后,吸去上清液,加入DMSO 150 μL/孔,之后立即用微型震荡器避光震荡5 ~ 10 min,使DMSO完全混匀溶解结晶,之后在酶标仪上用490 nm测其吸光度(A),实验重复3次。按以下公式计算抑制率。

2.6 流式细胞术检测细胞周期变化
将5 μg/mL丹参酮I分别作用24、48、72 h 3个时间点后的B16黑色素瘤细胞用胰酶消化收集浓度,再用PBS洗涤2次,用500 uL PBS重悬细胞,将悬液逐滴慢慢加入到预先冷却的4.5 mL70%乙醇中,置-20℃下过夜。取出离心弃上清,如残留在壁上则再次离心(500 r/min,2 ~ 3 min),用试剂盒中的Reagent B清洗2次(1 mL/次),重复上述操作后收集细胞。取试剂盒中的Reagent A 1 mL加入到细胞中,放入37℃水浴中水浴15 min后,用流式细胞仪检测。
2.7 统计学处理
采用DPS7.50软件进行统计分析,以P < 0.05为差异有统计学意义。
3 结果分析
3.1 丹参酮I对B16细胞形态的影响
在倒置显微镜下观察B16黑色素肿瘤细胞的生长情况及细胞形态,可以发现给药组的肿瘤细胞数量明显的减少,细胞变小,细胞边缘模糊,贴壁率低。而对照组的不含丹参酮 I的细胞生长旺盛,贴壁率高,细胞形态饱满无明显改变(图1)。

图1 细胞形态学观察(×200)Figure 1 Morphology of cells
3.2 丹参酮I对B16细胞的抑制作用
用MTT法检测后发现不同浓度的丹参酮I分别给药24、48、72 h后,对B16细胞的生长呈明显抑制作用。随药物作用时间延长,细胞生长抑制率逐渐升高,5 μg/mL的丹参酮I引起的细胞生长抑制率明显高于其他浓度
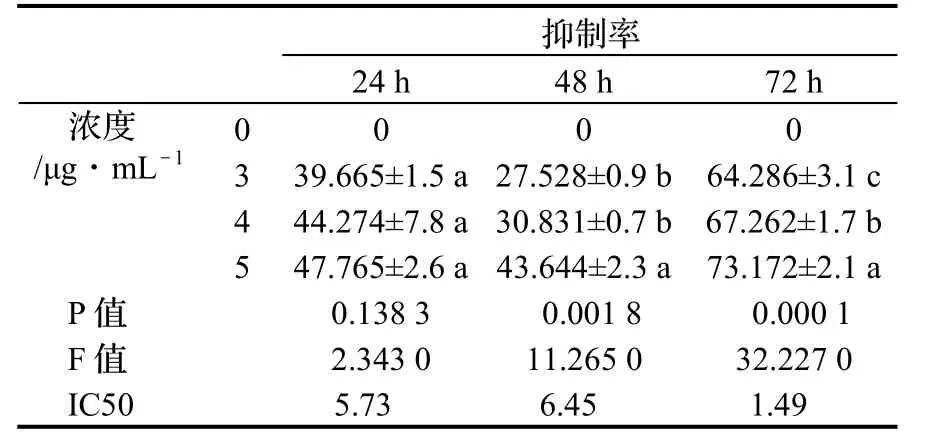
表1 不同浓度的丹参酮I对B16细胞的生长抑制作用Table 1 Effect of different concentration of Tanshinone I on B16 melanoma cells

图2 不同浓度丹参酮I作用B16细胞的周期比较Figure 2 Comparisons on B16 cell cycles treated by different concentrations of Tanshinone I
(P < 0.05)。由IC50值发现随着作用时间的延长,抑制细胞增长一半时的丹参酮I浓度在明显减少。由此表明丹参酮I的细胞抑制率与药物浓度及作用时间密切相关(表1)。
3.3 丹参酮I对B16细胞周期的影响
B16细胞经给药组(5 μg/mL丹参酮I作用72 h)和空白对照组(0 μg/mL丹参酮I作用72 h)处理,PI染色后使用流式细胞仪进行监测分析(图2)。
细胞的分化生长分为几个时期,G0期是细胞休眠期,而G1期是从有丝分裂到DNA复制前的一段时期,又称合成前期,S期是DNA合成期。通过与空白对照组比较可以发现在G1期给药组的细胞略微比空白组多,但是在S期给药组的细胞数下降且小于空白组(见表2,图3)。结果表明丹参酮I能使B16细胞周期阻滞于分裂期,使其不能进入S期。

图3 丹参酮I作用B16细胞72 h后细胞周期的变化Figure 3 Changes of B16 cell cycles 72 hours after treated by Tanshinone I
4 结论与讨论
丹参作为一味中药被广泛的应用在各种疾病的临床治疗,并且在抗肿瘤方面也有很大的作用。有研究发现丹参对人的肺癌、卵巢癌、黑色素瘤、结肠癌具有细胞毒作用,这些肿瘤细胞在经过从丹参根部提取的有效成分的培养后,细胞系的增殖均显著受到抑制[8]。其中袁淑兰等[9]研究发现:丹参酮IIA对各种肿瘤(包括白血病、软骨瘤、胃癌、胰腺癌、鼻咽癌)均有不同程度的疗效。而丹参酮I为丹参抗肿瘤有效成分之一,目前的抗肿瘤机制的研究还处于探索阶段。有研究报告指出,丹参酮I在体外体内试验表现出抗肿瘤活性,其作用机制可能通过白介素-8,Ras-mitogen-activated蛋白激酶和Rac1信号传导途径[10]。在另一份有关丹参酮I抗肿瘤的报道中,学者采用HepG2细胞进行研究,实验表明丹参酮I能抑制体外培养的癌细胞,并导致细胞凋亡[11]。
本次实验主要采用小鼠B16黑色素瘤细胞,有研究报道,丹参具有抗黑色素瘤转移的效应,这种效应可能是在丹参抑制瘤细胞的侵袭性和运动能力、加强粘附能力的共同作用下表现出来[12]。实验结果表明,不同浓度的丹参酮I对B16细胞的生长起到抑制作用,抑制的效果随着作用的时间和药物浓度的增加而增强。从倒置显微镜下观察,不含丹参酮I培养液培养的B16细胞生长旺盛,存活率高,而经丹参酮I培养的细胞生长受阻,开始出现凋亡的现象。有报道指出,丹参酮I能抑制HepG2细胞的增殖;通过观察HepG2细胞的形态观察到癌细胞生长被抑制,从HepG2细胞周期测定结果显示,丹参酮I先将细胞周期阻滞于G0/G1期,然后诱导细胞凋亡[13]。Bax和Bcl-2是一对凋亡相关调控基因,Bax主要通过与其家族Bcl-2形成二聚体而发生作用。当Bcl-2表达较高时,Bcl-2和Bax形成异源二聚体而抑制凋亡;当Bax表达较高时,Bax之间形成同源二聚体而促进凋亡。从本次试验流式细胞检测表明,丹参酮I对B16细胞周期产生了影响,阻滞了细胞周期的分裂期,从而抑制了细胞的生长,使细胞加入S期的比例明显减少,进一步促使细胞的凋亡,从而达到抗肿瘤的效果。
丹参酮I作为抗肿瘤的有效成分,在对抗小鼠B16黑色素瘤细胞的试验中表现出一定的抗肿瘤效果,尤其是在阻滞肿瘤细胞的生长和促进肿瘤细胞凋亡方面,并且作用效果随着给药浓度和给药时间的延长而增强。由此可见丹参酮I在抗肿瘤方面具有很大的实验研究的潜质,为临床抗肿瘤药物的研发奠定了基础。
[1] 黄良荣. 丹参制剂在肿瘤治疗中的研究进展[J]. 健康必读杂志,2010,8(8):8-9.
[2] 吕艳芬,苏子成. 丹参抗肿瘤转移的作用及其机制[J]. 肿瘤研究与临床,2009,21(2):138-139.
[3] 孙联平,李瑞杰. 丹参对原发性高血压大鼠左室肥厚及心肌凋亡的影响[J]. 同济大学学报(医学版),2007,27(2):29-30.
[4] [4] Zheng G C, Lee J Y, Kime D C, et al. Inhibitory effect of Saluia miltiorrhiza extract on growth of some cancer cell[J]. Korean Soc Food Sci Nutr, 2000, 29(4):726-731.
[5] 孙兆卿,王寿富. 丹参酮ⅡA抗肿瘤作用研究进展[J]. 云南中医药杂志,2010,31(7):70-71.
[6] 张玥,张英姿. 丹参及其主要成分抗肿瘤作用的研究进展[J]. 滨州医学报,2012,35(2):143-145.
[7] 赵坚,徐峰,魏峻,等. 丹参酮Ⅱ对人鼻咽癌CNE1细胞株B7H3表达的影响[J]. 临床耳鼻咽喉精颈外科杂志,2013,27(4):143-145.
[8] 张雁,于庆生. 丹参的抗肿瘤作用[J]. 安徽中医院学报,2007,26(6):61-62.
[9] 袁淑兰,黄韧敏,宋毅,等. 丹参酮抗肿瘤研究新进展[J]. 天然产物研究与开发,1997,12(6):253.
[10] Lee C Y, Sher H F, Chen H W, et al. Anticancer effects of tanshinonei in humannon-small cell lung cancer[J]. Mol Cancer Ther, 2008, 7(11):3 527-3 538.
[11] 郑国灿,李智英. 丹参酮I抗肿瘤作用及作用机制的实验研究[J]. 实用肿瘤杂志,2005,20(1):33-35.
[12] 徐建亚,顾勤,夏卫军,等. 丹参酮对小鼠黑色素瘤细胞株吧B16_BL16侵袭和转移能力的影响[J]. Chin J Inf TCM, 2007, 14(6):26-28.
[13] Korsmeyer S J. bcl-2 gene family and the regulation of programmed cell death [J]. Cancer Res, 1999, 59(7):1 693-1 700.

