环境饵料丰度的季节变化对筼筜湖3种大型底栖动物食性的影响
——来自稳定同位素的证据
郑新庆,黄凌风,林荣澄
(1.国家海洋局第三海洋研究所,福建厦门 361005;2.厦门大学环境与生态学院,福建厦门 361005)
环境饵料丰度的季节变化对筼筜湖3种大型底栖动物食性的影响
——来自稳定同位素的证据
郑新庆1,黄凌风2*,林荣澄1
(1.国家海洋局第三海洋研究所,福建厦门 361005;2.厦门大学环境与生态学院,福建厦门 361005)
测定了不同时期筼筜湖3种大型底栖动物(沙筛贝Mytilopsissallei、日本大螯蜚Grandidierella japonica和腺带刺沙蚕Neanthes japonica)及其潜在食源的稳定同位素组成(δ13C和δ15N),研究环境饵料丰度的季节变化对筼筜湖3种大型底栖动物食性的影响。结果显示,筼筜湖悬浮颗粒有机物(Particulate organic matter∶POM)的δ13C和δ15N存在明显的季节变化。3月,受到输入筼筜湖的西海域海水大量陆源有机碎屑以及湖区周围的生活污水以及餐饮业输入的影响,筼筜湖POM的δ13C和δ15N明显贫化;而在9月,POM中δ13C和δ15N明显富集的内源性浮游植物的贡献增加。沙筛贝是典型的底栖滤食者,主要以POM为食,但它比POM富集的δ13C值(3月和9月二者之间的Δδ13C分别为2.9‰和1.6‰)表明它还摄入其他δ13C相对富集的食物来源:石莼来源的有机碎屑可能是3月份沙筛贝δ13C富集的原因,而9月份则是由于再悬浮的底栖微藻对沙筛贝食源的贡献引起的。食碎屑的腺带刺沙蚕和日本大螯蜚在3月以石莼及其表面的附生生物为食,而9月份底栖微藻和浮游植物来源的POM是它们食源的主要贡献者。本研究的结果显示,筼筜湖3种大型底栖动物的δ15N都出现明显的季节变化(Δδ15N介于2.2‰~4.3‰),这是由于它们食源稳定同位素的季节性波动及其食性的季节变化引起的,而消费者食性的季节性变化则受到不同时期环境食物可利用性的影响。
大型底栖动物;季节变化;食性;稳定同位素;筼筜湖
1 引言
潟湖是近岸最具生产力的生态系统之一。湖区内有许多不同类型的初级生产者,如红树植物,盐沼植物,大型海草和大型海藻以及它们表面的附生生物,浮游植物,底栖微型藻类等[1—3],生产力巨大,为消费者提供充足的碳源。不过,受到植物自身的生理限制(温度、盐度以及营养盐竞争等)影响,潟湖初级生产者的类别组成和丰度常表现出时间尺度和空间尺度上的剧烈变化[4]。随之,由于消费者食物和栖息环境的变动,初级消费者,尤其是底栖消费者的食性也会随之发生改变[5—8],这可能引起系统食物网结构和功能的变化[6]。
与其他沿岸系统一样,潟湖主要的大型底栖动物是滤食者和食碎屑者。它们的摄食活动将沉积物和悬浮物有机联系起来,影响了生态系统的营养循环[9]。然而,由于消费者潜在食源的多样性,如外源有机质的输入,光合作用植物(浮游植物、大型藻类和沉底植物)的有机碎屑,来自陆源维管束植物的碎屑残体等,很难估计消费者所摄食同化的食物以哪些有机碳源为主[10]。而且,即使摄食习性相同的底栖消费者,它们的食性可能也有所不同[11—12]。例如,碎屑食性的大型底栖动物摄食的沉积有机质(Sedimentation organic matter,SOM)包括不同来源的有机质,如底栖微藻、细菌以及水生植物和陆生植物来源的有机碎屑。一些食碎屑者能选择同化SOM不同组分的能力(如仅同化底栖微藻),而另外一些食碎屑者则不具备选择性摄食的能力。这样,消费者这种选择性摄食或同化的能力使消费者及其食源的营养关系的分析更加复杂。
众多的研究表明,消费者与其食物之间存在密切的同位素相似性,通过对碳、氮稳定同位素的监测可以反映生物体长时间尺度的、经过消化吸收后的食物来源信息[13]。一般来说,碳稳定同位素(δ13C)相对保守,相邻营养级之间富集度低,可以反映其同化吸收的来自水域生态系统中不同栖息地的物质来源;而消费者及其食源之间的氮稳定同位素含量(δ15N)则会出现显著的富集现象[14]。因此,稳定同位素技术被广泛应用于消费者及其潜在食源营养关系的分析当中[11—12,15—16]。本研究以筼筜湖3种常年分布的大型底栖动物为研究对象,通过比较这3种大型底栖动物及其潜在食源碳、氮稳定同位素的季节变化,分析环境饵料丰度的季节变化对底栖动物食性的影响。
2 材料与方法
2.1 采样点描述
筼筜湖位于厦门岛西部,毗连西海域,是一个水深较浅的半封闭咸水潟湖(图1)。水体运动的主要形式是由纳潮引发的水循环,从西海域引入的海水经引水渠、内湖和外湖,最后经过水闸排入厦门西海域,水停留时间约3 d。此外,来自干渠上游的松柏湖水也会沿干渠进入内湖和外湖。由于大量陆源营养物的输入,湖区水体富营养化严重,冬春季(每年11月至次年的5月)常暴发大型海藻(石莼Ulva lactuca、条浒苔Enteromorpha clathrata和根枝藻Rhizocloniumsp.)的藻华(绿潮)[17],夏秋季(6月至10月)暴发赤潮[18]。
本研究分别选择冬春季和夏秋季有代表性的月份(3月和9月)采集样品,在内、外湖较深的区域(约4 m,见图1“○”所示位置)采集POM避免沉积物再悬浮产生的干扰,在内湖的近岸浅水水域采集SOM,石莼(Ulva)和底栖动物(小于1 m,见图1“●”所示位置),在内、外湖有红树林的区域采集红树植物叶片(Leafs of mangrove plants,LMP)。

图1 筼筜湖地图及采样站点Fig.1 Map of the Yundang Lagoon showing the sampling sites
2.2 样品的采集和前处理
2.2.1 消费者潜在食源的采集和样品前处理
取表层水1~2 L,经170μm的筛滤过滤,所获取的滤液经预先在马弗炉550°C灼烧过的GF/F膜过滤,所得的样品即为POM。采集Ulva装在封口袋中。所获取的Ulva在0.22μm的过滤海水中轻轻荡涤,去除表面附着的一些无机颗粒和一些松散附着的微型生物,然后用刷子轻刷Ulva表面,待Ulva表面洗净后,用MiliQ水冲洗Ulva藻表面3次,所得样品即为Ulva。将“刷洗液”通过63μm的筛绢过滤,静置3~5 min后,所得的上清液过滤到预先在马弗炉550°C灼烧过的GF/F膜上,所得膜样品即为Epi。采用柱状采样器采集SOM,每个站位取5~10个柱状样,取表层0.5 cm的沉积物混合于一个样品中。将采集的沉积物经63μm筛绢分筛,所获得的颗粒物即为SOM。
采用“沙埋法”采集底栖微藻(Benthic microalgae,BM)。原理是BM大多是具有一定运动能力的羽纹硅藻,可在沉积物表面上下移动。方法如下:用箱氏采样器采集沉积物,用铲子采集表层1 cm的沉积物于25 cm×35 cm搪瓷盆中。往沉积物表层铺洒0.2~0.5 cm厚的沙子(沙子粒径在0.5~1 mm之间,且须预先在马弗炉550°C灼烧过以去除有机质),然后沙子表面铺上63μm的筛绢,并在筛绢上铺上0.5 cm厚的沙子。在沙表面喷洒一定量的过滤海水,以湿润沙表面为宜。5 h后,收集筛绢上的沙至过滤海水(0.22μm)中并充分搅拌,使BM悬浮。待沙子沉淀后(1 min),导出上层水液,经63μm筛绢过滤去除可能的细沙后,将滤液过滤至经预先在马弗炉550°C灼烧过的GF/F膜上,所得的样品即为BM。
2.2.2 底栖初级消费者样品的采集和前处理
用箱式采样器(采样面积0.04 m2)采集沙筛贝Mytilopsis sallei、日本大螯蜚Grandidierella japonica以及腺带刺沙蚕Neanthes japonica。采集的日本大螯蜚和腺带刺沙蚕,用过滤海水(0.45μm)暂养2~4 h,待排空胃含物后,收集于50 m L的离心管中。取沙筛贝的肌肉部分用于稳定同位素的分析。
将上述样品(包括膜样品、沉积物样品和动物样品)置于烘箱60℃烘48 h至恒重。为了去除样品中的碳酸盐成分,膜样品和沉积物样品还必须经过酸化的步骤。膜样品采用酸熏的方法:在洗净的干燥器中用12 mol/L的HCl酸化48 h,然后迅速将膜样品放在烘箱中60℃烘48 h。用1 mol/L的HCl酸化SOM样品,每隔1 h搅拌摇匀一次,直至没有气泡产生,然后再用MiliQ水反复冲洗SOM样品5次,去除样品中残余的HCl,最后将酸化后的SOM样品置于烘箱中,60℃烘48 h至恒重。除膜样品外,其他的样品都研磨成粉,经100目的筛绢过筛后收集于样品瓶中,然后置于干燥器中保存以待分析。
样品的稳定同位素(δ13C和δ15N)采用DELTA V Advantage同位素比率质谱仪(Isotope Ratio Mass Spectrometer)测定。外部设备为Flash EA1112 HT元素分析仪(Elemental Analyzer)。它的原理是利用样品在元素分析仪中高温燃烧后生成CO2和N2,质谱仪通过检测CO2的13C与12C比率和N2的15N与14N比率,并与国际标准物(Pee Dee Belnite和大气N2)比对后计算出样品的δ13C和δ15N比率值。其中,δ13C的测定精度为±<0.1‰,δ15N的测定精度为±<0.2‰。
计算公式如下:
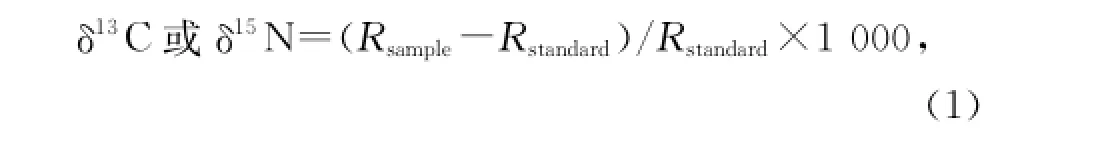
其中,R指的是13C/12C或15N/14N。
2.3 数据处理与分析
采用SPSS 16.0分析所获得的数据。采用单因素方差分析Tukey's检验比较不同食源碳、氮稳定同位素的差异。采用成组数据t检验比较不同时期3种底栖消费者及其潜在食源碳、氮稳定同位素的差异。
采用IsoSource线性混合模型分析不同食源对消费者的食源贡献率。根据Vander Zanden和Rasmussen[14],假设相邻营养级δ13C的营养富集因子(Trophic enrichment factor:TEF)是0.47‰。植食性消费者的δ15N的TEF是2.52‰。
3 结果
3.1 几种食源的稳定同位素组成及其季节变化
3月份,筼筜湖消费者的潜在食源复杂,包括LMP、POM、SOM、BM和Ulva及其表面的Epi,其δ13C值介于-27.0‰~-12.0‰之间。其中,红树植物凋零物LMP的δ13C值最低,Ulva的δ13C值最高。δ15N值介于-1.6‰~5.1‰之间。其中,POM的δ15N值最低,BM的δ15N值最高。方差分析的结果显示,3月份不同食源之间的δ13C值差异显著(见表1),因此利用δ13C基本可以将这些食源区分开。虽然BM和SOM之间的δ13C值并没有显著的差异(p>0.05),但利用δ15N可以进一步将它们区分开(p<0.05,表1)。10月份,消费者潜在的食源包括POM,SOM,BM以及LMP,其δ13C值介于-26.6‰~-16.9‰之间。同样,LMP的δ13C值最低,BM的 δ13C值最高,不同食源之间的δ13C值存在显著的差异(表1),利用δ13C即可将这些食源区分开。9月消费者潜在食源的δ15N值介于2.1‰~6.4‰之间,其中,POM的δ15N值最低,BM的δ15N值最高。

表1 筼筜湖各食源的稳定碳、氮同位素值Tab.1 Carbon and nitrogen stable isotope values of food sources in the Yundang Lagoon
消费者潜在食源的稳定同位素组成存在一定的季节变化(表2)。对δ13C来说,9月份采集的BM和POM明显比3月富集,而SOM的δ13C值并没有表现出显著的季节变化;对δ15N来说,3月SOM和 POM明显比9月贫化,但BM的δ15N值在不同月份之间并没有显著的差异;红树植物的δ13C和δ15N值没有明显差异。

表2 筼筜湖各食源稳定碳、氮同位素值的季节变化Tab.2 Seasonal shifts in carbon and nitrogen stable isotope values of food sources in the Yundang Lagoon
3.2 筼筜湖几种底栖动物的稳定同位素组成及其季节变化
不同时期3种大型底栖动物的稳定同位素组成如图2所示。日本大螯蜚和腺带刺沙蚕的δ13C和δ15N值远高于沙筛贝(见图2A)。3月采集的日本大螯蜚和腺带刺沙蚕的δ13C值与9月份相当,但δ15N值明显低于9月份(见图2B,Δδ15N分别为2.2‰和2.9‰)。沙筛贝的δ13C和δ15N值季节变化明显,3月份样品的δ13C和δ15N值均远低于9月份,其Δδ13C和Δδ15N分别为2.2‰和4.3‰(见图2A,2B)。
4 讨论
4.1 消费者潜在食源的稳定同位素组成及其季节变化
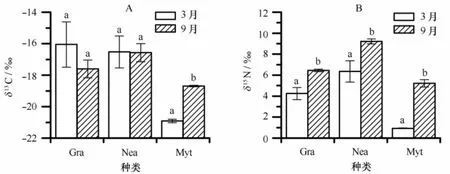
图2 筼筜湖3种底栖动物稳定碳、氮同位素值的季节变动Fig.2 Seasonal shifts in carbon and nitrogen stable isotope values of three species of macrozoobenthos in the Yundang Lagoon
一般认为,海源浮游植物的δ13C值介于-23.3‰~-18.0‰之间,δ15N值介于3.3‰~11.1‰之间(表4)。筼筜湖3月份POM的δ13C值在-24‰左右,δ15N值为-1.6‰,落在这个范围之外,这可能与引入筼筜湖的西海域海水中含有大量的陆源有机碎屑有关。陆源碎屑以陆生维管束植物为主,其δ13C和δ15N相对贫化(介于-27.1‰~26.5‰和1.8‰~3.5‰,表4)。在厦门海域,最大的陆源径流为位于厦门岛西南面的九龙江,位于筼筜湖的西侧(见图1),九龙江水通过潮流的混合作用会进入筼筜湖。先前在引水渠POM的各项化学指标及其稳定同位素组成的调查中也发现,从入海口进入筼筜湖的POM的TOC与Chla含量比值大于400(小于100表明浮游植物占主导),碳氮原子比在20左右,远高于浮游植物的水平(6~9),具有典型陆源碎屑物的特征;其δ13C和δ15N值分别为-23.15‰和0.05‰,与陆源碎屑物接近,表明引入筼筜湖的海水中含有大量的陆源有机碎屑[19]。此外,在筼筜湖上游的干渠和松柏湖,常有大量未经处理的生活废水以及餐饮业污水的排入。城市废水有明显贫化的δ13C和δ15N(介于-26.7‰~-24.7‰和-4.5‰~2.3‰,表4)。一般认为,排放入海的城市废水如果只经过初级处理过程(如,筛网拦截和沙滤塔过滤),其δ15N一般在0‰左右。这样,大量的生活污水以及餐饮业废水与进入筼筜湖的含有大量陆源有机碎屑的西海域海水相混合使得筼筜湖POM的δ13C和δ15N明显贫化。但是,随着水温的升高,大型海藻消亡,湖区内浮游植物开始大规模生长,POM中δ13C和δ15N明显富集的内源性浮游植物贡献的迅速增加,使POM的δ13C和δ15N值增加。

表4 不同有机物源的稳定同位素组成Tab.4 Carbon and nitrogen stable isotope values of organic sources from other studies
和浮游植物相比,BM有着相对富集的δ13C,其δ13C值介于-22.2‰~-12.1‰之间(表4),本研究BM的δ13C值也落在这个范围之内。9月份BM的δ13C值远高于3月,可能与9月份较高的辐射水平有关。更高的辐射水平使初级生产者有更高的碳需求,导致初级生产者更低的δ13C代谢以及随之而来δ13C的富集[20-22]。此外,不同时期初级生产者利用碳源的差异也会引起δ13C的变化。HCO-3和CO2的稳定碳同位素的值分别是0和-7.8%,冬季低的温度会使海水中CO2溶解度的增加,引起δ13C值的下降[23]。
和其他食源相比,石莼的δ13C值最为富集,约-12‰,这与Lin等[24]在台湾七股潟湖的研究结果相近。通过镜检,石莼表面的Epi主要以BM为主,还包括大量的细菌和有机碎屑,其δ13C值约为-17.61‰。尽管先前少有研究关注海藻表面附生植物的稳定同位素组成,但Currin等[25]和Moncreiff和Sullivan[26]等研究显示,互米花草Spartina alterniflora和二药藻Halodule wrightii表面附生植物的δ13C分别介于-17.6‰~-13.0‰和-19.7‰~-15.2‰(均值17.5‰),本研究的结果与之相近,但低于Jaschinski等[27]报道的大叶藻Zostera marina附生植物的δ13C值(见表4)。
4.2 筼筜湖几种底栖动物及其食源之间的营养关系
筼筜湖几种底栖动物及其潜在食源的δ13C-δ15N关系如图3所示。沙筛贝是典型的滤食性软体动物,它的δ13C与POM相近也证实了这一点(图3)。不过,沙筛贝与POM之间δ13C值的差异高达2.9‰(3月)和1.6‰(9月),表明沙筛贝还有其他δ13C相对富集的食物来源。图3A的结果显示,石莼来源的有机碎屑可能是3月份沙筛贝δ13C富集的重要原因。虽然Kanaya等,Page和Lastra与Yokoyama等的研究表明,来自沉积物表层再悬浮的BM可能也是滤食者的重要食物来源[12,16,35,37]。但是3月份石莼的丰度很高[17],它覆盖在沉积物表面,不易引起底栖硅藻的再悬浮。而且,3月份BM比沙筛贝显著富集的δ15N(Δδ15N=4.2‰)表明BM对这时期沙筛贝的食源贡献低。9月份,大型海藻消亡,表层沉积物裸露,水深较浅的区域在风和水流的作用下容易引起BM的再悬浮,BM对沙筛贝的食源贡献增加。
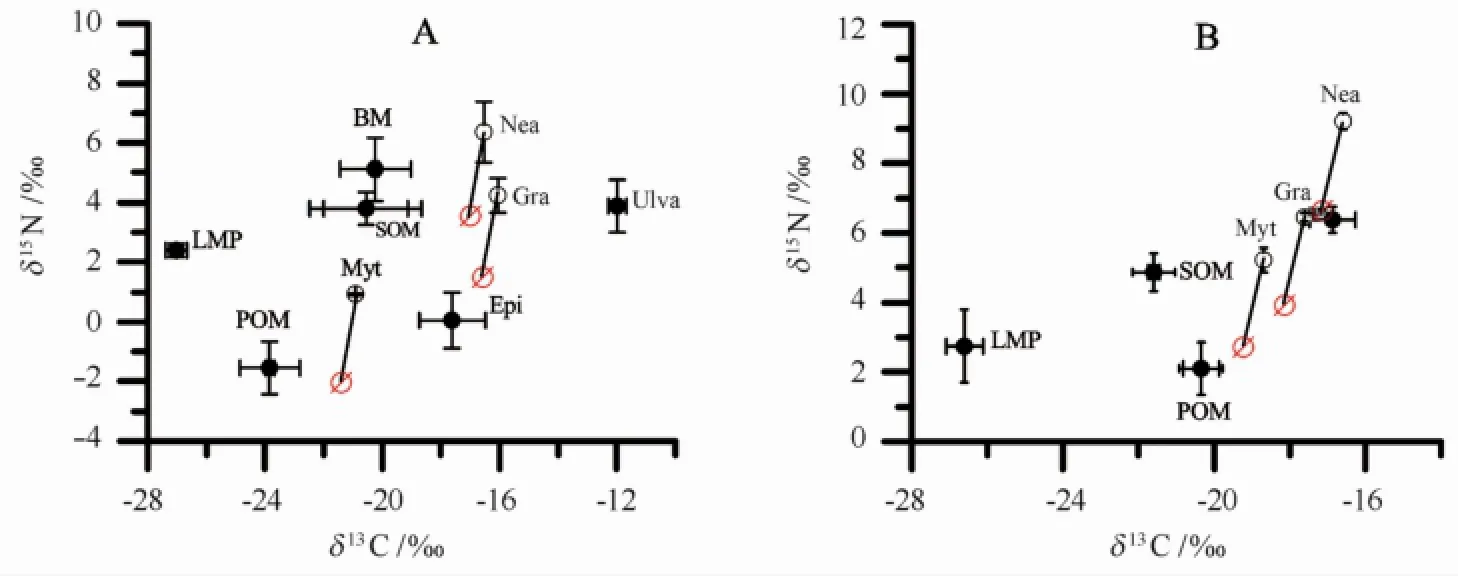
图3 筼筜湖几种底栖动物及其潜在食源的δ13C-δ15N关系图Fig.3 Carbon and nitrogen stable isotope plots of macrozoobenthos and their food sources in the Yundang Lagoon
3月份日本大螯蜚的δ13C值介于Ulva和Epi之间,表明Ulva和Epi是3月份日本大螯蜚的主要碳源,它们对日本大螯蜚的食源贡献率分别40.6%和37.6%。9月份日本大螯蜚食性发生明显的变化,其δ13C值介于POM和BM之间,表明这时期的日本大螯蜚以POM和BM为食。关于日本大螯蜚食性的报道较多[12,38],Aikins和Kikuchi发现,日本大螯蜚能选择性摄食江蓠Gracilaria vermiculophy lla表面的直链藻Melosira和舟形藻Nitzschia[38]。Kanaya等利用稳定同位素方法也证实日本大螯蜚以海藻表面的附生硅藻为食[12]。陈红星等报道,日本大螯蜚甚至能摄食贝肉等动物性饵料[39]。可见,日本大螯蜚的食性多变,既可以是动物食性,也可以植物食性,且其食性易受环境饵料可利用性的影响。
在3月,腺带刺沙蚕的δ13C值介于Ulva和Epi之间(见图3A),其潜在食源的δ15N值约3.9‰(6.4‰-TEF(约2.52‰)),与Ulva(3.89‰)相近,表明冬春季腺带刺沙蚕主要以Ulva和Epi为食,它们对腺带刺沙蚕的食源贡献率分别为39.7%和30.7%(表5,图3A)。而在2010年9月,虽然腺带刺沙蚕的δ13C值虽然与2010年3月没有显著的差异,不过,腺带刺沙蚕的食性发生了变化。其δ13C值比SOM富集,但与BM相近(Δδ13C=0.82‰),其δ15N值比BM富集2.99‰(见图3B),接近一个营养级的水平,表明这时期的腺带刺沙蚕选择性同化沉积物表面的BM。Kanaya等在日本圣代湾Idoura潟湖的研究也发现,食碎屑多毛类的δ13C(-18.4‰~-12.4‰)明显比SOM(-25‰)富集,表明多毛类对SOM的不同组分有选择性同化的能力,BM对多毛类食源组成的贡献高达45%~100%[7]。Kanaya等在Gamo潟湖的研究也发现,小头虫Capitellasp.主要的碳源也是沉积物中的BM[12]。多毛类选择性摄食或同化SOM库(SOM pool)中营养价值更高的BM,可能与这些多毛类体内缺少同化木质素的酶有关。

表5 不同食源对筼筜湖3月份日本大螯蜚和腺带刺沙蚕饵料组成的贡献(%)Tab.5 Contribution of potential food sources to the diet ofG.japonicaandN.japonicain March in the Yundang Lagoon
4.3 环境饵料丰度的变化对消费者食性的影响
本研究的结果显示,筼筜湖3种常年分布的大型底栖动物的δ15N都出现明显的季节变化(见图2),其δ15N的差值分别在2.2‰~4.3‰之间。这并不是这些消费者摄入动物性饵料或它们的营养级发生了变化,而是由于它们食源稳定同位素的季节性波动以及食性的季节变化引起的。而不同季节消费者食性的差异则受到不同时期环境食物可利用性的影响。3月份,筼筜湖正处于大型海藻大规模爆发和生长的时期[17],沉积物表层被大型海藻所覆盖,由于光线的遮蔽作用,沉积物表层BM的生物量和生产力相对较低,此时环境中最主要的饵料来源是石莼及其表面的附生生物。随着水温的升高,大型海藻消亡[17],充足的营养供给使得夏秋季浮游植物开始大量生长[18],这时期环境中消费者可利用的食物以浮游植物来源的POM和BM为主。这样,环境食物丰度激烈的季节变化必然对那些常年分布的消费者的食性产生影响。以腺带刺沙蚕为例,3月份它主要以石莼及其表面的附生生物为食,9月份腺带刺沙蚕食物摄入δ15N明显富集的BM,以此相对应,9月采集的腺带刺沙蚕则有更高的δ15N值。类似的结果也被Doi等报道[11]。Doi等发现日本Kitakami河口大型底栖动物的食性存在明显的空间变化特征。溯河而上的不同站位,由于其空间和水文条件的差异,消费者可利用食物的丰富度存在明显的变化。在芦苇分布密集的区域,由于光线的遮蔽作用,底栖硅藻的生产力低,因此它对底栖消费者的贡献也较低;相反,在无大型植被遮蔽的区域,底栖硅藻的食源贡献更高[11]。事实上,系统内不同食源对消费者的贡献与其在系统内的分布和生物量密切相关[1,31]。环境饵料丰度的变化,使得消费者可利用的食源发生了改变,那些对环境变化适应能力强的种类,必将通过调整自己的“食谱”适应环境的变动。
[1] Baeta A,Pinto R,Valiela I,et al.δ15Nandδ13C in the Mondego estuary food web:Seasonal variation in producers and consumers[J].Marine Environmental Research,2009,67(3):109-116.
[2] Maksymowska D,Richard P,Piekarek-Jankowska H,et al.Chemical and isotopic composition of the organic matter sources in the Gulf of Gdansk(Southern Baltic Sea)[J].Estuarine,Coastal and Shelf Science,2000,51(5):585-598.
[3] Carlier A,Riera P,Amouroux J M,et al.Food web structure of two Mediterranean lagoons under varying degree of eutrophication[J].Journal of Sea Research,2008,60(4):264-275.
[4] Cebrian J.Grazing on benthic primary producers[M]//Nielsen S L,Banta G T,Pedersen M F.Estuarine Nutrient Cycling:The Influence of Primary Producers.Netherlands:Springer,2004:153-185.
[5] Albertoni E F,Palma-Silva C,Esteves F A.Macroinvertebrates associated with Chara in a tropical coastal lagoon(Imboassica Lagoon,Rio de Ja-neiro,Brazil)[J].Hydrobiologia,2001,457(1/3):215-224.
[6] Fox S E,Teichberg M,Olsen Y S,et al.Restructuring of benthic communities in eutrophic estuaries:lower abundance of prey leads to trophic shifts from omnivory to grazing[J].Marine Ecology Progress Series,2009,380:43-57.
[7] Kanaya G,Kikuchi E.Spatial changes in a macrozoobenthic community along environmental gradients in a shallow brackish lagoon facing Sendai Bay,Japan[J].Estuarine,Coastal and Shelf Science,2008,78(4):674-684.
[8] Kanaya G,Suzuki T,Kikuchi E.Spatio-temporal variations in macrozoobenthic assemblage structures in a river-affected lagoon(Idoura Lagoon,Sendai Bay,Japan):influences of freshwater inflow[J].Estuarine,Coastal and Shelf Science,2011,92(1):169-179.
[9] Little C.The Biology of Soft Shores and Estuaries[M].London:Oxford University Press,2000.
[10] Shimoda K,Aramaki Y,Nasuda J,et al.Food sources for three species of Nihonotrypaea(Decapoda:Thalassinidea:Callianassidae)from western Kyushu,Japan,as determined by carbon and nitrogen stableisotopeanalysis[J].Journal of Experimental Marine Biology and Ecology,2007,342(2):292-312.
[11] Doi H,Matsumasa M,Toya T,et al.Spatial shifts in food sources for macrozoobenthos in an estuarine ecosystem:carbon and nitrogen stable isotope analyses[J].Estuarine,Coastal and Shelf Science,2005,64(2/3):316-322.
[12] Kanaya G,Takagi S,Kikuchi E.Spatial dietary variations inLaternula marilina(Bivalva)andHedistespp.(Polychaeta)along environmental gradients in two brackish lagoons[J].Marine Ecology Progress Series,2008,359:133-144.
[13] 林光辉.稳定同位素生态学[M].北京:高等教育出版社,2013.
[14] Vander Zanden M J,Rasmussen J B.Variation inδ15N andδ13C trophic fractionation:implications for aquatic food web studies[J].Limnology and Oceanography,2001,46(8):2061-2066.
[15] Tsuchiya M,Kurihara Y.The feeding habits and food sources of the deposit-feeding polychaete,Neanthes japonica(Izuka)[J].Journal of Experimental Marine Biology and Ecology,1979,36(1):79-89.
[16] Yokoyama H,Sakami T,Ishihi Y.Food sources of benthic animals on intertidal and subtidal bottoms in inner Ariake Sound,southern Japan,determined by stable isotopes[J].Estuarine,Coastal and Shelf Science,2009,82(2):243-253.
[17] 郑新庆,黄凌风,王蕾,等.筼筜湖大型海藻群落的几种藻栖端足类的种群动态研究[J].厦门大学学报(自然科学版),2011,50(5):928 -933.
[18] 李娟,黄凌风,郭丰,等.细基江蓠对氮、磷营养盐的吸收及其对赤潮发生的抑制作用[J].厦门大学学报,2007,46(2):221-225.
[19] 郑新庆,黄凌风,杜建国,等.筼筜湖绿潮期间颗粒有机物及沉积有机物的来源研究[J].海洋学报,2013,35(5):102-111.
[20] Cooper L W,DeNiro M J.Stable carbon isotope variability in the seagrassPosidoniaoceanica:Evidence for light intensity effects[J].Marine E-cology Progress Series,1989,50:225-229.
[21] Durako M,Hall M.Effects of light on the stable carbon isotope composition of the seagrassThalassia testudinum[J].Marine Ecology Progress Series,1992,86:99-101.
[22] Grice A M,Loneragan N R,Dennison W C.Light intensity and the interactions between physiology,morphology and stable isotope ratios in five species of seagrass[J].Journal of Experimental Marine Biology and Ecology,1996,195(1):91-110.
[23] Hofmann M,Wolf-Gladrow D A,Takahashi T,et al.Stable carbon isotope distribution of particulate organic matter in the ocean:a model study[J].Marine Chemistry,2000,72(2/4):131-150.
[24] Lin H J,Kao W Y,Wang Y T.Analyses of stomach contents and stable isotopes reveal food sources of estuarine detritivorous fish in tropical/subtropical Taiwan[J].Estuarine,Coastal and Shelf Science,2007,73(3/4):527-537.
[25] Currin C A,Newell S Y,Paerl H W.The role of standing deadSpartina alternifloraand benthic microalgae in salt marsh food webs:considerations based on multiple stable isotope analysis[J].Marine Ecoogy Progress Series,1995,121:99-116.
[26] Moncreiff C A,Sullivan M J.Trophic importance of epiphytic algae in subtropical seagrass beds:evidence from multiple stable isotope analyses[J].Marine Ecology Progress Series,2001,215:93-106.
[27] Jaschinski S,Brepohl D C,Sommer U.Carbon sources and trophic structure in an eelgrassZostera marinabed,based on stable isotope and fatty acid analyses[J].Marine Ecology Progress Series,2008,358:103-114.
[28] Gaston T F,Suthers I M.Spatial variation inδ13Candδ15N of liver,muscle and bone in a rocky reef planktivorous fish:the relative contribution of sewage[J].Journal of Experimental Marine Biology and Ecology,2004,304(1):17-33.
[29] Thornton S F,McManus J.Application of organic carbon and nitrogen stable isotope and C/N ratios as source indicators of organic matter provenance in estuarine systems:evidence from theTay estuary,Scotland[J].Estuarine,Coastal and Shelf Science,1994,38(3):219-233.
[30] Middelburg J J,Nieuwenhuize J.Carbon and nitrogen stable isotopes in suspended matter and sediments from the Schelde Estuary[J].Marine Chemistry,1998,60(3/4):217-225.
[31] Shang X,Zhang GS,Zhang J.Relative importance of vascular plants and algal production in the food web of aSpartina-invaded salt marsh in the Yangtze River estuary[J].Marine Ecology Progress Series,2008,367:93-107.
[32] Choy EJ,Richard P,Kim K-R,et al.Quantifying the trophic base for benthic secondary production in the Nakdong River estuary of Korea usingstable Cand N isotopes[J].Journal of Experimental Marine Biology and Ecology,2009,382(1):18-26.
[33] Haines E B.Stable carbon isotope ratios in the biota,soils and tidal water of a Georgia salt marsh[J].Estuarine and Coastal Marine Science,1976,4(6):609-616.
[34] Carlier A,Riera P,Amouroux J M,et al.A seasonal survey of the food web in the Lapalme Lagoon(northwestern Mediterranean)assessed by carbon and nitrogen stable isotope analysis[J].Estuarine,Coastal and Shelf Science,2007,73(1/2):299-315.
[35] Page H M,Lastra M.Diet of intertidal bivalvesin the Ria de Arosa(NWSpain):evidence from stable Cand Nisotope analysis[J].Marine Biology,2003,143(3):519-532.
[36] Martinetto P,Teichberg M,Valiela I.Coupling of estuarinebenthic and pelagic food webs to land-derived nitrogen sources in Waquoit Bay,Massachusetts,USA[J].Marine Ecology Progress Series,2006,307:37-48.
[37] Kanaya G,Nobata E,Toya T,et al.Effects of different feeding habits of three bivalve species on sediment characteristics and benthic diatom abundance[J].Marine Ecology Progress Series,2005,299:67-78.
[38] Aikins S,Kikuchi E.Grazing pressure by amphipods on microalgaein Gamo Lagoon,Japan[J].Marine Ecology Progress Series,2002,245:171 -179.
[39] 陈红星,闫启仑,韩明辅,等.室内培养底栖端足类日本大螯蜚饵料研究[J].海洋环境科学,1998,17(1):21-25.
Seasonal shifts in food sources influence feeding habits of three macrozoobenthos species in the Yundang Lagoon:the evidence from stable isotope
Zheng Xinqing1,Huang Lingfeng2,Lin Rongcheng1
(1.Third Institute of Oceanography,State Oceanic Administration,Xiamen361005,China;2.College of the Environment and Ecology,Xiamen University,Xiamen361005,China)
Carbon and nitrogen stable isotope(δ13Candδ15N,respectively)analysis were made on three species of lagoon macrozoobenthos(suspension feederMytilopsis sallei,and deposit feedersGrandidierella japonicaandNeanthesjaponica)and their food sources in March and September in order to examine the influence of seasonal shifts in food sources to their feeding habits.The results showed that there is a significant difference inδ13Candδ15N of POM observed.Due to the large input of terrestrial debris and the sewage water discharged by the catering industry around the lagoon,lagoon POM in March was characterized by depleted-δ13Candδ15N.However,the contribution of phytoplankton increased in September as temperature increased.M.salleiwas a typical benthic filterfeeder as suggested by theδ13C values closest to POM.However,it displayed a little more enriched inδ13C than POM,indicating that it may assimilate otherδ13C-enriched organic matters,perhaps the debris fromUlva lactucain March and benthic microalgae in September.Deposit feederG.japonicaandN.japonicamainly fed onU.lactucaand its associated epiphytes in March while obtained the carbon sources from benthic microalgae and phytoplankton in September.Our results indicated the significantly seasonal variations inδ15N for three macrozoobenthos species with theΔδ15N between 2.2‰and 4.3‰,which may be caused by seasonal shifts of the stable isotope of food sources and their feeding habits.The differences of feeding habits for these macrozoobenthos were strongly affected by food availabilities in the lagoon.
Macrozoobenthos;seasonal shifts;feeding habits;stable isotope;Yundang Lagoon
Q145.2
A
0253-4193(2014)12-0032-09
郑新庆,黄凌风,林荣澄.环境饵料丰度的季节变化对筼筜湖3种大型底栖动物食性的影响——来自稳定同位素的证据[J].海洋学报,2014,36(12):32—40,
10.3969/j.issn.0253-4193.2014.12.003
Zheng Xinqing,Huang Lingfeng,Lin Rongcheng.Seasonal shifts in food sources influence feeding habits of three macrozoobenthos species in the Yundang Lagoon:the evidence from stable isotope[J].Acta Oceanologica Sinica(in Chinese),2014,36(12):32—40,doi:10.3969/j.issn.0253-4193.2014.12.003
2014-04-18;
2014-06-02。
福建省自然科学基金(2014J01127);国家海洋公益性行业科研经费资助项目(201105012,201205009-3)。
郑新庆(1983—),男,福建省泉州市人,助理研究员,博士,从事海洋生态学研究。E-mail:zhengxinqing@tio.org.cn
*通信作者:黄凌风,男,教授。E-mail:huanglf@xmu.edu.cn

