环腺苷酸拟似物 8-CPT-cAMP诱导骨髓瘤细胞凋亡的实验研究
上海交通大学医学院附属第九人民医院血液内科,上海 200011
环腺苷酸拟似物 8-CPT-cAMP诱导骨髓瘤细胞凋亡的实验研究
杭海芳 王莹莹 朱琦
上海交通大学医学院附属第九人民医院血液内科,上海 200011

朱琦,医学博士,主任医师,硕士生导师。现任上海交通大学医学院附属第九人民医院血液科主任,中华医学会上海分会血液学专科委员会委员,上海市中西医结合血液病专业委员会常务委员,上海血液学研究所副所长。2003年赴新加坡中央医院血液病治疗中心担任外籍医师,在血液病,尤其是恶性血液病的诊断和治疗方面具有较丰富的临床经验。曾先后主持上海市科委自然基金、上海市卫生局基金和高等学校青年科学基金等课题多项,并作为主要参与者参加多项国家自然科学基金面上项目。先后获上海市政府颁发的自然科学一等奖、上海市医学科技奖一等奖、中华人民共和国教育部自然科学奖一等奖和中华医学一等奖等奖项。迄今为止已在国内外核心期刊以第一作者或通信作者发表论文40余篇,其中SCI收录6篇,参编血液病专著3部。
背景与目的:多发性骨髓瘤(multiple myeloma,MM)患者经标准方案治疗后缓解率虽高,但其缓解后复发及对化疗药物耐药性的产生较普遍。通过调变细胞内环腺苷酸浓度可以诱导多种肿瘤细胞增殖阻滞和凋亡,成为肿瘤治疗新途径。本研究观察环腺苷酸拟似物8-对氯苯硫基环腺苷酸[8-(4-chlorophenylthio) adenosine 3’,5’-cyclic monophosphate,8-CPT-cAMP]对MM细胞生物学行为的影响,探讨其诱导MM细胞凋亡的可能机制,为开发临床MM治疗新药提供研究方向。方法:以不同浓度8-CPT-cAMP处理MM细胞系U266,用细胞计数试剂盒-8(cell counting kit-8,CCK-8)检测其增殖,流式细胞仪检测细胞周期、凋亡率和线粒体跨膜电位的变化,实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-PCR)、蛋白质印迹法(Western blot)分别检测凋亡相关基因caspase-8、caspase-9、Bcl-2和Bax的转录及Bcl-2、Bax蛋白的表达。结果:U266细胞经不同浓度8-CPT-cAMP处理5 d后,生长受到明显抑制,呈浓度和时间依赖性;伴随作用时间延长,8-CPT-cAMP的半数有效抑制浓度(IC50)明显减低,第5天可达58.52 μmol/L。U266细胞周期在8-CPT-cAMP浓度增加的状态下逐渐停滞在G0/G1期;各浓度组细胞增殖抑制率、凋亡率与对照组相比差异均有统计学意义(P<0.05)。同时8-CPT-cAMP能够诱导U266细胞线粒体跨膜电位下降;此外,经8-CPT-cAMP处理48和72 h后,不同浓度U266细胞Bcl-2 mRNA及蛋白表达较对照组明显下降(P<0.05),caspase-9、Bax mRNA及 Bax蛋白表达明显升高(P<0.05),而caspase-8 mRNA表达与对照组比较无明显差异。结论:8-CPT-cAMP能够抑制骨髓瘤细胞增殖并诱导其凋亡,呈时间和浓度依赖性;该效应可能通过caspase依赖的线粒体诱导细胞凋亡途径来实现。
环腺苷酸;骨髓瘤;细胞凋亡
多发性骨髓瘤(multiple myeloma,MM)是浆细胞克隆增殖性疾病,为常见血液系统恶性肿瘤,发病率仅次于非霍奇金淋巴瘤。随着早期诊断及治疗手段的提高,MM患者临床缓解率和生存时间较以往有明显改善,但其缓解后复发及对化疗药物耐药性的产生仍较普遍[1]。因此,寻找骨髓瘤新型药物靶标对改善MM患者预后至关重要。研究发现,环腺苷酸(cyclic adenosine monophosphate,cAMP)衍生物对多种肿瘤细胞具有促凋亡作用,是一类极具临床价值的细胞凋亡诱导剂[2-3]。鉴于此,本研究以骨髓瘤细胞系U266为体外模型,探讨cAMP拟似物8-对氯苯硫基环腺苷酸[8-(4-chlorophenylthio) adenosine 3’,5’-cyclic monophosphate,8-CPT-cAMP]对U266细胞的促凋亡效应及其可能机制。
1 材料和方法
1.1 细胞培养和形态学观察
MM细胞株U266由上海交通大学医学院病理与病理生理学教研室提供。将2×105个/mL的U266细胞接种于含10%胎牛血清、100 μg/mL青霉素,100 μg/mL链霉素和2 mmol/mL谷氨酰胺的RPMI-1640培养液(美国Sigma公司)中,常规条件下培养(37 ℃,CO2体积分数为5%,95%湿度)48 h后抽取部分细胞进行细胞涂片仪(Shandon)涂片,瑞士蓝染色,光镜下观察其细胞形态,并以Image-Pro Plus软件拍摄图像。
1.2 细胞计数试剂盒-8(cell counting kit-8,CCK-8)法检测细胞增殖抑制率
取对数生长期的U266细胞,按2×105个/mL密度接种于96孔板,每孔100 μL。实验组分别加入终浓度为100、200、300和400 μmol/L的8-CPT-cAMP(美国Santa Cruz公司),同时设溶剂对照组(加入含0.1% DMSO的无血清IMDM培养基)和空白对照组,每组3个复孔。置于37 ℃、CO2体积分数为5%饱和湿度培养箱中,培养48、72、96及120 h后每孔分别加入10 μL CCK-8溶液(同仁化学研究所,日本),混匀,继续培养4 h,酶标仪振荡,以空白对照孔调零,测450 nm处各孔吸光度(A)值。按公式:细胞增殖抑制率(%)=(1-A实验组/A对照组)×100% 进行计算。
1.3 流式细胞仪检测细胞周期、凋亡率和线粒体跨膜电位
1.3.1 细胞周期检测
分别收集上述不同浓度处理的细胞,PBS洗涤后加入75%乙醇,-20 ℃固定过夜;加入1×PBS 10 mL混匀,2 500 r/min离心5 min,离心半径8.5 cm,洗涤2次,分别加入100 mg/mL Rnase 37 ℃温育30 min;采用100 μg/mL碘化丙啶(propidium iodide,PI)染色后行流式细胞仪检测。所有数据由Beckman Couler公司的Multicycle软件收集、存储和分析。
1.3.2 细胞凋亡率检测
根据Annexin-Ⅴ/FITC凋亡检测试剂盒(BD,SanDiego,CA)说明,将不同处理组细胞PBS洗涤后加入1 mL结合缓冲液,漂洗细胞1次。依次加入100 μL结合缓冲液及3 μL Annexin-Ⅴ/ FITC,重悬混匀,避光温育15 min,再加入3 μL PI,避光温育3 min;每管加入结合缓冲液350 μL,1 h内进行流式细胞仪检测。
1.3.3 线粒体跨膜电位检测
将对照及各组U266细胞以1 mL培养液重悬。按照线粒体凋亡检测试剂盒(Biovision)说明,分别加入10 μg/mL线粒体凋亡检测试剂罗丹明(Rh123),并于37 ℃饱和湿度的培养箱中温育30 min,2 500 r/min离心5min,离心半径8.5cm,去除上清液,PBS洗涤1次。以250 μg/mL PI染色,流式细胞仪检测,Rh123/PI荧光强度即为线粒体跨膜电位。
1.4 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RTPCR)检测细胞凋亡相关基因mRNA表达
以4×105个/mL密度接种U266细胞于6孔板。实验组加入200 μmol/L 8-CPT-cAMP,对照组加入0.5%DMSO,每孔设复孔2个;置37 ℃饱和湿度培养箱培养72 h后收集细胞,抽提细胞总RNA逆转录,进行PCR扩增;PCR循环参数为:95 ℃变性5 s,60 ℃退火,延伸40 s,共40个循环。检测细胞caspase-8、caspase-9、Bcl-2和Bax基因的表达(各基因上下游引物见表1),△Ct=Ct各组的值-CtGAPDH值,以2-△△Ct方法计算基因表达量。
1.5 蛋白质印迹法(Western blot)检测细胞凋亡相关蛋白表达
在PBS洗涤后的各组 U266细胞中加入细胞裂解液提取总蛋白,经考马斯亮蓝定量后,取各组等量总蛋白进行8%~15%SDS聚丙烯酰胺凝胶垂直电泳,常规转膜;膜经10%脱脂奶粉(含0.1% Tween-20)室温封闭1 h,加入相应一抗(包括Bcl-2和Bax),4 ℃过夜;经含0.1% Tween-20的PBS充分洗涤后与相应稀释度的二抗室温反应30 min,依据ECL试剂盒(Amersham Pharmacia Biotech,England)显色扫描保存。所用抗体均购自Santa Cruz公司。
1.6 统计学处理
采用SPSS 11.0软件包进行统计分析,成组设计t检验法比较各组间差异。结果以表示。P<0.05为差异有统计学意义。
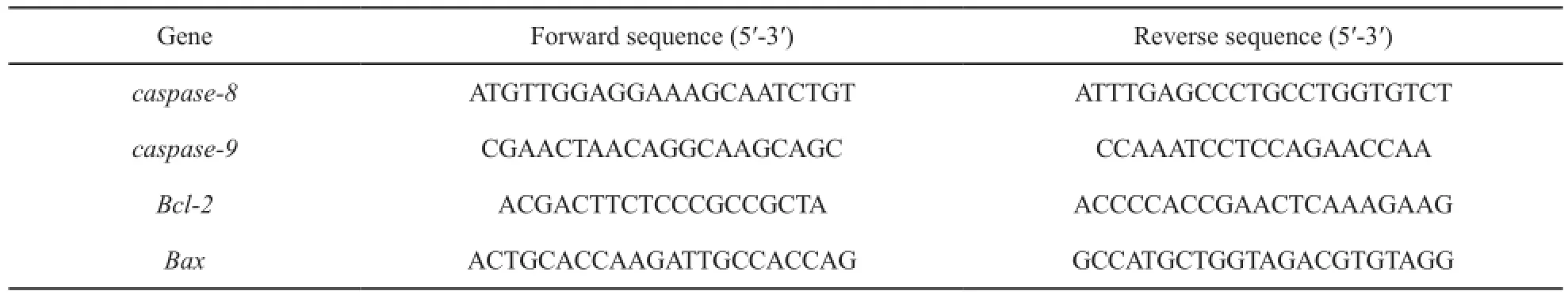
表1 RT-PCR引物序列Tab. 1 Primer sequences of RT-PCR
2 结 果
2.1 8-CPT-cAMP对U266细胞增殖的影响
骨髓瘤细胞株U266经不同浓度(100、200、300和400 μmol/L)8-CPT-cAMP处理5 d后,细胞生长受到明显抑制,活力也有明显变化,且呈浓度和时间依赖性。400 μmol/L 8-CPT-cAMP处理U266第5天,U266细胞几乎全部凋亡;且伴随作用时间延长,8-CPT-cAMP的半数有效抑制浓度(IC50)呈明显减低趋势。各组细胞抑制率与对照组间差异均有统计学意义(P<0.05,表2)。
2.2 8-CPT-cAMP对U266细胞周期、凋亡率及线粒体跨膜电位凋亡的影响
采用不同浓度8-CPT-cAMP(100、200、300和400 μmol/L)处理U266细胞72 h。结果如表3所示:随着药物浓度的增加,U266细胞G0/ G1期细胞逐渐增多,而G2/M期及S期细胞逐渐减少,与空白对照组相比,差异有统计学意义(P<0.05)。进一步以Annexin-Ⅴ/PI双染法比较各实验组与对照组细胞凋亡率,差异均有统计学意义(P<0.05)。Rh123是一种亲脂性阳离子荧光染料,可发射绿色荧光被线粒体吸收,其吸收量与△Ψm呈正比。U266经PI和Rh123双染后分为PI-Rh123high、PI-Rh123low和PI+Rh123low共3个亚群,分别代表正常细胞(△Ψm正常,膜完整)、凋亡细胞(△Ψm崩溃,膜尚完整)和死亡细胞(△Ψm崩溃,膜破坏)。经不同浓度8-CPT-cAMP处理的U266细胞,PI-Rh123low染色相比对照组均明显增强(P<0.05),且有明显浓度依赖性。
2.3 8-CPT-cAMP对U266细胞内凋亡调控因子mRNA表达的影响
不同浓度U266细胞分别经8-CPT-cAMP处理48和72 h后,Bcl-2 mRNA表达量较溶剂对照组明显下降(P<0.05),caspase-9及Bax mRNA表达较溶剂对照组升高(P<0.05),而caspase-8 mRNA表达与对照组比较,差异无统计学意义(P>0.05,表4) 。
2.4 8-CPT-cAMP对U266细胞内凋亡调控因子蛋白表达的影响
Western blot检测结果显示,相比溶剂对照组,不同浓度8-CPT-cAMP(200、300和400 μmol/L)处理U266细胞 72 h 后,Bcl-2表达水平显著下调,而Bax表达则逐渐增强(图1)。
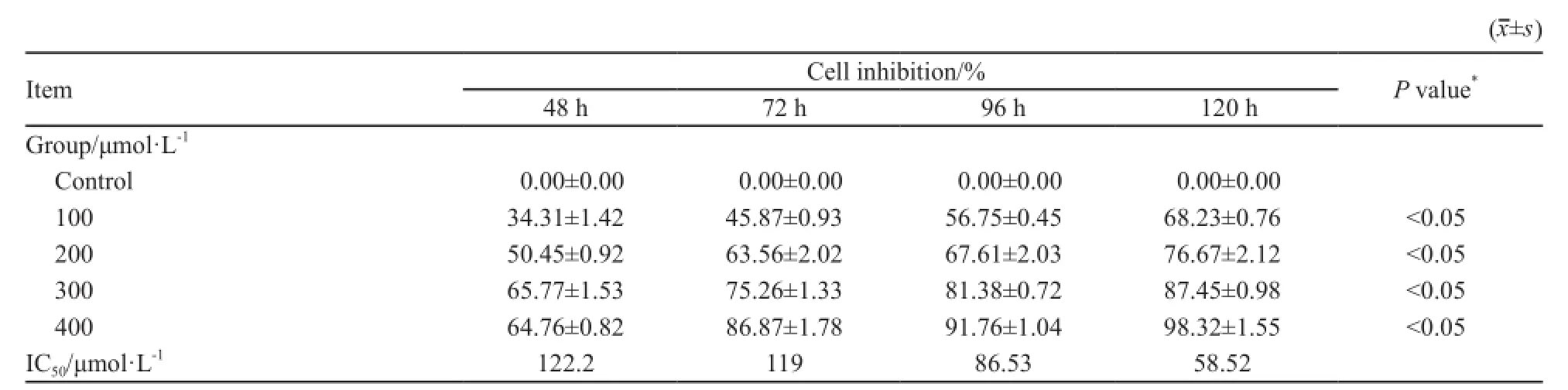
表2 8-CPT-cAMP作用5 d后U266细胞增值活性的影响Tab. 2 Effect of 8-CPT-cAMP on the survival of myeloma cell lines
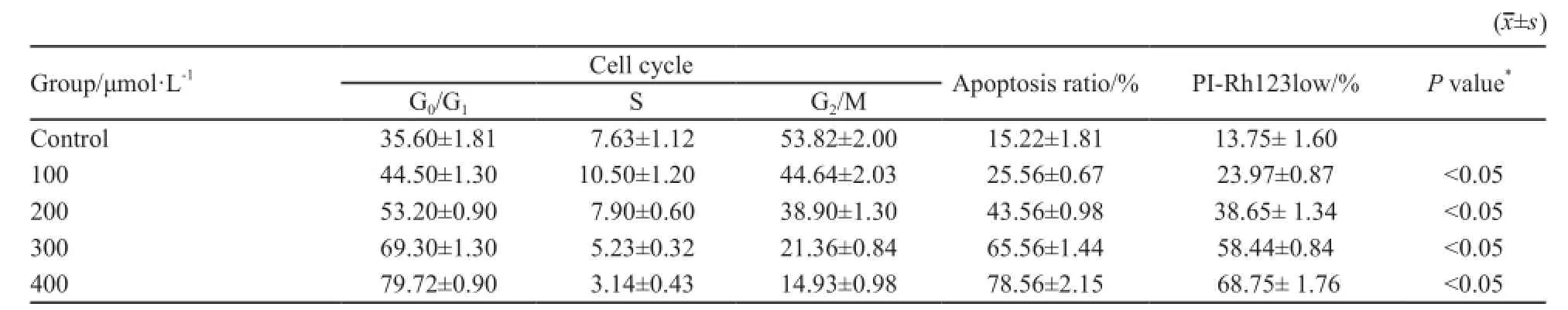
表3 8-CPT-cAMP对U266细胞周期、凋亡率及线粒体跨膜电位凋亡的影响Tab. 3 Sensitivity of MM cell lines to 8-CPT-cAMP
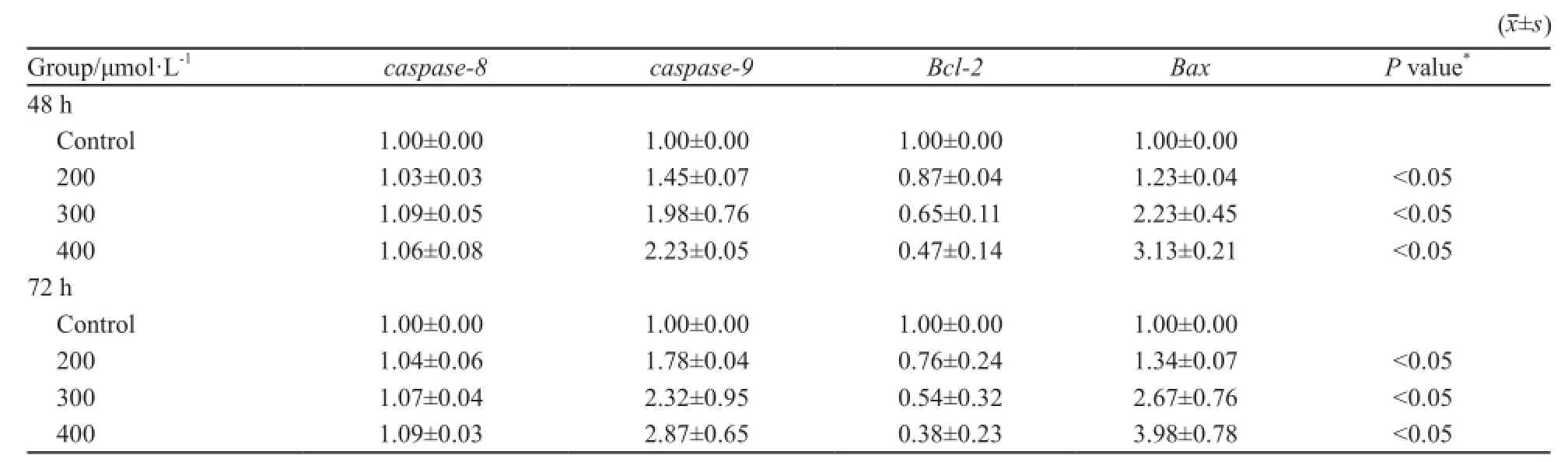
表4 8-CPT-cAMP对U266细胞基因表达水平的影响Tab. 4 Reactivation of gene expression by 8-CPT-cAMP treatment in myeloma cell lines U266
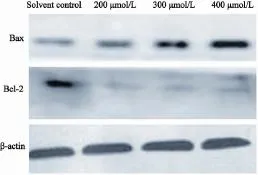
图1 不同浓度8-CPT-cAMP对U266细胞Bcl-2及Bax蛋白表达的影响Fig. 1 The expression of Bax and Bcl-2 protein was tested by Western blot with 8-CPT-cAMP
3 讨 论
cAMP作为信号转导最普遍的第二信使,参与体内多种造血调控因子对造血细胞增殖、分化和凋亡的调节。相对正常组织细胞,肿瘤细胞内cAMP信号通路存在异常变化[4],因而,调变细胞内cAMP信号表达可能成为肿瘤治疗的新途径。
近来研究显示,磷酸二酯酶抑制剂等药物可通过增高细胞内cAMP浓度,诱导恶性淋巴细胞凋亡[5],提示cAMP表达与肿瘤细胞生长密切相关。我们前期研究发现,cAMP拟似物8-氯-cAMP能够诱导骨髓瘤细胞增殖阻滞和凋亡[6],但8-氯-cAMP可能通过其代谢物8-氯-腺苷产生细胞毒作用而非由cAMP信号通路介导。鉴于此,本研究采用能渗入胞膜且不易降解的cAMP拟似物8-CPT-cAMP处理骨髓瘤细胞,观察提高骨髓瘤细胞内cAMP水平对其生物学行为的影响。结果显示,8-CPT-cAMP可阻滞骨髓瘤U266细胞增殖,且绝大多数细胞停滞在G0/G1期,并呈剂量依赖性。同时,经8-CPT-cAMP处理72 h后的U266细胞形态呈现核固缩和凋亡小体等典型凋亡表现,经流式细胞仪检测,细胞发生凋亡。
增殖优势和凋亡受阻是骨髓瘤细胞重要生物学特性。经典细胞凋亡主要包括线粒体途径和死亡受体途径[7]。本实验发现,8-CPT-cAMP可诱导U266细胞线粒体跨膜电位,并呈剂量依赖性,提示8-CPT-cAMP诱导U266细胞凋亡可能是通过细胞内线粒体途径。其次,定量PCR和Western blot检测结果显示,8-CPT-cAMP处理后的U266细胞内Bcl-2抗凋亡因子转录和表达水平显著降低,而Bax促凋亡因子转录和表达明显升高,提示8-CPT-cAMP可能通过上调Bax,同时下调Bcl-2来介导U266细胞凋亡。但其具体作用机制有待进一步研究。
综上所述,8-CPT-cAMP能够抑制U266细胞增殖,促使细胞凋亡。鉴于8-CPT-cAMP主要通过提高细胞内cAMP水平而发挥作用,故针对性设计调变骨髓瘤细胞内cAMP信号表达的药物,可成为骨髓瘤诱导凋亡治疗的新途径。
[1] WANG N, BARTLOW P, OUYANG Q, et al. Recent advances in anti-multiple myeloma drug development[J]. Pharm Pat Anal, 2014, 3(3): 261-277.
[2] INSEL P A, WILDERMAN A, ZHANG L, et al. Cyclic AMP/PKA-promoted apoptosis: Insights from studies of s49 lymphoma cells[J]. Horm Metab Res, 2014, [Epub ahead of print].
[3] LUCCHI S, CALEBIRO D, DE FILIPPIS T, et al. 8-Chlorocyclic AMP and protein kinase A I-selective cyclic AMP analogs inhibit cancer cell growth through different mechanisms[J]. PLoS One, 2011, 6(6): e20785.
[4] MONAHAN T M, MARCHAND N W, FRITZ R R, et al. Cyclic adenosine 3’:5’-monophosphate levels and activities of related enzymes in normal and leukemic lymphocytes[J]. Cancer Res, 1975, 35(9): 2540-2547.
[5] RICKLES R J, PIERCE L T, GIORDANOET T P 3RD, et al. Adenosine A2A receptor agonists and PDE inhibitors: a synergistic multitarget mechanism discovered through systematic combination screening in B-cell malignancies[J]. Blood, 2010, 116(4): 593-602.
[6] CHENG Y M, ZHU Q, YAO Y Y, et al. 8-Chloroadenosine 3’, 5’-monophosphate induces cell cycle arrest and apoptosis in multiple myeloma cells through multiple mechanisms[J]. Oncol Lett, 2012, 4(6): 1384-1388.
[7] FULDA S, DEBATIN K M. Extrinsic versus intrinsic apoptosis pathways in anticancer chemotherapy[J]. Oncogene, 2006, 25(34): 4798-4811.
Experimental study on cAMP analogue 8-CPT-cAMP inducing apoptosis in multiple myeloma cells
HANG Hai-fang, WANG Ying-ying, ZHU Qi
(Department of Hematology, Shanghai Ninth People’s
Hospital Af fi liated to Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China)
ZHU Qi E-mail: zhuqi70@hotmail.com
Background and purpose: Despite the high remission rate in patients with multiple myeloma (MM) after the standard regimen, but often relapsed and resistant. It has been shown that modulation of cAMP can induce cell cycle arrest and apoptosis in a variety of tumor cells, which has become an interesting approach to cancer therapy. This study aimed to investigate possible effects of cyclic adenosine monophosphate (cAMP) analogue 8-(4-chlorophenylthio) adenosine 3’, 5’-cyclic monophosphate (8-CPT-cAMP) on multiple myeloma cells, provide direction to develop new drugs for the treatment of MM. Methods: The myeloma cell line U266 cells were treated with 8-CPT-cAMP of different concentrations. The proliferation of U266 cells was evaluated through cell counting kit (CCK-8) assay, fl ow cytometry was used to analyze the changes of cell were distribution, apoptosis rate as well as mitochondrial transmembrane potential (ΔΨm) in U266 cells before and after the treatment. Meanwhile, real-time quantitative polymerase chain reaction (RT-PCR) and Western blot assay were used to detect expression levels of apoptosis regulators including caspase-8, caspase-9, Bcl-2 and Bax genes in U266 cells before and after the treatment. Results: The U266 cells were treated 5 days with 8-CPT-cAMP of different concentration, it was shown that 8-CPT-cAMP could signi fi cantly inhibit cell growth of U266 cells in a concentration and time dependent manner, the IC50of 8-CPT-cAMP was reduced obvious prolonged reaction time, and reached to 58.52 μmol/L in the fi fth day. The cell cycle of U266 cells was stopped in G0/ G1stage as the progress of concentration. It was showed statistical signi fi cant difference associated with the cellular proliferation inhibition rate and apoptosis rate in different concentration and control (P<0.05). Meanwhile, 8-CPT-cAMP could induce mitochondrial transmembrane potential collapse in U266 cells. Compared with control groups, the levels of Bcl-2 mRNA transcripts and protein in U266 cells were reduced in 8-CPT-cAMP treated groups (P<0.05), while the levels of caspase-9, Bax mRNA transcription and the expression of Bax protein were increased in treatment groups, but the caspase-8 mRNA had no statistical signi fi cant difference with controls. Conclusion: 8-CPT-cAMP can inhibit the proliferation and promote apoptosis of myeloma cells, which might be mediated by caspase via mitochondrial pathway.
cAMP; Myeloma; Cell apoptosis
10.3969/j.issn.1007-3969.2014.10.007
R733.3
A
1007-3639(2014)10-0755-06
2014-07-12)
上海市自然科学基金资助项目(No:12ZR1416800)。
朱琦 E-mail:zhuqi70@hotmail.com

