副猪嗜血杆菌单因子血清的制备*
路明华,王雪敏,李淑芳,路迎迎,张培君,龚玉梅,王宏俊*
(1.北京市农林科学院畜牧兽医研究所,畜禽疫病防控技术北京市重点实验室,北京 100097;2.河北工程大学农学院,河北邯郸 056021;3.河北省禽病工程技术研究中心,河北邯郸 056021)
副猪嗜血杆菌单因子血清的制备*
路明华1,2,王雪敏2,3,李淑芳1,路迎迎1,2,张培君1,龚玉梅1,王宏俊1*
(1.北京市农林科学院畜牧兽医研究所,畜禽疫病防控技术北京市重点实验室,北京 100097;2.河北工程大学农学院,河北邯郸 056021;3.河北省禽病工程技术研究中心,河北邯郸 056021)
利用副猪嗜血杆菌(Hps)的15个血清型的参考菌株分别制备相应的兔抗血清,然后对抗血清进行交叉吸收试验,得到15个血清型的单因子血清,不同血清型的单因子血清不与其他血清型抗原发生反应。应用这15种单因子血清对临床分离到的9株副猪嗜血杆菌进行血清型的鉴定,结果表明,其中6株为5型,2株为4型,1株为7型。
副猪嗜血杆菌;单因子血清;制备
副猪嗜血杆菌(Haemophilusparasuis,Hps)属于巴斯德菌科(Pasteurellaceae)嗜血杆菌属(Hamophilus),为革兰阴性细小杆菌,具有多种形态,定植于健康猪上呼吸道,属于正常菌群,在免疫抑制等特定条件下会引起猪格氏病(Glässer's disease)[1-2],以纤维素性多发性浆膜炎、脑膜炎、关节炎为主要特征。近些年来由于猪场规模化养殖的快速发展,尤其是工厂集约化养殖,猪格氏病已经呈世界性流行和暴发,表现出突然死亡率、发病率和病死率较高,严重危害养猪业发展,并造成巨大经济损失[3-4]。
由于副猪嗜血杆菌(Hps)体外难以培养,直到1922年Schermer和Ehrlich才成功地分离到该菌。20世纪70年代,研究证明了Hps在体外培养过程中只依赖V因子,即烟酰胺腺嘌呤二核苷酸(NAD),而不需要正铁血红素(X因子),并将此菌更名为副猪嗜血杆菌[5-6]。
Kielstein P等[7]在1992年用琼脂免疫扩散将Hps分为了15个血清型,但是目前对于血清型的鉴定仍然存在很多问题,例如不同血清型之间的交叉凝集反应等。本研究利用Hps的15个参考菌株制备了单因子血清,试图避免不同血清型间的交叉反应,并对本实验室分离和鉴定的副猪嗜血杆菌进行血清型的鉴定。
1 材料与方法
1.1 材料
1.1.1 菌株 副猪嗜血杆菌15个血清型的参考菌株来自澳大利亚昆士兰州动物研究所,由本实验室保存。
1.1.2 培养基 固体培养基为加入50mL/L小牛血清和10g/L NAD的TSA平板;TSB液体培养基。
1.1.3 溶液、试剂 0.01mol/L PBS、硫柳汞和甲醛为中药集团产品;弗氏完全佐剂、弗氏不完全佐剂为Sigma公司产品;2×PCR Mix为天根生化科技有限公司产品。
1.1.4 主要仪器设备 PCR仪为德国Eppendorf公司产品;DYY-2C型电泳槽、DYY-2C型稳压稳流电泳仪为北京六一仪器厂产品;琼脂糖凝胶成像系统为美国SIM BIO公司产品。
1.2 方法
1.2.1 抗血清的制备 ①抗原的制备:将-80℃冻存的Hps 15个血清型菌株划线于TSA平板上进行复苏,37℃过夜培养;将复苏起来的各型菌进行扩大培养,之后每型菌株接种10个TSA平板,然后用加入了10g/L硫柳汞的PBS将菌体洗下,调整菌液浓度为109cfu/mL,加入2mL/L的甲醛,37℃36h,放4℃备用[8-9]。②活菌检验:将灭活的菌液接种TSA板,观察有无细菌生长。③免疫动物:首免分别取灭活的菌液1.5mL与1.5mL弗氏完全佐剂等量混合乳化均匀,于兔颈部皮下多点注射,1mL/只。首免2周后,用1.5mL灭活菌液与1.5mL弗氏不完全佐剂等量混合乳化均匀后于兔背部皮下多点注射,1mL/只。二免2周后于兔耳缘静脉注射菌液1mL/只,每隔3d再免疫1次,最多免疫12次。期间,免疫3次后静脉采血检测抗体水平。④检测有高效价抗体产生时,将实验兔进行心脏采血,常规方法制备血清。
1.2.2 抗血清效价的测定 分别将15个血清型副猪嗜血杆菌菌液浓度调整为109cfu/mL,作为15个血清型的凝集抗原。各型血清稀释度依次为1∶16、1∶32、1∶64、1∶128、1∶256。抗血清效价的测定采用玻片凝集法,取10μL 15种凝集原分别滴在玻片上,然后取10μL相应不同稀释度的抗血清与之混合,常温放置3min内观察有无凝集发生。
1.2.3 交叉反应 采用琼脂扩散试验(gel diffusion test,GDT)进行交叉反应的测定。因为煮沸抗原的交叉反应较低,所以试验采用煮沸的方式制备抗原。将标准菌株接种TSA平板,长好的细菌菌落用pH 7.2的PBS洗下,调整菌悬液浓度为1.5×109cfu/mL,100 ℃ 60min,5 000r/min 离 心15min,取上清作为抗原。用PBS配制10g/L的琼脂糖凝胶,用打孔器按孔径3mm、孔间距4mm打孔,在相应的孔中分别加入15μL血清和15μL抗原,放入湿盒中37℃放置24h观察结果。如果血清孔和抗原孔之间出现沉淀带为阳性,反之,则为阴性。
1.2.4 单因子血清的制备 根据交叉反应的结果,抗血清选择与其发生交叉反应的血清型的菌株进行吸收,具体方法为抗血清与菌液混合后,37℃孵育过夜,然后10 000r/min离心15min,取上清[10]。用琼脂扩散试验检测上清液交叉反应情况,如仍有交叉反应,则再次进行吸附,直至不再出现交叉反应,即只与本型菌株发生反应,与其他菌株不发生反应。
1.2.5 单因子血清效价的测定 采用常规玻片凝集法测定。凝集原采用1.2.2所制备的凝集原,取不同稀释度的单因子血清分别与对应血清型的凝集原做玻片凝集试验,试验方法同1.2.2。
1.2.6 Hps分离株的鉴定 本试验对分离得到的9株菌利用Angen O等[11]报道合成3条特异性16S rRNA引物(表1),由上海生工生物工程技术服务有限公司合成。
该引物扩增长度约1 090bp的片段。25μL体系:2×PCR Mix 12.5μL,HP1F3 0.6μL;HP2F2 0.6μL,HPRevx 1.5μL,ddH2O 8.8μL。程序设置为:94℃ 3min;94℃1min,56 ℃ 45s,72 ℃1min,35个循环;72℃10min,4℃结束反应。

表1 引物名称及序列Table 1 Names and sequences of primers
1.2.7 单因子血清的应用 用制备的单因子血清对实验室分离鉴定的9株Hps做琼脂扩散试验以确定其血清型。具体步骤:用PBS配制10g/L琼脂糖,微波炉融化,然后倒入培养皿中待其凝固后,用打孔器用打孔器按孔径3mm、孔间距4mm打孔,在中间孔加入15μL各型单因子血清,周围孔加入15μL分离到的9株分离株制备的抗原,抗原制备按1.2.3方法;放入湿盒中37℃放置24h观察结果。如果血清孔和抗原孔之间出现沉淀带判为阳性,反之,则判为阴性。
2 结果
2.1 抗血清效价测定结果
结果见表2。

表2 抗血清效价测定结果Table 2 Determination results of anti-serum titer
2.2 交叉反应测定结果
由表3可以看出,1型、2型、5型、11型和12型血清出现交叉反应,其余各型无交叉现象出现。其中5型交叉反应最为严重。

表3 交叉反应试验测定结果Table 3 Determination results of cross reaction test
2.3 单因子血清效价测定结果
由表4可以看出,1型和12型血清抗体效价未受影响,2型、5型和11型血清效价均降低了1个稀释度,这是由于这3个型的血清交叉反应严重,吸附菌液加入量大,故造成血清一定程度的稀释,所以吸附后血清效价出现下降的情况。

表4 单因子血清效价测定结果Table 4 Determination results of uni-factor serum titer
2.4 Hps分离株PCR鉴定结果
由图1可以看出,用特异性引物PCR扩增出的目的条带与预期大小一致,故分离到的9株分离株均为副猪嗜血杆菌。
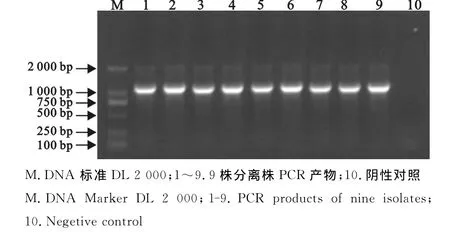
图1 9株分离株PCR鉴定Fig.1 PCR identification of nine isolates
2.5 单因子血清应用结果
用制备的单因子血清,对分离得到的9株Hps进行了血清型的鉴定,结果表明其中6株为5型,2株为4型,1株为7型,结果特异性良好,不存在交叉反应,进一步证明了所制备的单因子血清可用于临床分离株血清型的分型。
3 讨论
在本试验制备抗血清的过程中,不同菌株刺激机体产生抗体的时间差别很大,其中免疫3型抗原3次后血清中产生抗体;而免疫7型抗原10次后,采血检测抗体仍为阴性,直到免疫12次后才检测到抗体的存在。因为抗原的制备采用的方法和免疫的剂量各型之间完全相同,所以这不免使人想到免疫效果是否与菌株本身的血清型和抗原性有一定关系。另外,据报道,兔并不是Hps最敏感的实验动物[12],但与猪相比,兔要廉价很多;与较敏感的豚鼠相比,兔的血液量大的多,故综合考虑兔仍作为实验动物最佳选择,而上述现象可能与兔个体本身的差异有关。
本试验采用的是灭活菌株进行免疫接种,前期有些菌株并不能刺激机体产生抗体,于是后期采用了活菌加强免疫的办法,之后抗体很快便产生。由此可见,灭活细菌在刺激机体产生抗体的程度上与活菌相比仍存在一些差距。同时,琼扩试验结果也表明,使用活菌接种容易产生交叉保护抗体,这与其他细菌的情况类似[13]。但活菌接种存在免疫剂量不易准确掌握的不足,免疫剂量稍大容易致使动物死亡。在制备灭活疫苗的时候应考虑选用更好的佐剂,提升灭活抗原对动物机体的刺激程度及刺激时间。目前,在国内外的研究中,很少有关于副猪嗜血杆菌灭活疫苗佐剂筛选方面的报道。
传统方法制备的Hps抗血清存在较大的交叉反应性,无法对菌株进行确切的分型。本试验采用Hps 15个标准参考菌株,制备了相应血清型的抗血清,并进行交叉反应试验,在此基础上,采用高浓度少量的吸附方法对存在交叉的部分进行了吸附,除去交叉反应部分的同时尽量避免了血清效价大幅度的降低,得到特异性较好的单因子血清;进一步用所获得的单因子血清对分离到的Hps菌株进行血清型的分型,获得了良好的结果。试验过程中,采用了本实验室保存的Hps标准血清对分离株进行了同样的分型,但结果出现了较为严重的交叉反应;由此可见,本试验所制备的单因子血清较好的避免了分型过程中出现的交叉反应,具有更好的特异性,为分离株血清型的确定提供了一种可行的方法,也为该疾病的防控提供了依据。
[1]Costa-Hurtado M,Aragon V.Advances in the quest for virulence factors ofHaemophilusparasuis[J].Vet J,2013,198(3):571-576.
[2]张焕容.副猪嗜血杆菌抗原性研究进展[J].动物医学进展,2010,31(7):91-94.
[3]Blackall P J,Turni C.Understanding the virulence ofHaemophilusparasuis[J].Vet J,2013,198(3):549-550.
[4]Aragon V,Segales J,Oliveira S.Glassers disease[M]//Zimmerman J,Karriker L,Ramirez A,et al.Diseases of Swine.Wiley-Blackwell,Ames,Iowa,USA,2012:760-769.
[5]Kilian M.A taxonomic study of the genus Haemophilus,with the proposal of a new species[J].J Gen Microbiol,1976,93(1):9-62.
[6]叶 飞,贺云霞,徐 慧,等.副猪嗜血杆菌病研究进展[J].动物医学进展,2011,32(2):101-104.
[7]Kielstein P,Rapp-Gabrielson V J.Designation of 15serovars ofHaemophilusparasuison the basis of immunodiffusion using heat-stable antigen extracts[J].J Clin Microbiol,1992,30(4):862-865.
[8]徐引弟,王治方,朱文豪,等.副猪嗜血杆菌高免血清的制备与应用[J].中国农学通报,2010,26(13):14-16.
[9]高鹏程,储岳峰,赵 萍,等.副猪嗜血杆菌培养条件的筛选及对豚鼠的致病性试验[J].动物医学进展,2008,29(10):10-13.
[10]赵 钦,孙亚妮,孔义波,等.副鸡禽杆菌单因子血清的制备与应用[J].西南农业学报,2008,21(4):1152-1155.
[11]Angen O,Oliveira S,Ahrens P,et al.Development of an improved species specific PCR test for detection ofHaemophilus parasuis[J].Vet Microbiol,2007,119(24):266-276.
[12]高鹏程,储岳峰,赵 萍,等.副猪嗜血杆菌对部分常用实验动物的致病性试验[J].畜牧兽医学报,2009,40(1):138-141.
[13]雷连成,韩文瑜,王丽哲,等.猪胸膜肺炎放线杆菌血清1和5型交叉免疫保护研究[J].中国生物制品学杂志,2007,20(11):811-813.
Preparation of Uni-factor Serum ofHaemophilusparasuis
LU Ming-hua1,2,WANG Xue-min2,3,LI Shu-fang1,LU Ying-ying1,2,ZHANG Pei-jun1,GONG Yu-mei1,WANG Hong-jun1
(1.BeijingInstitutionofAnimalHusbandryandVeterinaryMedicine,BAAFS;BeijingMunicipalKeyLaboratoryofAnimalDiseasePreventionandControlTechnology,Beijing,100097,China;2.CollegeofAgriculture,HebeiUniversityofEngineering,Handan,Hebei,056021,China;3.PoultryDiseasesEngineeringTechnologyResearchCenterofHebeiProvince,Handan,Hebei,056021,China)
The homologous antisera were gotten by utilizing the representative strains of theHaemophilus parasuis,and then 15mono-specific antisera were acquired by cross absorption and all mono-specific antisera showed serotype-specificity.Further investigations indicated that 2,1and 6of the nine isolates strains ofHaemophilusparasuis,respectively,belonges serotype 4,7and 5identified by using the 15mono-specific antisera.
Haemophilusparasuis;uni-factor serum;preparation
S852.613
A
1007-5038(2014)07-0021-04
2013-12-18
北京市农林科学院创新能力建设项目(KJCX20140410);“863”子课题项目(2011AA10A210);国家自然科学基金项目(31272558,31001072);河北省教育厅自然科学重点项目(ZH200811)
路明华(1987-),男,河北邢台人,硕士研究生,主要从事分子免疫学与预防兽医学研究。* 通讯作者

