三峡水库不同运行阶段澎溪河典型优势藻原位生长速率*
冯 婧,李 哲,**,闫 彬,张利萍,郭劲松,方 芳,张曾宇
(1:重庆大学城市建设与环境工程学院,重庆 400045)
(2:中国科学院重庆绿色智能技术研究院,重庆 400030)
藻类原位生长速率通常是指特定藻种在天然水域进行原位培养所获得的生长速率.原位培养过程中藻类种群生境条件接近或等同于实际生境,故其所反映的生长特征更接近于天然种群动态,更准确地反映了天然水域藻类生态过程.原位生长速率被广泛运用于藻类生态学研究中.Westwood 等在澳大利亚Murry 河中的实验研究发现鱼腥藻原位宏观生长速率随生境状态的变化而发生显著改变[1].De Tezanos Pinto 等研究发现,虽然束丝藻、鱼腥藻生长策略相同,并能在集群中共存占优,但在水华过程中由于其光合效率(光合速率计算法也是原位生长速率的一种方法)存在显著差异,使得水华不同阶段束丝藻、鱼腥藻在集群中的优势度差异明显[2].Yamamoto 等分析了3 种微囊藻在不同季节的原位生长速率,发现相同生境下铜绿微囊藻具有相对较高的原位生长速率(0.18 ~0.65 d-1),易使其在种群中占优势[3].Stolte 等发现有害蓝藻(鱼腥藻、微囊藻)水华过程的原位生长速率较无害蓝藻低[4],并且Kardinaal 等进一步发现无害微囊藻更耐受于低光照的生境条件并将维持较高的生长速率[5].吴晓东等在太湖等水域运用细胞分裂频率法对微囊藻原位生长特征进行了研究[6],但国内相关研究依然相当有限.
三峡成库后支流回水区普遍出现了藻类大量生长、水华频发的现象.在三峡水库“蓄清排浑”运行的影响下,支流回水区水动力条件、光热条件、营养物含量等藻类生境要素具有同天然河流、湖泊迥异的独特性.生境要素改变迫使藻类群落处于“开放”的生态位,其群落丰度、结构组成、季节演替过程等特征表现出明显差异.目前三峡支流藻类生态研究着重于跟踪调查成库前后以及水华期间藻类群落结构和演替特征[7-8];或结合室内模拟实验分析典型优势藻同主要环境因素的相互关系[9-10],阐释水华过程的控制性环境因素或其突变性特点[11].尽管所获得的一般共识是在营养物充裕的支流水体中适宜的光热输入是诱导出现水华的关键,但由于水华形成是藻类群落演替并促成顶极的结果,从群落生态学的角度对三峡水库支流藻类群落进行系统分析仍相对薄弱,通过原位生长实验阐释群落演替趋势的相关研究仍鲜有报道.
笔者所在团队曾于2011年夏季对三峡水库中段支流澎溪河高阳平湖水域藻类原位生长速率进行了初步研究,建立了在该水域开展藻类原位生长速率研究的基本方法[12].本文在此基础上对三峡水库不同运行时期的典型优势藻进行原位生长培养,结合同期关键生境要素变化特点,比较分析不同水库运行阶段的藻类原位生长与群落演替特征,探索利用原位生长速率判断藻类群落演替趋势的方法,为阐释水华过程的藻类群落演替规律提供更丰富的信息.

图1 澎溪河回水区云阳段及高阳平湖示意图Fig.1 Backwater area of Pengxi River and Lake Gaoyang
1 材料与方法
1.1 研究区域与原位培养时间选取
澎溪河地处四川盆地东部边缘,流域面积5173 km2,干流全长182.4 km,是三峡库区北岸中段流域面积最大的支流.澎溪河高阳平湖水域(31°5'48″N,108°40'20″E,图 1),地处澎溪河下游永久回水区中部,地势平坦,上游水体经峡谷流入此处,流速减缓,具有类似湖泊的地貌环境及水文水力特征.该水域在夏季低水位时期平均水深不足15 m,冬季高水位时期平均水深将超过40 m,形成了近似于“浅水湖泊↔深水湖泊”的季节性交替特征.原位培养反映所在水域本地藻种生长—衰亡趋势与速率变化特点,但难以反映随流输移造成的机械性增减.故本研究原位培养地点选择在水体流动性相对较弱的高阳平湖李家坝处库湾内原位实验平台处.
结合一个完整调蓄周期的三峡水库坝前水位变化过程(图2),研究将整个水库运行周期划分为3 个阶段:3月至6月上旬,为水库泄水期;6月至9月,为低水位运行期;10月至次年3月,为高水位运行期.上述3 个阶段高阳平湖的生态环境特征见表1.在上述3 个水库运行时期内,分别选取2011年6月29日至 7月 5日(低水位)、2011年 12月 4日至 10日(高水位)、2012年3月2日至10日(泄水期)开展原位生长速率研究.
根据 Trimbee 等[13]和 Gaedeke 等[14]的观点,藻类群落结构(多样性和演替速率)对外界扰动响应显著的时段为5 ~15 d;另外,Reynolds[15]的研究表明淡水湖泊中藻类世代周期一般为3 ~4 d,2 ~3 倍于世代周期的时间间隔(6 ~16 d)易于反映藻类群落的演替特征.故综合考虑,选择实验周期为6 d,接种后每48 h 采样1 次,采样时间控制在9:30-12:00.
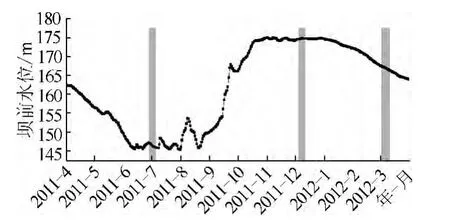
图2 研究期间(一周年)三峡水库坝前水位日变化情况(阴影部分为研究所选的代表性时间)Fig.2 Daily water level of the Three Gorges Reservoir during the whole research year

表1 三峡水库不同运行时期高阳平湖的生态环境特征比较[16-18]Tab.1 Comparison of main eco-environmental features of Lake Gaoyang under different operating stages of the Three Gorges Reservoir
1.2 原位实验方法
前期研究发现,水库运行初期澎溪河藻类总体呈现以下群落演替特征:从春季开始,S/CS 型生长策略的藻类占优势,在夏季汛期易出现CR/CS 频繁交替的混生型藻类群落格局,在夏末初秋时S/CS 型藻种占优,但从秋末开始迅速向R/CR 型生长策略过渡,在经历2月中旬至3月上旬冬末初春的短暂繁盛后于3月上中旬迅速转变至S/CS 型生长策略藻类占优的格局.同北半球深水湖泊相对系统完善的C-R-S 季节演替模式相比,澎溪河回水区藻类生长策略的季节演替过程并不完善,缺失了C 型、RS 型藻种在群落中形成持续优势的明显时段[17].

表2 原位培养所遴选的典型藻种及所代表的时期[19-21]Tab.2 Selected algae and their prosperous periods in Pengxi River in the in situ research
结合上述研究成果,选择该水域不同时期出现的典型优势藻种(表2)开展原位生长速率测试研究.原位生长实验方法见文献[12],本文采用自制培养桶进行原位生长速率研究.
绝大多数藻类种群增长符合指数增长模型:

式中,Nt是t 时刻藻类生物量;N0是初始藻类生物量,本研究选择叶绿素a 作为藻类生物量估算的测量指标;μ 是比生长速率.上述公式可进一步转换为:

式中,μ 为藻类原位生长速率(d-1);Xi为i 时刻的叶绿素a 浓度(mg/m3);t 为采样天数(2 d).
1.3 气象数据和水体理化指标测定
使用5 L 改良式采水器采集表层0.5 m 水样,采样后于48 h 内完成全部样品分析.现场测试分析指标包括:pH 值、水温(Tw)、真光层深度(Zeu)、太阳光照辐射(Light)、降雨量(Rain)以及最大风速(Vmax),其中pH 值、Tw采用YSI 63 型pH 计测定,真光层深度通过光量子仪测定水上及水下光强测算,太阳光照辐射、降雨量以及最大风速从气象站获取.同期取表层湖水2000 ml 用于化学指标的测定,包括总氮(TN)、溶解性无机氮(DIN)、溶解性磷酸盐(SRP)、总磷(TP)、颗粒态磷(PP)、总颗粒物(TPM)以及叶绿素a(Chl.a),所有化学测试指标分析方法参照《水和废水监测分析方法》进行[22].
1.4 数据处理与统计方法
坝前水位数据下载自中国长江三峡集团公司网站(http://www.ctgpc.com.cn),化学实验分析及计算得出的数据录入SPSS 或Origin 软件进行统计分析,采用Oneway ANOVA 或t 检验来辨别不同数据组的差异性,采用变异系数Cv 值(标准差同均值的比值)表征数据变化幅度,采用CANOCO 进行RDA 分析和蒙特卡洛检验.

图3 三峡水库不同运行阶段培养期内原位生长速率均值的变化Fig.3 Mean values of in situ growth rate under different operating stages of the Three Gorges Reservoir
2 结果与分析
2.1 不同水库运行状态下藻类原位生长速率特征
低水位阶段,培养期内各藻种原位生长速率均值分别为:湖北小环藻 0.128 ±0.006 d-1、铜绿微囊藻-0.380 ±0.019 d-1、空 球 藻- 0.177 ± 0.009 d-1、水 华 鱼 腥 藻-0.197 ±0.010 d-1、卵形隐藻 0.210 ± 0.010 d-1(图 3).相同生长策略的实验藻种在研究期间原位生长速率的变化过程相同,且平均生长速率的正负关系一致.在整个培养周期内,代表CR 型生长策略的湖北小环藻和兼具C、R、S 生长策略的卵形隐藻,它们的原位生长速率总体呈逐渐下降趋势,即在研究初期出现了生物量累积,但从研究中期开始随即出现生物量下降.代表CS 型生长策略的水华鱼腥藻和空球藻的原位生长速率则先增加后又有所下降,出现较显著增长的是在实验中期,而末期则出现种群衰亡的趋势.代表S 型生长策略的铜绿微囊藻的原位生长速率虽然前期和中期都为负,但后期转为正值(图4).
高水位阶段,培养期内各藻种原位生长速率均值分别为:湖北小环藻0.175 ±0.009 d-1、铜绿微囊藻-0.036 ±0.002 d-1、空球藻 0.326 ±0.016 d-1、水华鱼腥藻-0.020 ±0.001 d-1、卵形隐藻 0.187 ±0.009 d-1(图 3).在整个培养周期内,湖北小环藻、空球藻和卵形隐藻的原位生长速率均为正值且总体呈逐渐上升趋势,即在研究期间生物量一直在累积且以更快的速度不断增多.水华鱼腥藻的原位生长速率则先增加后又有所下降,出现较显著增长的是在实验中期,而末期则出现了种群衰亡的趋势.铜绿微囊藻的原位生长速率处于较低水平且其值持续下降,衰亡现象明显(图4).
水库泄水阶段,培养期内各藻种原位生长速率均值分别为:湖北小环藻0.231 ±0.012 d-1、铜绿微囊藻0.157 ±0.008 d-1、空球藻 0.281 ±0.014 d-1、水华鱼腥藻-0.009 ±0.001 d-1、卵形隐藻 0.406 ±0.020 d-1(图3).湖北小环藻、空球藻和卵形隐藻的原位生长速率均为正值且总体呈先上升后下降的趋势.铜绿微囊藻的原位生长速率均为正值且呈现逐渐上升的趋势,而水华鱼腥藻则仅在第6 ~8 d 出现正值外,其它时段均为负值(图4).
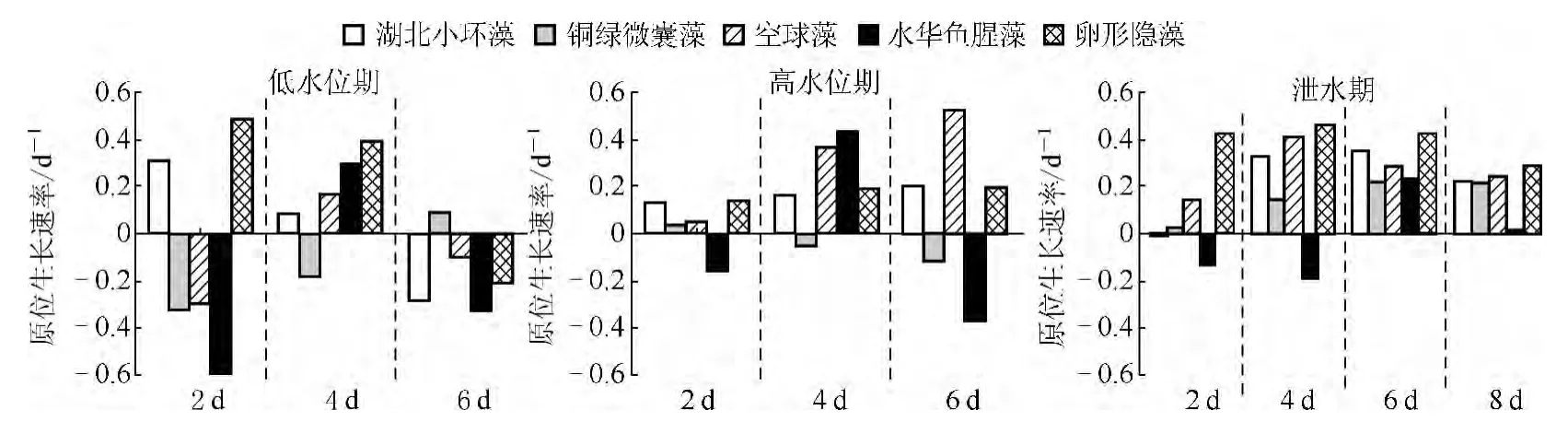
图4 三峡水库不同运行阶段培养期内原位生长速率的变化Fig.4 Variation of in situ growth rates under different operating stages of the Three Gorges Reservoir
2.2 生境要素动态与同期水生生态特征
低水位培养期间,天气晴多阴少,无降雨.水温在26.73 ~32.64℃之间,呈上升趋势;太阳辐射强度均值为20.50 ±1.22 MJ/(m2·d);日最大风速均值为6.13 ±0.34 m/s.水中pH 呈上升趋势,变化范围为8.70 ~9.70.真光层深度范围为1.25 ~2.05 m.水中SRP 浓度相当低甚至不能检出,最大值也仅为4.35 μg/L.磷素形态以颗粒态磷为主;TN 和 TP 浓度均值分别为 1640.38 ± 154.58 μg/L 和 118.40 ± 22.78 μg/L,变化过程基本一致.总颗粒态物质浓度范围为6.67 ~22.27 mg/L,均值为15.50 ±2.47 mg/L.Chl.a 浓度先降后升,其均值为58.0 ±16.1 mg/m3(图5).
高水位培养期间,天气阴转小雨,日降雨量均值为0.64 ±0.35 mm,日最大风速均值为4.77 ±0.73 m/s,太阳光照辐射强度均值仅为2.10 ±0.60 MJ/(m2·d);水温变幅为16.80 ~17.70℃,水中 pH 为7.54 ~7.69,真光层深度均值为5.57±0.33 m,在4.57 ~5.92 m 之间.水体中TPM 浓度相对于低水位时期有明显下降,均值仅为3.95±0.75 mg/L.实验期间水中磷素以 SRP 为主,PP 和 SRP 浓度均值分别为7.98 ±2.41 μg/L 和22.88 ±8.52 μg/L.TN/TP 有逐渐上升的趋势,变化范围为 23.03 ~141.57,Chl.a 浓度先上升后下降,其均值仅为2.94 ±0.36 mg/m3(图5).
泄水期培养期间,天气基本为阴,云层较厚有零星小雨.期间降雨量日均值为0.52 ±0.23 mm,日最大风速均值为5.82 ±0.51 m/s,太阳辐射强度均值为5.61 ±1.38 MJ/(m2·d).水温变幅为11.10 ~12.10℃.水中pH 变化在7.70 ~8.00 之间.真光层深度有逐渐下降的趋势,其变化在6.90 ~8.80 m 之间,均值为8.02 ±0.25 m,较高水位时期有明显增加.水体中TPM 均值仅为2.12 ±0.16 mg/L,其中PP 浓度均值为11.43 ±3.37 μg/L.同时,此次实验中SRP 浓度相对于高水位时期也有所增加,均值为22.88 ±8.52 μg/L;TN、TP 均值分别为 1206.96 ±8.16 μg/L 和 64.18 ± 8.24 μg/L,TN/TP 变幅为 12.64 ~ 30.64.水体中磷素形态仍以SRP 为主.湖水中Chl.a 浓度呈波动变化,其均值为8.73 ±0.88 mg/m3(图5).
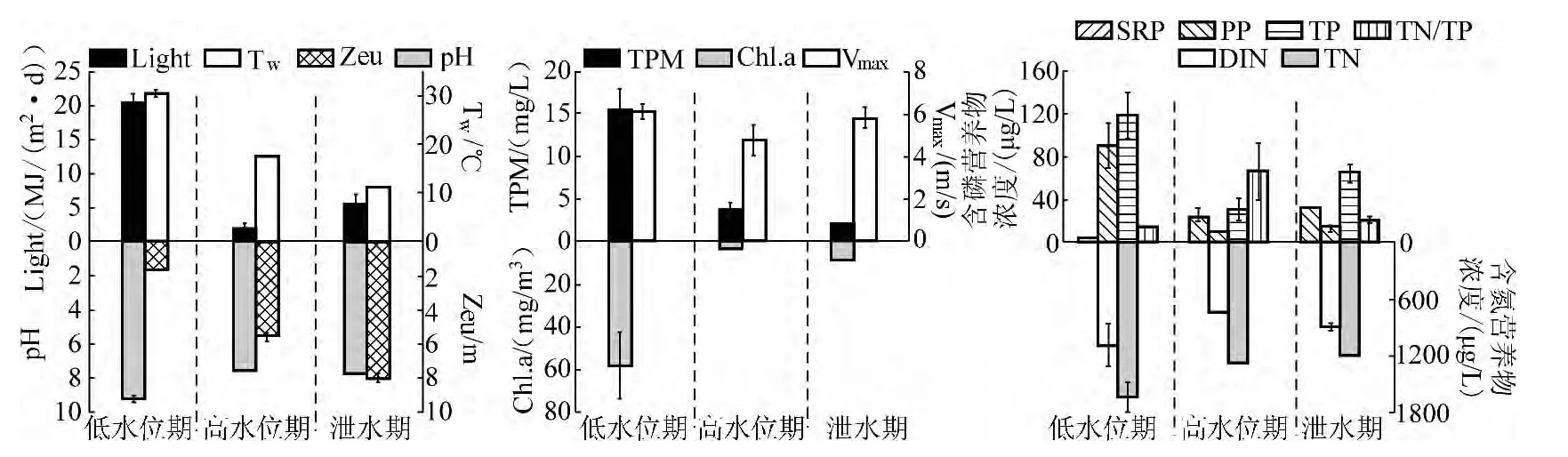
图5 三峡水库不同运行阶段主要环境参量的变化Fig.5 Variation of key environmental variables under different operating stages of the Three Gorges Reservoir
3 讨论
对三峡水库不同运行时期典型优势藻与生境要素进行RDA 直接梯度分析,结果发现:低水位时期,CS型生长策略的水华鱼腥藻和空球藻处于同一象限,TN/TP 与Vmax增加对其原位生长速率具有显著促进作用,而TN、TP、PP 和SRP 对上述两种CS 型生长策略藻种亦有影响.TPM、Tw和pH 的增加对S 型生长策略的铜绿微囊藻的原位生长速率增加影响显著.而具有R 型生长策略特征的湖北小环藻(CR 型)和卵形隐藻(CRS 型)则位于另一象限,DIN、Zeu 和Light 的增加对其原位生长速率增加贡献显著.高水位时期,外部光热条件、PP 与最大风速可能是影响水华鱼腥藻原位生长速率的主要因素;TPM、DIN 和pH 的增加对卵形隐藻、湖北小环藻和空球藻原位生长速率均具有促进作用.而铜绿微囊藻原位生长速率则对TN、TP、SRP、Tw的响应敏感.泄水期,水华鱼腥藻原位生长速率的增加与pH、TN/TP 的增加密切相关,且亦同另一象限的DIN、TP、Zeu、Vmax等因素有关.铜绿微囊藻原位生长速率主要同pH、TPM 和另一象限的SRP、TN 关联密切.湖北小环藻、空球藻等的原位生长速率在该时期受Tw、PP 和Light 等因素的显著影响,卵形隐藻则对TP、Vmax的改变更为敏感.采用蒙特卡洛检验对模型中各生境变量的边际效应和条件效应进行分析可发现,低水位期影响实验藻种原位生长速率的主要环境因素为SRP 和Tw.高水位时期,对实验藻种生长速率影响显著的环境变量主要为PP 和Vmax.泄水期,对实验藻种生长速率影响显著的环境变量主要为SRP、DIN 和TN(图6).

图6 三峡水库不同运行阶段各典型优势藻与生境变量间的RDA 分析统计结果(Cyc.为湖北小环藻、Mic.为铜绿微囊藻、Eud.为空球藻、Ana.为水华鱼腥藻、Cry.为卵形隐藻)Fig.6 RDA analysis for algae species and key environmental variables under different operating stages of the Three Gorges Reservoir
藻类群落演替表征为生境变化下不同藻种间相互取代的连续变化序列,是自然发生且可辨识的[23].尽管藻类群落演替表现为不同藻种生物量的变化,但其本质则是不同藻种对生境的适应与响应[24].在不考虑特定水域藻类随流迁入迁出的情况下,最适宜于在所处生境中生长的藻种往往具有最高的生长速率,进而能够在足够的时间内实现持续的生物量积累并最终形成优势;不适宜于所处生境的藻种往往因其生长速率受到抑制而难以在同一生境中具备生长优势,并最终被其他适生藻种取代[19].在上述逻辑中,表观上藻类在群落中的优势度实质上是种群表观生长速率(即种群生物量积累能力)和生境持续性的数学函数.函数边界为初始状态下藻类在种群中的优势度.种群表观生长速率是藻种在群落中占优势或被淘汰的必要条件,而生境持续性则是充分条件,种群表观生长速率和生境持续性共同决定了藻类群落演替的结果[19].故理论上若能够获取特定藻类种群表观生长速率,同时掌握生境持续性与初始状态,故可实现对不同藻种优势度的预测,并进而判别种群演替趋势(图7).
在不考虑水柱中藻类随流迁入迁出的情况下,原位培养是明晰天然水域种群表观生长速率的一种有效途径.原位培养所获得的生长速率值及其在培养期间所发生的原位生长速率变化趋势,可以反映在所处宏观生境下特定生长策略藻种的实际生长特征,并进而为种群演替趋势预测提供基础.结合前述RDA 分析结果可以看出,低水位时期,光热条件优越,营养盐丰足,倾向于CR型生长策略的湖北小环藻和具有CRS 型生长策略属性的卵形隐藻均在研究期间出现了正的生长速率特征,这可用于解释同期湖水中卵形隐藻、湖北小环藻为优势藻的现象;但随着藻类大量生长,水体透光性能逐渐下降,溶解性磷浓度进一步降低,其速率的长期变化趋势则呈现出极显著的下降趋势,这体现了其作为杂生种(ruderals)在稳态生境条件下将逐渐失去优势的生态特征.而S 型生长策略的铜绿微囊藻较其他藻种更能耐受资源的不足,通过悬浮生长机制等满足生长需求,从而表现出长期生长趋势[25],因而在相对稳定的生境状态下最终达到顶级(climax),即形成水华.
高水位时期,营养盐浓度相对丰足,光热条件较差,藻类生长受光热条件限制明显.具有低光照耐受性的湖北小环藻和低温耐受性的空球藻以及兼具两者特征的卵形隐藻充分体现其作为杂生种在该生境条件下的优势,在一段时间内保持占优的趋势,而铜绿微囊藻也有一定的生物量累积,尽管该时期水柱中营养物含量颇丰,但是由于能量输入的进一步减弱而逐渐走向衰亡.
泄水时期,营养盐水平和光热条件介于低水位和高水位时期之间,这种有利生境在研究期间并未发生明显变化,湖北小环藻、空球藻以及卵形隐藻将在较长时间内保持优势,但上述优势随着营养盐水平和光热条件进一步提高的低水位时期的到来而破坏.具有较强胁迫耐受能力的铜绿微囊藻随着水库泄水水位持续下降而逐渐体现出优势,进而在春末夏初时节形成水华.
尽管如此,上述推论仅有限地适用于流动性并不显著的库湾水域.对于具有显著流动性的澎溪河干流,特定水库运行时期(如低水位运行期)藻类群落演替同时亦可能明显受到藻类随流迁入迁出的影响,原位生长速率测试仅可能有限反映本地藻种的生长潜势,故在具有显著流动性的水域环境中,基于原位生长的藻类群落演替模式依然需要进一步探索.
[1]Westwood KJ,Ganf GG.Effect of mixing patterns and light dose on growth of Anabaena circinalis in a turbid,lowland river.River Research and Applications,2004,20(2):115-126.
[2]De Tezanos Pinto P,Litchman E.Eco-physiological responses of nitrogen-fixing cyanobacteria to light.Hydrobiologia,2010,639:63-68.
[3]Yamamoto Y,Tsukada H.Measurement of in situ specific growth rates of Microcystis(Cyanobacteria)from the frequency of dividing cells.Journal of Phycology,2009,45(5):1003-1009.
[4]Stolte W,Garcés E.Ecological aspects of harmful algal in situ population growth rates.In:Graneli E,Turner JT eds.Ecology of harmful algae.Berlin:Springer Berlin Heidelberg,2006:141-152.
[5]Kardinaal WEA,Tonk L,Janse I et al.Competition for light between toxic and nontoxic strains of the harmful cyanobacterium Microcystis.Applied and Environmental Microbiology,2007,73(9):2939-2946.
[6]吴晓东,孔繁翔.水华期间太湖梅梁湾微囊藻原位生长速率的测定.中国环境科学,2008,28(6):552-555.
[7]罗专溪,张 远,郑丙辉等.三峡水库蓄水初期水生态环境特征分析.长江流域资源与环境,2005,14(6):781-785.
[8]曾 辉,宋立荣,于志刚等.三峡水库“水华”成因初探.长江流域资源与环境,2007,16(3):336-339.
[9]刘信安,湛 敏,马艳娥.三峡库区流域藻类生长与营养盐吸收关系.环境科学,2005,26(4):95-99.
[10]周贤杰,罗固源,杨清玲等.三峡库区次级河流回水区环境因子对藻类生长影响的模拟实验研究.环境科学学报,2008,28(3):558-562.
[11]刘信安,张毅力.模拟消落带水华暴发行为的数值沙堆模型.环境科学学报,2006,26(7):1126-1134.
[12]李 哲,谢 丹,郭劲松等.三峡水库澎溪河典型优势藻原位生长速率的初步研究.湖泊科学,2012,24(5):746-754.
[13]Trimbee AM,Harris GP.Use of time-series analysis to demonstrate advection rates of different variables in a small lake.Journal of Plankton Research,1983,5(6):819-833.
[14]Gaedeke A,Sommer U.The influence of the frequency of periodic disturbances on the maintenance of phytoplankton diversity.Oecologia,1986,71(1):25-28.
[15]Reynolds CS.Scales of disturbance and their role in plankton ecology.Hydrobiologia,1993,249(1/2/3):157-171.
[16]李 哲,方 芳,郭劲松等.三峡小江回水区段2007年春季水华与营养盐特征.湖泊科学,2009,21(1):36-44.
[17]李 哲,方 芳,郭劲松等.三峡小江(澎溪河)藻类功能分组及其季节演替特点.环境科学,2011,32(2):392-400.
[18]方 芳,周 红,李 哲等.三峡小江回水区真光层深度及其影响因素分析.水科学进展,2010,21(1):113-119.
[19]Reynolds CS.The ecology of phytoplankton.UK:Cambridge University Press,2006:1-436.
[20]Reynolds CS,Huszar V,Kruk C et al.Towards a functional classification of the freshwater phytoplankton.Journal of Plankton Research,2002,24(5):417-428.
[21]Padisák J,Crossetti LO,Naselli-Flores L.Use and misuse in the application of the phytoplankton functional classification:a critical review with updates.Hydrobiologia,2009,621(1):1-19.
[22]国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法:第4 版.北京:中国环境科学出版社,2002:200-284.
[23]Odum EP 著.孙儒泳,钱国桢,林浩然等译.生态学基础.北京:人民教育出版社,1981:83-281.
[24]Odum EP.The strategy of ecosystem development.Science,1969,164(3877):262-270.
[25]Oliver RL,Ganf GG.Freshwater blooms.In:Whitton BA,Potts M eds.The ecology of cyanobacteria.Netherlands:Kluwer Academic Publisher,2000:149-194.
——藻类科学研究和产业发展的重要平台

