齐口裂腹鱼鳞片发生及覆盖过程研究
严太明 唐仁军 刘小帅 杨世勇 杨 淞 何 智
齐口裂腹鱼鳞片发生及覆盖过程研究
严太明 唐仁军 刘小帅 杨世勇 杨 淞 何 智
(四川农业大学动物科技学院, 雅安 625014)
观察了实验室养殖条件下齐口裂腹鱼稚鱼鳞片的发生和覆盖过程。结果表明, 稚鱼体长为30.7— 32.3 mm时, 鳞片最先出现在鳃盖后缘侧线处; 体长为45.3—47.9 mm时, 鳞片覆盖完毕, 体长和日龄对鳞片覆盖均有显著影响。在鳞片覆盖过程中出现6个鳞片发生起始位置, 依次是鳃盖后缘侧线处、尾柄部侧线处、臀鳍基部、腹鳍基部、背鳍基部和峡部。此外, 组织切片的观察结果表明, 齐口裂腹鱼鳞片发育主要经历了形态发生早期、形态发生晚期、分化早期、分化晚期和折叠期五个阶段。这些研究结果丰富了齐口裂腹鱼早期发育的生物学资料, 将有助于了解其在系统学和功能形态学上的特征。
齐口裂腹鱼; 鳞片发生; 鳞片覆盖
鳞片作为皮肤重要的衍生物, 与哺乳动物的毛发、指甲等一样, 由皮肤原始干细胞定向分化产生, 具有重要的生物学意义[1, 2]。除减少游动产生的摩擦力、维持体型骨架的基本功能外, 鱼类的鳞片还具有防御病原侵害的重要功能。同时, 鱼类鳞片形态结构也是研究鱼类分类特征、生存环境和生长特性的重要依据[3, 4]。鳞片发生一直是鱼类学重要的基本研究对象之一, 其研究有助于阐明鱼类的生长规律。通过鳞片发生过程的观察, 可判断鱼苗的生长状况和培育效果, 便于及时调整饲养管理措施[4, 5]。此外, 鳞片发生位置和覆盖过程的研究也有助于鱼类演化过程的探讨和鱼类亲缘关系的鉴定[6—8]。
齐口裂腹鱼(Tchang)隶属于鲤科(Cyprinidae), 裂腹鱼亚科(Schizothoracinae), 裂腹鱼属(), 广泛分布于长江上游的岷江、大渡河等中上游急流河段, 是当地重要的经济鱼类, 具有广阔的市场前景[9]。为保护和合理开发利用齐口裂腹鱼资源, 诸多学者针对齐口裂腹鱼的早期发育、人工繁殖与养殖等开展了大量的研究工作[10—14]。谢林等对齐口裂腹鱼成鱼鳞片的表面结构进行了扫描电镜观察[3], 但是关于其鳞片发生及覆盖还未见相关报道。本文观察了实验养殖条件下的齐口裂腹鱼鳞片的发生和覆盖过程, 探讨了鳞片发生与生长的相关性, 旨在丰富齐口裂腹鱼早期发育的生物学资料。
1 材料与方法
1.1 实验鱼来源与管理
实验鱼来自雅安芦山宝剑渔业有限公司。人工授精的齐口裂腹鱼胚胎在14.0—16.0℃水温中静水孵化, 用充氧泵充氧。初孵仔鱼在恒温生化箱内的白色塑料盆(36 cm×28 cm×12 cm)中培养, 水温(15.0± 0.2)℃。鱼苗开口后前2周投喂人工孵化的卤虫无节幼体, 之后转至玻璃水族箱(90 cm×40 cm× 75 cm)内饲养, 投喂足量消毒后并剁碎的水蚯蚓, 水温21.0—26.0℃。每日9:00和21:00完全换充分曝气的自来水, 并及时清理粪便和残饵。
1.2 样品采集与处理
待90%以上的仔鱼腹鳍鳍褶消失之后(约43日龄), 每2d取样一次, 52日龄后每4d左右取样一次。实验鱼采用盐酸利多卡因(浓度为30 mL/L)麻醉后, 用Leica DC500照相系统拍照, 并用系统自带软件测量鱼体体长(精确度0.1 mm); 用吸水纸除去鱼体表水分后, 用分析天平称重。每次随机抽取25尾鱼, 其中5尾用于直接染色观察鳞片出现位置以及鳞片覆盖情况; 20尾用10%的福尔马林溶液固定备用(其中15尾用于剥取躯干鱼皮和测量鳞片覆盖面积, 另5尾用于组织切片观察)。
1.3 鱼皮染色和组织切片观察
除去鱼体表水分后, 用手术剪去掉所有鳍条, 然后用手术刀沿背部中线剖开, 再用镊子和手术刀沿躯干剥下从头部后缘至尾柄末端的整个鱼体表皮。所得鱼皮采用茜素红饱和中性水溶液染色法染色[7], 用自来水清洗后在Leica 立体显微镜下观察和照相, 并用照相系统自带软件测量鱼体躯干表面积和鳞片覆盖面积。
对福尔马林溶液固定材料进行常规石蜡切片, 切片厚度6 μm, HE染色后, 中性树胶封片进行组织学观察, 并在Nikon E800显微镜下照相。
1.4 数据处理
选用鳞被覆盖率(鳞片覆盖面积对整个鱼皮总面积之百分比)作为判断鳞片覆盖指标。采用Adobe Photoshop CS3进行图片编辑处理, 用Microsoft Excel 2010绘制鳞片覆盖率与日龄、体长的关系曲线和SPSS 17.0进行数据的相关性分析。
2 结果
2.1 鳞片发生位置及覆盖过程
采用茜素红饱和中性水溶液染色法确定齐口裂腹鱼鳞片发生起始位置共有6个, 按出现的先后顺序依次是鳃盖后缘侧线处、尾柄部侧线处、臀鳍基部、腹鳍基部、背鳍基部和峡部。体长达到30.7— 32.3 mm时, 齐口裂腹鱼鳃盖后缘侧线处最先出现鳞片(图1A), 该位置鳞片沿鳃盖后缘上下方向扩展的速度明显低于沿侧线向尾柄部延伸的速度。当体长达到31.1—32.5 mm时, 第二个鳞片发生起始位置位于尾柄部侧线处(图1B), 该处鳞片以较慢速度沿侧线上下方向扩展, 而以较快速度向前延伸, 并与第一鳞片发生起始位置的鳞片汇合形成完整的侧线鳞(数目为91—102)。当体长达34.7—35.3 mm时, 臀鳍基部开始出现鳞片, 此处为第三个鳞片发生起始位置(图1C)。体长35.9—36.2 mm时, 稚鱼第四个鳞片发生起始位置出现在腹鳍基部(图1D), 此时尾柄部鳞片基本覆盖完全。当体长达到36.1—39.1 mm时, 第五个鳞片发生起始位置出现在背鳍基部前缘(图1E), 此时臀鳍基部扩散的鳞片与尾柄部起始位置延伸出的鳞片汇合。体长39.7—43.2 mm时, 第六个鳞片发生起始位置出现在峡部(图1F), 该位置鳞片向腹中线两端延伸的同时, 也向鳃盖后缘延伸并与鳃盖后缘起始位置延伸的鳞片汇合, 同时臀鳍基部起始位置扩散的鳞片与腹鳍基部起始位置延伸的鳞片完成汇合。稚鱼体长41.8—46.5 mm时, 鱼体背侧鳞片覆盖完全, 腹中线完全汇合。体长45.3— 47.9 mm时, 胸鳍后腹部鳞片覆盖完全, 整个鱼体鳞片覆盖完毕。

图1 齐口裂腹鱼稚鱼鳞片发生起始位置
齐口裂腹鱼6个鳞片发生起始位置依次是鳃盖后缘侧线处(A)、尾柄中部侧线处(B)、臀鳍基部(C)、腹鳍基部(D)、背鳍基部(E)和峡部(F)。除F为腹面观之外, 其他均为侧面观。比例尺为1.0 mm
The six locations of scale development injuvenilewere the lateral line near the posterior border of gill cover (A), the lateral line near the middle of caudal peduncle (B), the base of anal fin (C), the base of pelvic fin (D), the base of dorsal fin (E), and isthmus (F). All pictures were lateral views of fish, except for the F (ventral view). Scale bar=1.0 mm
2.2 鳞片发生的组织学观察
组织切片观察结果表明, 齐口裂腹鱼的鳞片发育主要经历了五个阶段: 形态发生早期、形态发生晚期、分化早期、分化晚期和折叠期。在鳞片发生早期, 胶原纤维致密层在表皮基质细胞层下迅速堆积形成真皮组织(图2A); 成纤维细胞开始侵入真皮组织中部, 形成单独一层细胞结构(图2B); 当大量成纤维样细胞在表皮-真皮交界处积累时, 表皮基质细胞形成一层并列的连续细胞层(图2C)。鳞片发育晚期, 在表皮-真皮交界处积累的纤维样细胞变长, 形成浓密的鳞片乳突, 并凹入表皮基质(图2D)。在鳞片分化早期, 鳞片乳突继续增多, 并分化成两层鳞片形成细胞, 两层细胞之间出现鳞片基质层, 同时鳞囊也形成(图2E)。随着鳞片基质的沉积, 鳞片发育进入分化晚期(图2F)。在折叠期, 表皮开始在鳞片后端边缘折叠, 鳞囊进一步扩大, 相邻的鳞片发生重叠, 形成成熟的鳞片(图2F)。
2.3 鳞被覆盖与体长和日龄的关系
鳞被覆盖率(Coverage rate,)与体长(Body length,)和出膜后的日龄(Days post hatching,)的关系如图3所示, 鳞被覆盖率与日龄的关系为:= –0.00173+0.40012–28.331+630.61(2=0.9207,= 0.000)(图3A); 鳞片覆盖率与体长的关系为:= –0.04693+5.82862–231.99+2994.3(2=0.9376,=0.000)(图3B)。结果表明, 体长和日龄对鳞被覆盖均有显著影响。研究还发现, 在日龄小于52d, 体长小于30.7 mm时, 未观察到鳞片发生; 52—60日龄, 体长为30.7—35.3 mm时, 鳞片覆盖缓慢; 64—89日龄, 体长35.3—45.0 mm, 鳞片覆盖速度明显加快; 93日龄时体长大于45.0 mm, 鳞片覆盖速度减缓; 至105日龄体长为45.3—47.9 mm时, 鳞片覆盖完毕。
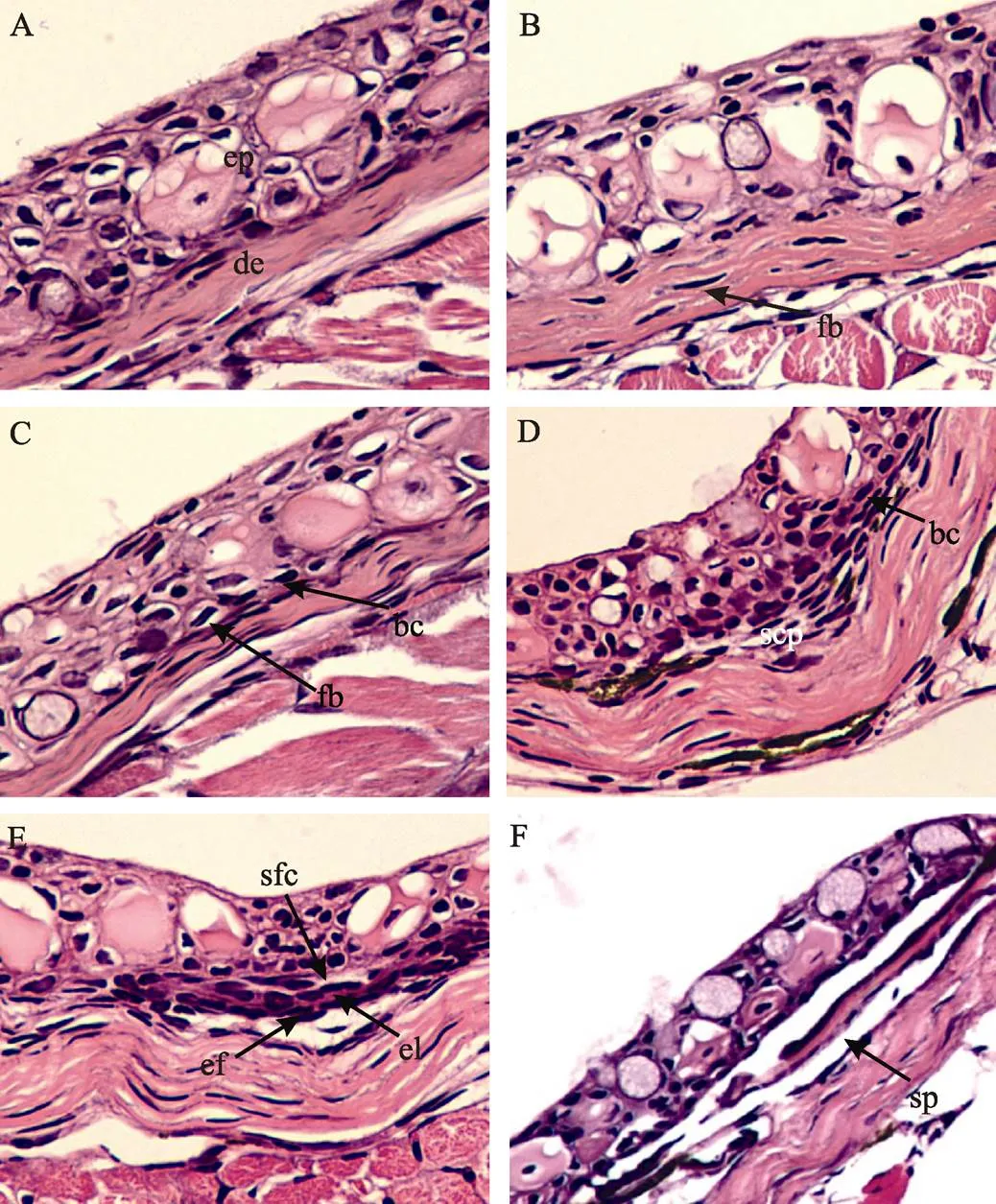
图2 齐口裂腹鱼稚鱼鳞片发育的组织结构(×400倍)
A-C. 鳞片形态发生早期: 胶原纤维堆积形成真皮组织(A), 成纤维细胞侵入真皮层中部(B), 大量纤维样细胞在表皮-真皮交界处积累(C); D. 形态发育晚期, 鳞片乳突的形成; E. 分化早期, 鳞片形成细胞分化以及鳞囊形成; F. 分化晚期和折叠期, 表皮在鳞片后端边缘折叠, 鳞片形成
A-C. early morphogenesis, the collagenous fiber formed the dermal stroma (A), fibroblasts have invaded the primary dermal stroma (B), and fibroblasts were accumulated along the epidermal-dermal boundary (C). D. late morphogenesis, the differentiation of scale papillae was immediately below the epidermis. E. early differentiation, the two upper cell layers of the scale papillae were differentiated into scale-forming cells and scale pocket started to form. F. late differentiation and folding stage, the depositions of elasmodin were in the external layer, and the epidermis started to fold around the posterior margin of the scale
ep: 表皮; de: 真皮; fb: 成纤维细胞; bc: 基底细胞; scp: 鳞片乳突; sfc: 鳞片形成细胞; el: 外层细胞; ef: 弹性纤维; sp: 鳞囊
ep: epidermis; de: dermis; fb: fibroblast; bc: basal cell; scp: scale papilla; sfc: scale forming cell; el: external layer cell; ef: elastic fibers; sp: scale pocket
3 讨论
3.1 鳞片最先出现部位和起始位置数量
本研究结果表明, 齐口裂腹鱼鳞片最先出现在鳃盖后缘的侧线处。这与同属于鲤科的鲤鱼()、鲢()、鳙()和草鱼()鳞片最先出现在躯干前段侧线处的结果一致[7], 而与丽鱼科(Cichlidae)的尼罗罗非鱼()[7]、五种底鳉科鱼类[8]、鳗鲡科(Anguillidae)的奥克兰鳗鲡()和大鳗鲡()[15]和胭脂鱼科(Catostomidae)的小孔亚口鱼()[16]鳞片发生最早出现在尾柄部侧线处存在较大差异。同时, 与鲻科(Mugilidae)的梭鱼()[4]、塘鳢科(Eleotridae)的河川沙塘鳢()[17]、太阳鱼科(Centrarchidae)暗斑棘盖太阳鱼()[18]鳞片最早出现在尾柄侧中央至体侧中央的连线上也不一致。此外, 还有少数鱼类鳞片最早出现位置在侧线以外的其他部位, 如鳢科(Channidae)的乌鳢()出现在头顶部[5], 溪鳉科(Aplocheilidae)的花斑溪鳉()和鲱科(Clupeidae)的大鳞油鲱()分别出现在鳃盖骨和颅骨连接处[19]与胸鳍与腹鳍之间的腹部[20]。由此看来, 鱼类鳞片最早出现的位置在物种间差异较大, 具有种属特异性。
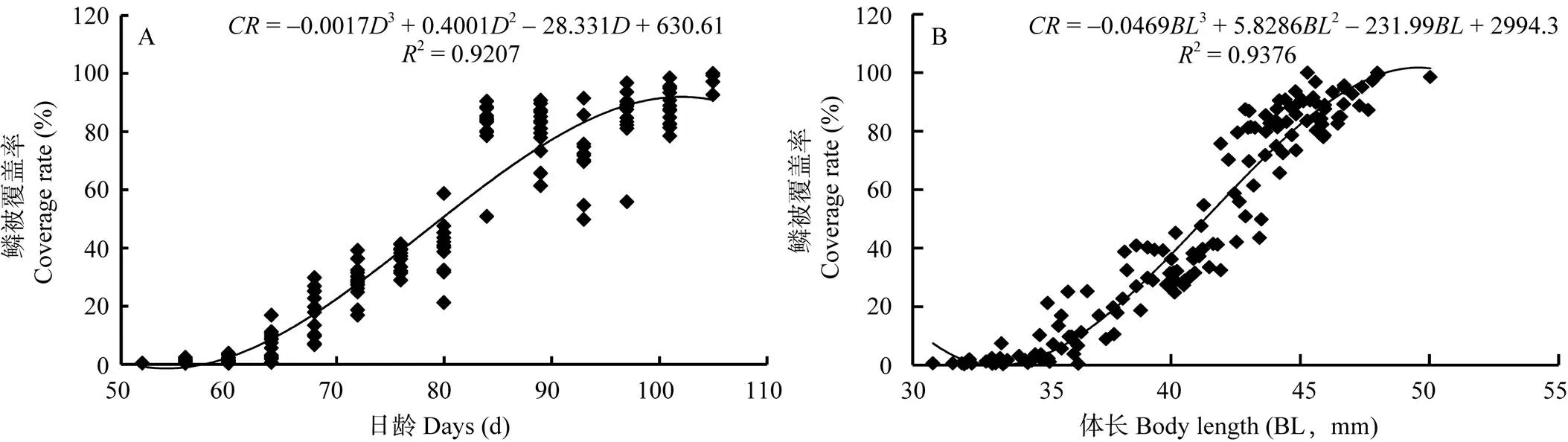
图3 齐口裂腹鱼稚鱼鳞被覆盖率与日龄、体长的关系
本研究发现齐口裂腹鱼稚鱼鳞片发生起始位置有6个, 与本实验室对重口裂腹鱼()的研究结果一致(另文报道), 但数量却明显多于以往的报道。如鲤科的鲤鱼、鲢、鳙和草鱼[7]、丽鱼科的尼罗罗非鱼[7]、鳗鲡科的奥克兰鳗鲡和大鳗鲡[15]、塘鳢科的河川沙塘鳢[17]鳞片发生起始位置仅有1个; 鲻科的梭鱼[4]、溪鳉科的花斑溪鳉[19]、鲱科的大鳞油鲱[20]有2个; 鲤齿鳉科(Cyprinodontidae)杂色鳉()[8]、太阳鱼科的暗斑棘盖太阳鱼[18]有3个; 鳢科的乌鳢[5]、底鳉科鱼类[8]有4个。从已有的这些研究来看, 不同物种之间鳞片发生起始点的数目存在差异, 似乎没有一定的规律性。
3.2 鳞被覆盖过程
鳞被覆盖过程常用鳞片覆盖率作为判断指标。对于鳞片较大、行列清楚容易计数的鱼类, 常采用鳞片出现排数作为鳞片覆盖率的指标, 如梭鱼[4]、鲤[7]、草鱼[7]、罗非鱼[7]、河川沙塘鳢[17]和黑鲷[21]等; 对于鳞片小, 行列不清难以计数的鱼类, 则以鳞片覆盖面积对鱼的整个侧面皮肤面积之百分比为覆盖率指标, 如鲢[7]、鳙[7]、乌鳢[5]以及一些鳉科鱼类[8]等。齐口裂腹鱼体披细鳞[9], 统计鳞片排数较难, 故本文采用鳞片覆盖面积对整个鱼皮总面积之百分比为覆盖率指标。
已有研究表明, 不同分类阶元的物种鳞片覆盖方式没有明显的规律, 可能具有种属特异性。即使同属于鲤科的鲤鱼、草鱼、鲢和鳙的鳞被覆盖过程和速度也存在差异[7]: 鲤鱼和草鱼鳞片在横向地朝尾柄部延伸的同时, 也以相似速度纵向朝背、腹扩展, 腹中线附近的鳞片最后出现; 鲢和鳙的鳞片以较快的速度向腹部和尾柄部扩展, 但向背部延伸的速度较慢, 在腹部与尾柄部基本覆盖完毕时, 鳞片才由侧线上方向背部和由尾柄上部向前伸展, 头后背部的鳞片最后出现。丽鱼科的尼罗罗非鱼的鳞片最先出现在侧线上, 鳞片向尾柄部前端覆盖的速度快于向后, 向背部覆盖的速度快于向腹部, 头后背部最后覆盖[7]。黑鲷的鳞片从胸鳍基部后至肛门直上方的侧线处开始, 逐渐向四周扩展延伸, 直至覆盖整个鱼体[21]。
本研究发现, 虽然齐口裂腹鱼鳃盖后缘侧线鳞的出现时间先于尾柄中部, 但尾柄部鳞片发育和覆盖速度却明显快于前者, 推测这可能是为适应山区河流急流环境所采取的一种策略。幼鱼在游动时主要依靠尾部摆动产生驱动力[22], 其与硬的河床基质接触时受伤的几率增大。尾部快速覆盖鳞片将有助于保护皮肤, 防御病原侵害, 从而提高幼鱼在野外的存活率。裂腹鱼亚科中裂腹鱼属鱼类通常生活在峡谷河道的急流中, 为适流速较快和河床多为卵石或砾石的水体环境, 这类鱼通过长时间进化而身披细鳞, 甚至鳃峡以后的胸腹部都有明显的鳞片[9]。齐口裂腹鱼峡部的鳞片发生是在躯干背部鳞片完成覆盖之后, 最后与腹鳍基部发生的鳞片汇合完成腹中线覆盖, 这与部分鱼类鳞片覆盖终止于腹部是相同的[7]。不同分类阶元的物种间鳞片覆盖方式有一定差异, 但分类地位相近的物种鳞被覆盖方式却基本相似[8]。因此, 本研究结果将为揭示其他裂腹鱼属鱼类早期发育阶段鳞片覆盖特点提供重要的参考。
3.3 鳞被覆盖与生长
本研究表明, 齐口裂腹鱼体长和日龄对鳞片覆盖均有重要影响, 在64—89日龄, 体长35.3—45.0 mm时, 鳞片覆盖速度明显快于其他发育阶段。鲤鱼、草鱼、鲢、鳙和尼罗罗非鱼中的研究表明: 体长的发育阶段对鳞片出现与覆盖过程起决定性作用[7]。五种鳉科鱼类体长10.0—19.9 mm时, 鳞片覆盖速度最快, 鳞片发生与鱼体体长关系密切[8]。同时, 斑马鱼鳞被覆盖在同一日龄组与体长成正相关, 而在不同日龄组与体长和日龄均相关[2]。这些结果表明, 不同鱼类的鳞片覆盖过程的阶段性可能与日龄和体长有重要关联。鳞片具有减少游动产生的摩擦力、维持体型骨架的基本功能以及防御病原的侵害作用, 故齐口裂腹鱼鳞片发生和覆盖的阶段性可能是其与功能相适应的一种表现。
[1] Sharpe P T. Fish scale development: Hair today, teeth and scales yesterday [J]?, 2001, 11(18): R751—752
[2] Sire J Y, Allizard F, Babiar O,Scale development in zebrafish () [J]., 1997, 190(4): 545—561
[3] Xie L, Fang J. Scanning electron microscopic observation on surface structure of scalesin(Tchang) [J]., 2003, 22(6): 506—507 [谢林, 方静. 齐口裂腹鱼鳞片表面结构的扫描电镜观察. 电子显微学报, 2003, 22(6): 506—507]
[4] Zhang F C, Su B R, Lin J B,. A preliminary observation on the development of the scales of mullet () [J].(Natural Sciences), 1980, (4): 99—104 [张非常, 苏炳仁, 林金榜, 等. 梭鱼 () 鳞片发生的初步观察. 南京大学学报 (自然科学版), 1980, (4): 99—104]
[5] Xie C X, Zhou J, Xiong C X,. Early developmental and morphological characteristics of scale of Chinese snake-head fish, () [J]., 1996, 15(1): 68—72 [谢从新, 周洁, 熊传喜, 等. 乌鳢早期鳞被的形成及鳞片形态特征. 华中农业大学学报, 1996, 15(1): 68—72]
[6] Li S F, Yang X L, He C G. The preliminary study of scales development and cover process in grass carp [J]., 1986, (1): 45—52 [李思发, 杨小林, 何超刚. 草鱼的鳞片出现和复盖过程的初步研究. 江西水产科技, 1986, (1): 45—52]
[7] Li S F. The scale formation process and its relation to the growth of five species of fish [J]., 1983, 7(4): 343—351 [李思发. 五种鱼的鳞被复盖过程及其同生长的关系. 水产学报, 1983, 7(4): 343—351]
[8] Able K W, Sakowicz G P, Lamonaca J C. Scale formation in selected fundulid and cyprinodontid fishes [J]., 2009, 56(1): 1—9
[9] Ding R H. The Fishes of Sichuan, China [M]. Chengdu: Sichuan Publishing House of Science & Technology. 1994, 370—371 [丁瑞华. 四川鱼类志. 成都: 四川科学技术出版社. 1994, 370—371]
[10] Wu Q, Wang Q, Cai L M,The embryonic and larval development of[J]., 2004, 19(3): 218—221 [吴青, 王强, 蔡礼明, 等. 齐口裂腹鱼的胚胎发育和仔鱼的早期发育. 大连水产学院学报, 2004, 19(3): 218—221]
[11] Fang J, He M, Du Z J,. Histological studies on the ovary development of[J]., 2007, 25(1): 88—93 [方静, 何敏, 杜仲君, 等. 齐口裂腹鱼卵巢发育的组织学研究. 四川农业大学学报, 2007, 25(1): 88—93]
[12] Dong Y Z, Deng S H. Artificial reproduction and fry rearing in prenant’s Schizothoracin[J]., 2011, 30(10): 638—640 [董艳珍, 邓思红. 齐口裂腹鱼的人工繁殖与苗种培育. 水产科学, 2011, 30(10): 638—640]
[13] Tang W J, Yang C. Domesticated matters needing attention in wild[J]., 2008,(5): 33 [唐文家, 杨成. 野生齐口裂腹鱼驯化注意事项. 科学养鱼, 2008, (5): 33]
[14] Zhou X H, Zheng S M, Wu Q,. The optimum nutrient requirements and energy-protein ratio in formulated feed in juvenile[J]., 2007, 22(1): 37—41 [周兴华, 郑曙明, 吴青, 等. 齐口裂腹鱼幼鱼饲料中营养素适宜含量和最适能量蛋白比的研究. 大连水产学院学报, 2007, 22(1): 37—41]
[15] Jellyman D J. Scale development and age determination in New Zealand freshwater eels (spp.) [J]., 1979, 13(1): 23—30
[16] White D S. Early development and pattern of scale formation in the spotted sucker,(Catostomidae) [J]., 1977, 1977(2): 400—403
[17] Hu X C, Sun G Y. Early scale development in the dark sleeper(Gunther) [J].(Natural Science Edition), 1996, 13(3): 6—9 [胡先成, 孙帼英. 河川沙塘鳢早期鳞被的形成. 重庆师范学院学报(自然科学版), 1996, 13(3): 6—9]
[18] Cooper J A. Scale development as related to growth of juvenile black crappie,Lesueur [J]., 1971, 100(3): 570—572
[19] Park E, Lee S. Scale growth and squamation chronology for the laboratory-reared hermaphroditic fish(Cyprinodontidae) [J]., 1988, 34(4): 476—482
[20] Chapoton R B. Scale development in the Gulf menhaden,[J]., 1967, 96(1): 60—62
[21] Ding Y W, Li J E. Early scale development in the black porgy(Basilewsky) [J]., 1991, 10(3): 16—20 [丁彦文, 李加儿. 黑鲷早期鳞被的形成. 热带海洋, 1991, 10(3): 16—20]
[22] Yang H, Cao Z D, Fu S J. Effect of caudal amputatuion on swimming capacity, energy expenditure and behavior of juvenile[J]., 2013, 37(1): 157—163 [杨晗, 曹振东, 付世建. 尾鳍缺失对鳊鱼幼鱼游泳能力、能量效率与行为的影响. 水生生物学报, 2013, 37(1): 157—163]
The scale formation and development in juvenile of
YAN Tai-ming, TANG Ren-jun, LIU Xiao-shuai, YANG Shi-yong, YANG Song and HE Zhi
(College of Animal Science and Technology, Sichuan Agricultural University, Ya’an 625014, China)
Scale morphology, growth and the squamation chronology were described for thereared in the laboratory. The results showed that scale formation including onset and completion occurred at 30.7— 32.3 mm and 45.3—47.9 mm body length (BL), and the appearance of scale is related to BL and age. The scale of juvenile ofwere formed at six locations: the lateral line near the posterior border of gill cover, the lateral line near the middle of caudal peduncle, the base of anal fin, the base of pelvic fin, the base of dorsal fin, and isthmus. Furthermore, our results revealed that the scale formation and development were divided into five stages: early morphogenesis, late morphogenesis, early differentiation, late differentiation and scale fold. These results suggest that understanding the pattern of scale formation may be useful in systematics, functional morphology and habitat use.
; Scale formation; Scale coverage
2013-07-04;
2014-01-02
农业部淡水鱼类种质资源与生物技术重点开放实验室开放课题“大渡河上游齐口裂腹鱼的生物学研究”资助
严太明(1972—), 男, 四川万源人; 理学博士; 主要研究方向为鱼类生态学。E-mail: yantaiming@sina.com
何智, E-mail: hezhisicau@aliyun.com
Q958.8
A
1000-3207(2014)02-0298-06
10.7541/2014.43

