梅山猪胚胎附植期EphB2的组织表达及RNA-seq分析
付言峰,周艳红,,王爱国,李兰,刘红林,李碧侠,任守文
1. 江苏省农业科学院畜牧研究所,动物品种改良和繁育重点实验室,南京 210014;
2. 南京农业大学动物科技学院,南京 210095;
3. 中国农业大学动物科学技术学院,北京 100193;
4. 中国农业大学动物医学院,北京 100193;
5. 国家兽用生物制品工程技术研究中心,南京 210014
梅山猪胚胎附植期EphB2的组织表达及RNA-seq分析
付言峰1,周艳红1,2,王爱国3,李兰4,5,刘红林2,李碧侠1,任守文1
1. 江苏省农业科学院畜牧研究所,动物品种改良和繁育重点实验室,南京 210014;
2. 南京农业大学动物科技学院,南京 210095;
3. 中国农业大学动物科学技术学院,北京 100193;
4. 中国农业大学动物医学院,北京 100193;
5. 国家兽用生物制品工程技术研究中心,南京 210014
猪产仔数是一个重要的经济和繁殖性状,而胚胎附植是影响猪产仔数的重要因素。为了研究促红细胞生成素产生肝细胞受体B2 (EphB2)对猪胚胎附植过程中子宫内膜迁移和粘附活动的影响,文章以太湖流域梅山猪为研究对象,利用实时荧光定量PCR (qRT-PCR)和蛋白免疫印迹(Western blot)方法,检测EphB2基因在梅山猪胚胎附植前、中、后期子宫内膜附植点/非附植点和卵巢组织的mRNA和蛋白表达谱,并用转录组测序(RNA-seq)方法分析了不同附植时期子宫内膜附植点和卵巢组织的差异表达基因。qRT-PCR和 Western blot结果表明,EphB2在胚胎附植前、中、后期子宫内膜附植点和非附植点的mRNA和蛋白均呈现先升高后降低的表达趋势,且附植中期的表达量显著高于前期和后期(P<0.01);EphB2在附植前、中、后期卵巢中的mRNA和蛋白表达趋势则相反,为先降低后升高,且不同时期间表达差异显著(P<0.05)。RNA-seq结果表明,EphB2在子宫内膜附植点的mRNA表达,附植中期极显著高于附植前期(P<0.01);EphB2在卵巢的mRNA表达,附植中期显著高于附植后期(P<0.05)。综上所述,EphB2很可能在猪胚胎附植过程中发挥着重要的调控作用,为潜在的猪产仔数性状候选基因。
EphB2;胚胎附植;表达;转录组测序;梅山猪
产仔数是母猪的重要繁殖性状,是猪育种工作的重要指标。要提高产仔数,猪的高排卵数是基础,而胚胎成活率是关键。一般认为,猪妊娠早期(10~30 d)是胚胎死亡的高峰期,约占总胚胎死亡率的60%~70%[1,2]。而猪的胚胎附植开始于妊娠第13 d,结束于妊娠第24 d[3,4]。由此可见,猪的胚胎附植期(妊娠13~24 d)是影响猪产仔数的一个非常关键的时期,如何减少这一时期胚胎的死亡成为当前亟待解决的问题。
研究表明,Eph-Ephrin系统在人[5,6]、小鼠[7]和大白猪[8,9]的胚胎附植过程中发挥着重要作用。EphB2作为Eph-Ephrin家族中的受体成员之一,在多种细胞的迁移和粘附活动中发挥作用。研究表明,EphB2的过量表达会使人神经胶质瘤细胞的粘附能力降低,并使细胞的侵入能力增加[10]。EphB2在人的前列腺癌细胞迁移和正常组织结构维护方面发挥着必不可少的作用[11],EphB2利用独立的信号通路调控人肠上皮细胞的迁移和侵入性增殖,其中细胞迁移是非激酶依赖的通路,而细胞增殖是激酶依赖通路(Ab1-cyclin D1)[12]。
但到目前为止,人们对EphB2在胚胎附植期的时空表达规律、组织表达谱和基因功能等内容还知之甚少。所以,本研究以中国太湖猪的典型类别梅山猪为研究对象,采用实时荧光定量PCR方法和蛋白免疫印迹技术检测胚胎附植前、中、后期 EphB2基因在子宫内膜等组织中的 mRNA和蛋白表达趋势,并用转录组测序(RNA-seq)方法对EphB2进行差异表达分析。
1 材料和方法
1.1 实验动物
9头胎龄相近(5~7胎)、体重相近(80~100 kg)的半同胞梅山猪母猪来自江苏农林职业技术学院梅山猪保种场。对其进行单圈饲养,使之自由采食及饮水。适时进行同期发情和人工授精(间隔12 h左右重复授精2~3次,相同种公猪精液)。以最后一次配种为0 d计,分别在配种第13 d(附植前期)、18 d(附植中期)和24 d(附植后期),分别屠宰3头健康的、体况基本一致的母猪。每头猪采集3种繁殖组织样(子宫内膜附植点、子宫内膜非附植点和卵巢),之后迅速置于液氮中冷冻保存。另外,空怀猪1头(配种后13 d)和妊娠猪(95 d )1头作为对照实验。

表1 EphB2基因引物序列及PCR扩增条件
1.2 方法
1.2.1 引物设计
猪 EphB2基因(GenBank登录号: XM_ 003481993) cDNA 全长4033 bp,编码序列(CDS)范围为1~2949 bp。采用Primer Premier 5. 0 和Oligo 6软件设计EphB2和内参基因GAPDH的qRT-PCR 引物。引物由上海英潍捷基(Invitrogen)生物公司合成(表1)。
1.2.2 qRT-PCR
首先提取组织样中的总RNA(TRIzol, Invitrogen),然后将其反转录成 cDNA(AMV First Strand cDNA Synthesis Kit,BBI),再将cDNA样品稀释8倍作为模板进行检测(Step one plus型荧光定量PCR仪,ABI)。扩增体系为20 µL:SybrGreenqPCR Master Mix (2X) (ABI, America) 10 μL,上下游引物(10 μmol/L)各1 µL,ddH2O 7 µL,模板(cDNA) 1 μL。 PCR扩增程序:(1) 95℃ 2 min热启动HotStarTaq酶活性;(2) 融解95℃ 10 s,复性/延伸 60℃ 40 s,共 40 循环;(3) 45~95℃,读板时0.1℃/s 进行溶解曲线分析。以GAPDH为内参基因(GenBank登录号:NM_001206359),以交配后未妊娠猪(non)和妊娠第95 d猪(95 d)作为对照。qRT-PCR的数据利用2-ΔΔCt法分析。
1.2.3 蛋白提取和Western blot
切取0.1 g组织样(子宫内膜附植点/非附植点、卵巢)剪碎,加入PBS洗涤两次,2000 r/min离心10 min,弃上清。加入400 µL蛋白裂解液(0.05 mol/L Tris•HCl、 NaCl 8.76 mg/mL、1% TritonX-100、100 µg/mL PMSF),置于匀浆器上30 s,冰上放置10~15 min。取组织样匀浆液转移到1.5 mL预冷的离心管,10 000 r/min、4℃离心5 min。取上清转移至新的预冷的离心管中,即为全蛋白提取物。提取出的总蛋白用BCA蛋白定量试剂盒(Invitrogen, USA)检测。Western blot过程参考文献[8,13],步骤包括SDS-PAGE电泳(Western blot电泳仪,Bio-Rad)、转膜、封闭、一抗孵育(EphB2 goat polyclonal antibody against human (A-15),Santa cruz)、二抗孵育、DAB显色和ECL曝光。
1.2.4 RNA-seq
本研究采用Illumina Hiseq2000测序平台的双端100 bp测序模式对梅山猪子宫内膜附着点和卵巢组织样进行高通量测序。原始数据经过引物与adaptor序列去除,最终保留高测序质量的碱基片段。保留的测序序列(Remained reads)片段用于后续RNA-seq项目分析模块的分析。
2 结果与分析
2.1 qRT-PCR检测EphB2 mRNA表达
琼脂糖凝胶电泳结果表明,提取的总RNA非常完整,无降解,且含量较高,保证了后续相关实验的可靠性。
在猪胚胎附植前(妊娠第13 d)、中(妊娠第18 d)和后期(妊娠第24 d),利用实时定量PCR法在子宫内膜(又分为附植点和非附植点)和卵巢中均检测到EphB2的mRNA表达,且mRNA表达量会随着附植的进行而发生相应的变化。
在猪子宫内膜附植点和非附植点,EphB2在胚胎附植期(第13~24 d)的mRNA表达趋势基本保持一致,都是先升高后降低,且妊娠第18 d的表达量极显著高于其他妊娠日龄(P < 0.01)。在未妊娠猪中,EphB2的表达量很低,仅略高于妊娠第24 d。在妊娠第95 d中,EphB2的表达量第二高,仅低于妊娠第18 d。
在卵巢中,EphB2在胚胎附植期的mRNA表达趋势为先降低后升高,且妊娠第 18d的表达量显著低于其他妊娠日龄(P<0.01)。这与子宫内膜中的表达趋势相反。在未妊娠猪和妊娠第95 d猪的卵巢中,EphB2的表达量均很高(图1)。
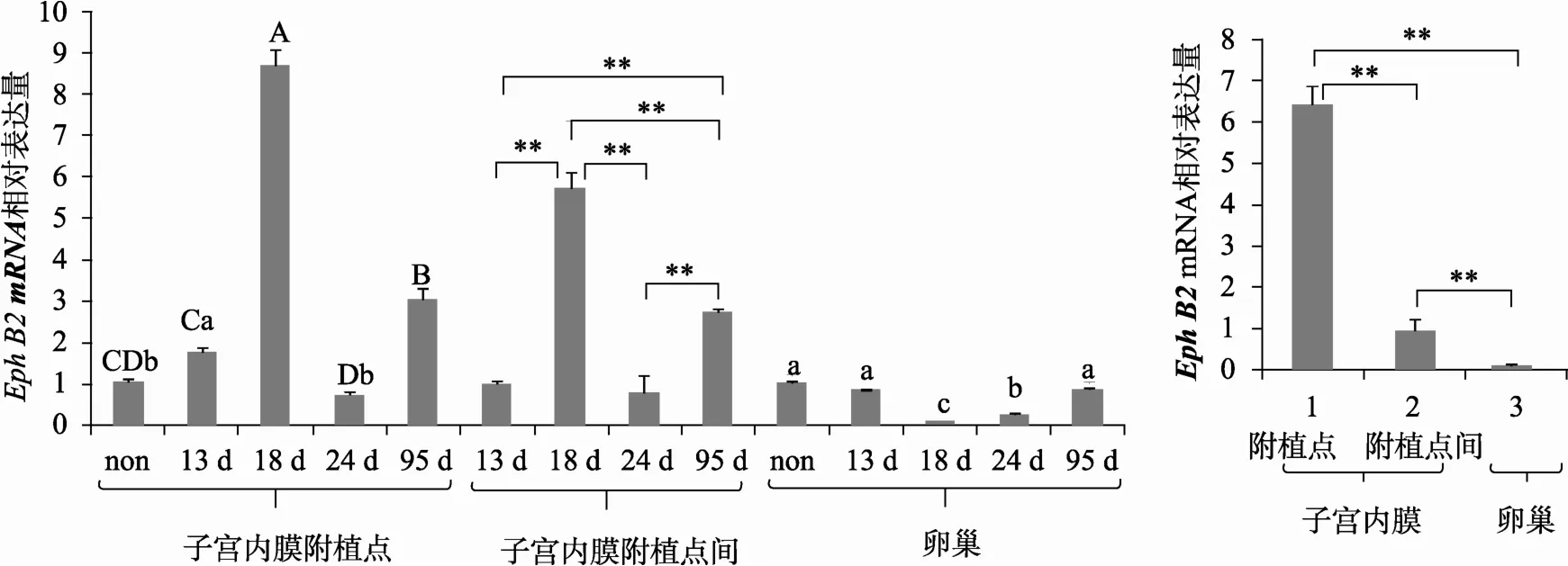
图1 qRT-PCR方法检测梅山猪胚胎附植期不同组织中EphB2 mRNA表达谱(GAPDH为内参基因)A:不同妊娠日龄;B:同一妊娠日龄 (18 d)。柱形图上不同的小写字母或“*”表示差异显著水平为0.05 (P<0.05),不同的大写字母或“**”表示差异显著水平为0.01 (P<0.01)。non:空怀猪。
另外,同一胚胎附植时期(妊娠第18 d),子宫内膜附植点的表达量极显著高于子宫内膜非附植点和卵巢组织(P<0.01)。这些结果表明,EphB2在猪胚胎附植调控中可能发挥了一定的作用。
2.2 Western blot检测EphB2蛋白表达
在猪胚胎附植早(13 d)、中(18 d)、晚期(24 d),EphB2在子宫内膜附植点和非附植点的蛋白表达曲线均呈先升高后降低的趋势,即在胚胎附植早期至中期的过程中表达量持续升高,在胚胎附植中期至晚期的过程中表达量持续降低。其中妊娠第18 d的表达量最高,其次为第13 d的表达量,最低的是妊娠第24 d的表达量,且3个妊娠日两两间的表达量差异均极显著(P<0.01)(图2)。
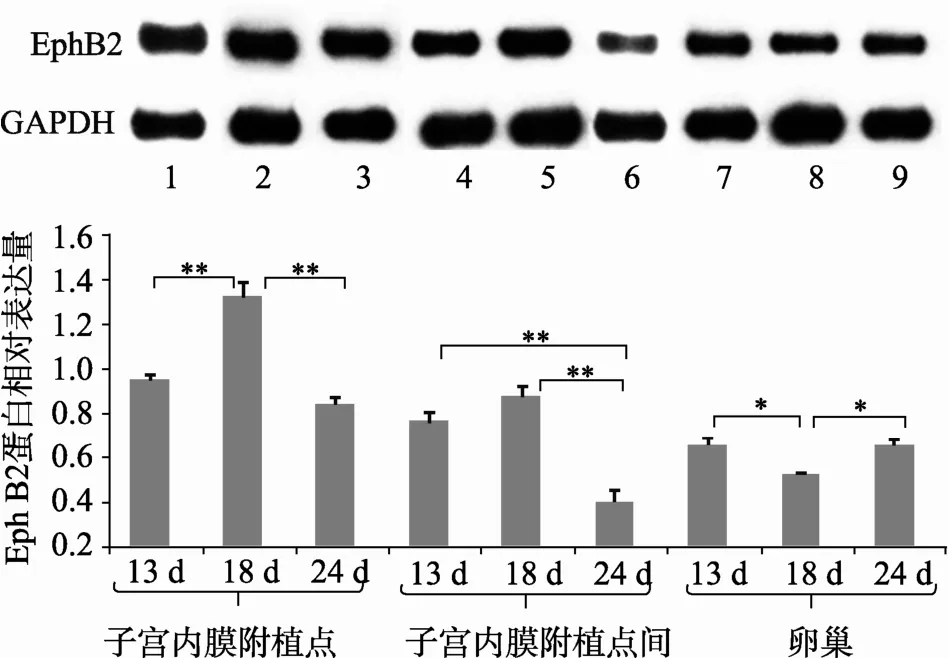
图 2 梅山猪在胚胎附植期不同组织中 EphB2蛋白表达变化 (GAPDH为内参基因)柱形图之间的*和**分别代表两者间差异显著水平为0.05(P<0.05)和0.01(P<0.01)。
EphB2在卵巢组织中的蛋白表达曲线则呈先降低后升高的趋势,即在胚胎附植早期至中期的过程中表达量持续降低,在胚胎附植中期至晚期的过程中表达量持续升高。其中,妊娠第18 d的表达量最低,且显著低于妊娠第13 d和第24 d的蛋白表达量(P<0.05)。
2.3 EphB2差异表达分析
RNA-seq结果表明,EphB2在梅山猪胚胎附植前期(13 d)和中期(18 d)子宫内膜附植点的mRNA表达量分别为1.59和6.43,且两者差异极显著(P <0.01)。在附植中期和后期卵巢组织中的 mRNA表达量分别为1.51和 0.73,且两者差异显著(P<0.05)。RNA-seq的质量评估结果表明,转录组测序的大部分 Reads(较短的原始测序序列)重复性强,Reads碱基大多分布于低密度区域(图3)。
3 讨 论
猪胚胎附植过程的特点是附植前期特别长,即胚胎滋养层细胞侵入腔上皮细胞之前有充分的时间进行观察,因此,可将猪作为研究胚胎附植前期调控机理的理想动物模型[14]。猪胚胎附植相关基因已有报道,如过氧化物酶体增殖物活化受体γ(PPARγ)[15]、黏液素1(Muc1)[16]、瘦素及其受体(Obesity gene and obesity gene long form receptor)[17]。EphB2基因属于受体酪氨酸激酶基因(Receptor tyrosine kinase gene)[11],属于Eph-Ephrin家族系统中的一员,该系统功能与胚胎附植有着很紧密的联系[18]。

图3 转录组测序的质量评估结果A:Reads重复性评估(比对到相同基因组位置的 Reads 被认定为重复 Reads);B:Reads 碱基分布热图(蓝色表示低密度区域,橘黄色表示中密度区域,红色表示高密度区域)。
本研究采用qRT-PCR、Western blot和RNA-seq方法,在梅山猪胚胎附植前(妊娠第13 d)、中(妊娠第18 d)、后(妊娠第24 d)期均检测到EphB2基因在猪子宫内膜中和卵巢中的表达。qRT-PCR结果表明,Eph B2在猪子宫内膜附植点和非附植点上的mRNA表达量从胚胎附植前期至后期呈先升高后降低的趋势,且在附植中期表达量极显著高于其他时期(P<0.01)。另外,附植前、中、后期,EphB2在卵巢中的表达趋势与子宫内膜中的相反。这说明 EphB2很可能参与了猪胚胎附植过程中子宫内膜和胚胎之间的迁移和粘附活动,这与其调控神经胶质瘤细胞的粘附、生长和侵入的作用类似[10]。作为EphB2的配体,EphrinB2在6月龄苏钟猪子宫内膜组织中的表达量显著高于其他组织[19]。该家族成员EphrinA3在胚胎附植期的mRNA表达趋势同EphB2一致[18]。
Western blot 结果表明,EphB2 mRNA翻译的蛋白在胚胎附植期各组织中的表达趋势同mRNA基本保持一致,即子宫内膜附植点和非附植点蛋白表达量在胚胎附植前期到中期逐渐升高,中期到后期逐渐降低。卵巢表达趋势则相反,为先降低后升高。这进一步说明 EphB2可能参与了猪胚胎附植的调控。EphA1、EphA2和EphA4基因[8]在猪胚胎附植期子宫内膜附植点也表现先升高后降低的蛋白表达趋势。另外,EphB2所在的 Eph-Ephrin系统在人[6]和小鼠[7]的胚胎附植过程中也发挥着重要作用。
通过转录组测序(RNA-seq)[20],本研究在梅山猪胚胎附植期的子宫内膜附植点和卵巢的差异表达基因中发现了EphB2,且不同附植期的mRNA表达差异显著。结合qRT-PCR和Western blot结果,初步断定EphB2在梅山猪的胚胎附植调控中很可能发挥着重要的作用。
综上所述,EphB2基因作为Eph-Ephrin系统中的一个受体,在猪的胚胎附植中期mRNA和蛋白表达量都非常显著,预示着其在猪胚胎附植活动中发挥着重要作用。
[1] Geisert RD, Schmitt RAM. Early embryonic survival in the pig: Can it be improved. J Anim Sci, 2002, 80(E. Suppl. 1): E54-E65.
[2] Lin HC, Liu GF, Wang AF, Kong LJ, Wang XF, Fu JL. Effect of polymorphism in the leukemia inhibitory factor gene on litter size in Large White pigs. Mol Biol Rep, 2009, 36(7): 1833-1838.
[3] Kyriazakis I, Whittemore CT. Whittemore's science and practice of pig production. 3rd ed. Oxford, UK: Blackwell Publishing, 2006.
[4] Ren Q, Guan S, Fu JL, Wang AG. Temporal and spatial expression of muc1 during implantation in sows. Int J Mol Sci, 2010, 11(6): 2322-2335.
[5] Fujiwara H, Yoshioka S, Tatsumi K, Kosaka K, Satoh Y, Nishioka Y, Egawa M, Higuchi T, Fujii S. Human endometrial epithelial cells express ephrin A1: possible interaction between human blastocysts and endometrium via Eph-ephrin system. J Clin Endocrinol Metab, 2002, 87(12): 5801-5807.
[6] Red-Horse K, Kapidzic M, Zhou Y, Feng KT, Singh H, Fisher SJ. EPHB4 regulates chemokine-evoked trophoblast responses: a mechanism for incorporating the human placenta into the maternal circulation. Development, 2005, 132(18): 4097-4106.
[7] Fujii H, Tatsumi K, Kosaka K, Yoshioka S, Fujiwara H, Fujii S. Eph-ephrin A system regulates murine blastocyst attachment and spreading. Dev Dyn, 2006, 235(12): 3250-3258.
[8] Fu Y, Fu J, Ren Q, Chen X, Wang A. Expression of Eph A molecules during swine embryo implantation. Mol Biol Rep, 2012, 39(3): 2179-2185.
[9] Fu Y, Fu J, Wang A. Association of EphA4 polymorphism with swine reproductive traits and mRNA expression of EphA4 during embryo implantation. Mol Biol Rep, 2012, 39(3): 2689-2696.
[10] Nakada M, Niska JA, Tran NL, McDonough WS, Berens ME. EphB2/R-Ras signaling regulates glioma cell adhesion, growth, and invasion. Am J Pathol, 2005, 167(2): 565-576.
[11] Huusko P, Ponciano-Jackson D, Wolf M, Kiefer JA, Azorsa DO, Tuzmen S, Weaver D, Robbins C, Moses T, Allinen M, Hautaniemi S, Chen YD, Elkahloun A, Basik M, Bova GS, Bubendorf L, Lugli A, Sauter G, Schleutker J, Ozcelik H, Elowe S, Pawson T, Trent JM, Carpten JD, Kallioniemi OP, Mousses S. Nonsense-mediated decay microarray analysis identifies mutations of EPHB2 in human prostate cancer. Nat Genet, 2004, 36(9): 979-983.
[12] Genander M, Halford MM, Xu NJ, Eriksson M, Yu ZR, Qiu ZZ, Martling A, Greicius G, Thakar S, Catchpole T, Chumley MJ, Zdunek S, Wang CG, Holm T, Goff SP, Pettersson S, Pestell RG, Henkemeyer M, Frisén J. Dissociation of EphB2 signaling pathways mediating tor cell proliferation and tumor suppression. Cell, 2009, 139(4): 679-692.
[13] Fu YF, Li L, Ren S. Effect of FTO expression and polymorphism on fat deposition in Suzhong pigs. Asian-Australas J Anim Sci, 2013, 26(10): 1365-1373.
[14] McIntosh KA, Tumber A, Harding JC, Krakowka S, Ellis JA, Hill JE. Development and validation of a SYBR green real-time PCR for the quantification of porcine circovirus type 2 in serum, buffy coat, feces, and multiple tissues. Vet Microbiol, 2009, 133(1-2): 23-33.
[15] Wang GY, Kong LJ, Hu P, Fu JL, Wang AG. Effect of polymorphism in the peroxisome proliferator-activated receptor gamma gene on litter size of pigs. Mol Biol Rep, 2011, 38(3): 1807-1812.
[16] Chen X, Wang XF, Li ZL, Kong LJ, Liu GF, Fu JL, Wang AG. Molecular cloning, tissue expression and protein structure prediction of the porcine 3-hydroxy-3-methylglutaryl-coenzyme A reductase (HMGR) gene. Gene, 2012, 495(2): 170-177.
[17] Wang HF, Fu JL, Wang AG. Expression of obesity gene and obesity gene long form receptor in endometrium of Yorkshire sows during embryo implantation. Mol Biol Rep, 2014, 41(3): 1597-1606.
[18] 付言峰, 王爱国, 李兰, 傅金銮, 王学敏, 方晓敏, 李碧侠, 任守文. 胚胎附植期Eph-Ephirn A基因家族在猪子宫内膜中的 mRNA表达变化. 江苏农业学报, 2013, 29(1): 93-100.
[19] 付言峰, 王爱国, 方晓敏, 傅金銮, 李碧侠, 王学敏, 李兰, 任守文. Ephrin B2在猪不同组织中的表达谱和基因多态性与产仔数的关联分析. 江苏农业学报, 2012, 28(6): 1330-1337.
[20] Brady JJ, Li M, Suthram S, Jiang H, Wong WH, Blau HM. Early role for IL-6 signalling during generation of induced pluripotent stem cells revealed by heterokaryon RNA-Seq. Nat Cell Biol, 2013, 15(10): 1244-1252.
(责任编委: 蒋思文)
Tissue expression of EphB2 and RNA-seq analysis during embryo implantation in Meishan pigs
Yanfeng Fu1, Yanhong Zhou1,2, Aiguo Wang3, Lan Li4,5, Honglin Liu2, Bixia Li1, Shouwen Ren1
1. The Key Laboratory of Animal Breed Improvement and Reproduction, Institute of Animal Science, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
2. College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China
3. College of Animal Science and Technology, China Agricultural University, Beijing 100193, China;
4. College of Veterinary Medicine, China Agricultural University, Beijing 100193, China;
5. National Research Center of Veterinary Biologicals Engineering and Technology, Nanjing 210014, China
Abstract:Embryo implantation is a key step affecting swine litter size, which is an important economic and reproduction trait in pigs. In order to investigate the effect of erythropoietin-producing hepatocellular receptor B2 (EphB2) on endometrium migration and attachment during swine embryo implantation, the mRNA and protein expression levels of EphB2 in endometrium implantation sites, endometrium non-implantation sites and ovary were detected in Meishan sows during pre-implantation, mid-implantation and post-implantation period using real-time quantitative PCR and Western blot. Differential expression genes were also analyzed in endometrium implantation sites and ovary during different implantation periods by RNA sequencing (RNA-seq) technology. The qRT-PCR and Western blot results showed that EphB2 mRNA and protein expression curve was the same in endomtrium implantation sites and endometrium non-implantation sites during pre-implantation, mid-implantation and post-implantation period, with a first increase followed by a decrease, and its expression level during mid-implantation was significantly higher than pre-implantation and post-implantation (P<0.01). In contrast, EphB2 mRNA and protein expression curve in ovary during pre-implantation, mid-implantation and post-implantation period showed a first decrease followed by an increase, and the expression levels were significantly different among different implantation periods (P<0.05). RNA-seq results indicated that EphB2 mRNA expression during mid-implantation was higher than that of pre-implantation extremely significantly in endometrium implantation sites (P<0.01), and was significantly higher than that of post-implantation in ovary (P<0.05). By and large, EphB2 might play an important role in swine embryo implantation, and it’s a potential candidate gene for litter size in pigs.
EphB2; embryo implantation; expression; RNA-seq; Meishan pig
2014-03-22;
2014-06-11
国家自然科学基金项目(编号:31201767),江苏省农业科技自主创新资金项目(编号:CX(13)5042),国家生猪现代产业技术体系-南京综合试验站项目(编号:nycytx-009)和江苏省科技支撑计划项目(编号:BE2012333)资助
付言峰,博士,副研究员,专业方向:动物遗传育种与繁殖。Tel: 025-84391941,E-mail: fuyanfeng@jaas.ac.cn
周艳红,在读硕士研究生,专业方向:动物遗传育种与繁殖。E-mail: 954268869@qq.com
付言峰和周艳红同为第一作者。
任守文,研究员,硕士生导师,研究方向:动物遗传育种与生产。E-mail: shouwenren@163.com
10.3724/SP.J.1005.2014.1243
时间: 2014-9-17 17:27:24
URL: http://www.cnki.net/kcms/detail/11.1913.R.20140917.1727.005.html

