伊立替康或奥沙利铂联合卡培他滨治疗结直肠癌伴肝转移的临床研究
曹玉娟 王德林 刘承伟 杜 芳 郝龙英 曹 凤 李伟伟 赵 聪
随着人类饮食结构的改变,特别是高蛋白、高脂饮食在饮食结构中的比例升高,结直肠癌(colorectal cancer,CRC)已经成为最常见的恶性肿瘤之一[1]。而目前在我国成为此类肿瘤的高发人群,特别是近几年,随着工业化进程的加快,人民生活水平提高,结直肠癌的发病率及病死率在我国逐年上升,占全部恶性肿瘤的10%~15%,死亡率在所有恶性肿瘤中居第4位[2]。出现器官转移是引起晚期结直肠癌的临床疗效和预后差的重要原因,特别是肝转移,大约1/3结直肠癌合并肝转移;肝转移的发生能大幅缩短结肠癌患者的中位生存期,影响其生存质量[3],如何提高结直肠癌肝转移患者的生存期一直是临床关注的热点。大量文献发现,手术切除是治疗肝转移是惟一有效的手段,能大幅提高患者的生存率;但受到肝占位大小、数目、位置及全身状况等因素的影响。切除率仅为20%~30%[4],特别是随着人口老龄化,大多患者确诊时已错过了最佳手术时机;体质较差无法耐受手术,或者术后出现复发、转移率较高,远期疗效不理想[5]。而联合化疗用于结直肠癌伴有肝转移的患者取得了很好的疗效[6];故此分析不同治疗方案的特点及优势,为临床实践提供理论依据。本研究分别用伊立替康或奥沙利铂联合卡培他滨治疗结肠癌伴肝转移,并观察临床疗效及不良反应等,现报道如下。
1 材料与方法
1.1 临床资料
收集2009年5月至2012年5月在北京大学首钢医院住院或门诊就诊的晚期结直肠癌患者125例,并按入院顺序的奇偶数,随机分成两组,其中治疗组63例,对照组62例,均签署知情同意书,并同意定期接受随访。
入选标准:1)年龄≥18岁,结直肠及肝脏转移灶均行病理细胞学及影像学检查,支持CRC伴肝转移诊断,但除外其他器官转移,均在二甲以上级别医院确诊;2)既往有标准的放化疗史;3)所有患者均行肝脏MRI检查,能有效测量肝转移瘤的大小及数目;4)(ECOG)评分≤2分。
排除标准:严重心脑血管病、肝肾疾病、自身免疫系统疾病、造血功能异常、脑转移者、原发性肝癌等;怀孕或哺乳期妇女;大手术伤口未完全愈合;精神障碍,不能或不愿意配合随访和复查者,预计其生存期小于半年者。
1.2 方法
1.2.1 两组患者用药方法 对照组给予奥沙利铂130 mg/m2,1 d,8 d;卡培他滨 1 000 mg/m2,每日2次,1~14 d。治疗组给予伊立替康150 mg/m2+0.9%氯化钠注射液250 mL,1 d静脉滴注,滴注1.5 h;卡培他滨1 000 mg/m2,每日2次,1~14 d,每21d为1个周期,至少化疗6个周期,总疗程不超过6个月。
1.2.2 临床随访 所有患者在疗效确定后至少每个月随访1次,以电话、书信或门诊复查的方式进行,所有患者在疗效确定后每3个月随访复查血常规、血生化、肿瘤标记物及影像学检查,病情进展停止治疗或不能耐受治疗的患者仍继续接受随访,直至患者死亡或随访截止,随访截止时间为2012年5月30日。
1.2.3 疗效及不良反应评价 1)采用RECIST疗效评价标准进行评价[7]:分为完全缓解(CR),部分缓解(PR),稳定(SD),进展(PD),客观缓解率(ORR)=CR+PR,疾病控制率(DCR)=CR+PR+SD。2)观察两组患者MST和PFS等生存指标,并绘制生存曲线;PFS定义为从入组开始到肿瘤进展的生存时间;MST又称为半数生存期。3)不良反应的评价按照美国国立癌症研究所新版《常见不良事件评价标准》(Commonter⁃minology criteria for adverse events,CTCAE version 3.0)进行安全评估,分为Ⅰ~Ⅴ级5个级别,Ⅲ~Ⅴ级不良反应视为严重不良反应。
1.3 统计学分析
2 结果
2.1 一般资料
患者的性别、年龄、病情等基线情况差异无统计学意义(P>0.05,表1)。
2.2 两组近期疗效比较
两组ORR和DCR比较差异无统计学意义(P>0.05)。
2.3 生存分析
治疗组和对照组的中位总生存期分别为14.0个月和12.0个月,相应的中位无进展生存期分别为5个月和4个月,差异无统计学意义(P>0.05),两组生存曲线见图1,治疗组好于对照组,差异有统计学意义,(χ2=2.348,P=1.254)。
2.4 两组Ⅲ、Ⅳ级药物不良反应
主要为血液学毒性、消化道反应和手足综合症等发生率较高;两组的腹泻发生率比较差异有统计学意义(P<0.05),其他不良反应方面,差异均无统计学意义(P>0.05,表3)。

表1 两组患者的基线资料比较Table 1 Basic clinical data of the patients in the two groups
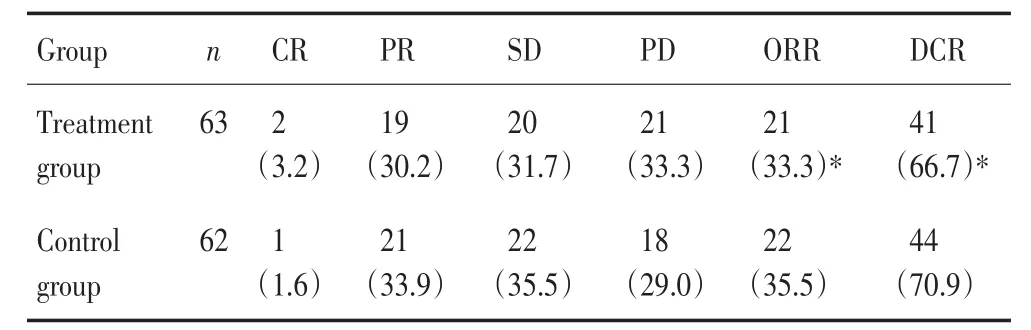
表2 两组的治疗疗效比较 例(%)Table 2 Therapeutic efficacy comparison between the two groups (n%)
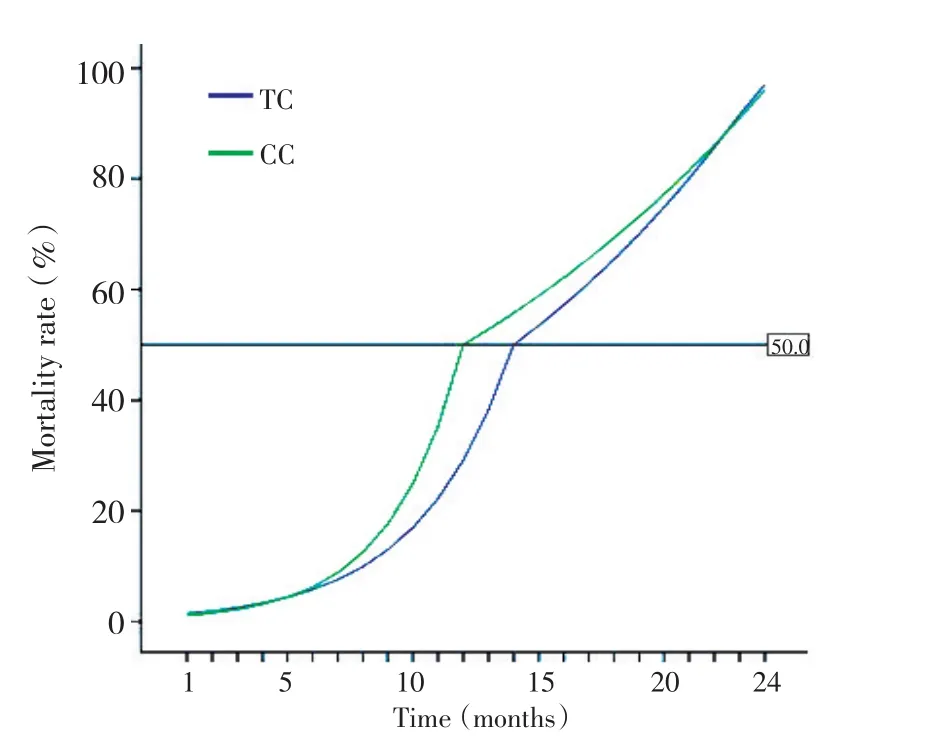
图1 两组生存率曲线比较Figure 1 Survival rates comparison between the two groups
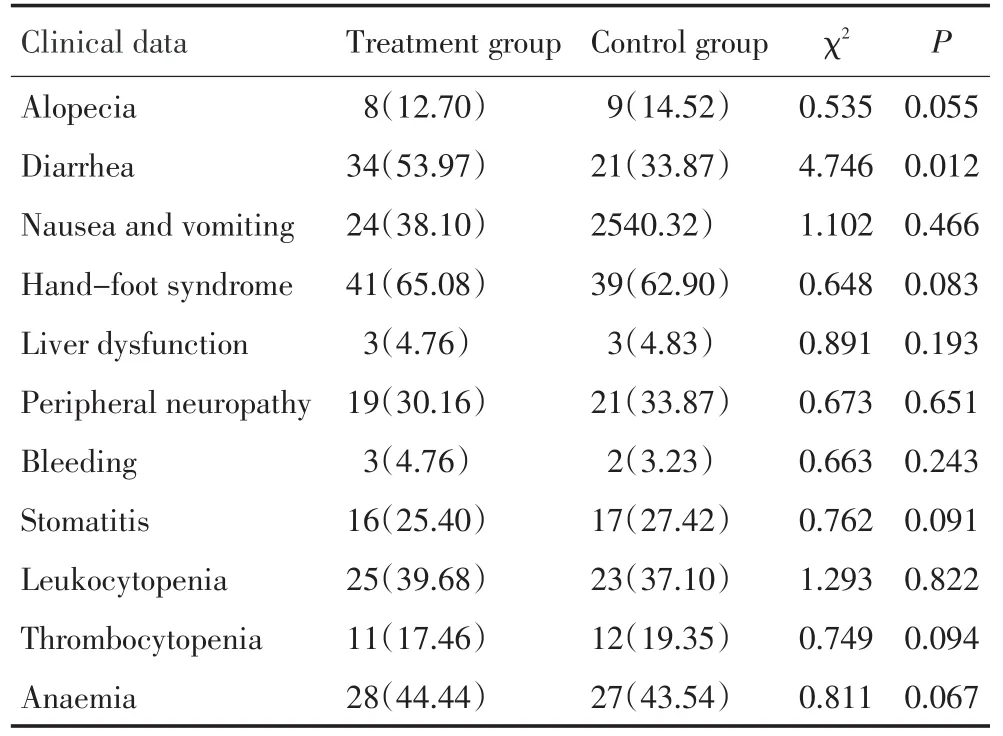
表3 两组Ⅲ、Ⅳ级药物不良反应比较 例(%)Table 3 Level-Ⅲ and-Ⅳ adverse reaction comparison in the two group(n%)
3 讨论
在全世界范围内,结直肠癌每年造成大于600 000例患者的死亡,目前已受到公共卫生组织的广泛关注[8];其早期诊断率较低、手术切除率低以及复发转移率高,一旦发生肝转移,患者的生存时间明显缩短,中位PFS为13个月左右,5年生存率仅为7.8%[9];目前,有效的晚期肠癌治疗方案依然是临床亟待解决的问题,因为对于晚期结直肠患者,大多已经丧失了手术机会,即使能行癌肿局部切除术,不但不能减少远处器官转移风险,还对排便及性功能产生影响,降低了患者的生存质量,缩短患者生存期,故全身化疗仍然是最主要的治疗手段。肿瘤的抗药性,使肿瘤对化疗药物相对不敏感,使单药化疗的疗效成下降趋势,并逐渐出现耐药[10],故需要寻找有效的联合化疗手段。近年来,采用奥沙利铂、伊立替康(CPT-11)联合卡培他滨治疗晚期肠癌的方案都具有较好的耐受性,且疗效显著。
而目前对于结肠癌伴有肝转移的患者,主要采用手术治疗或是肝动脉化疗栓塞的治疗方法;张家文[11]研究报导,肝动脉化疗栓塞治疗肠癌肝转移,其PFS为11个月,明显高于对照组5个月;陈骏等[12]研究,用FOLFOX4方案治疗肠癌肝转移,发现PFS为17.5个月,中位生存期为19.7个月。Lv等[13]用XELOX方案治疗肝转移癌其中位PFS能达到5.6个月,短期的ORRs为34.1%,全身化疗对肝转移有效,故寻找有效的联合化疗方案有重要临床意义。
本研究分别有奥沙利铂联合卡培他滨和CPT-11联合卡培他滨两药连用于结肠癌肝转移患者;治疗组的短期生存率,其ORR、DCR分别为33.3%、66.7%;对照组ORR、DCR分别为35.5%、70.9%;两组比较,差异无统计学意义(P>0.05)。罗秦英等[14]利用CPT-11联合卡培他滨治疗转移性结直肠癌,其结果135例患者疗效及不良反应评价:其中CR 0例,PR 63例(46.7%),SD 42例(31.1%),PD 30例(22.2%),总有效率(CR+PR)46.7%,临床获益率(CR+PR+SD)77.8%。同本研究结果相似;Cvetanovic等[15]研究表明,化疗联合靶向药物治疗的有效率为ORR 40.56%,DCR为82.36%;其结果优于本研究结果,与其联合应用靶向药物有关。
本研究治疗组和对照组的中位总生存期分别为14.0个月和12.0个月,中位无进展生存期分别为5个月和4个月,两组比较差异无统计学意义(P>0.05);Chuang等[16]相关研究,中位无进展生存期时间6个月,中位生存期12.8个月,与本研究结果基本相似。
两组Ⅲ、Ⅳ级药物不良反应主要为血液学毒性,消化道反应和手足综合症等发生率较高;其治疗组的腹泻明显高于对照组,差异有统计学意义(P<0.05);同伊立替康引起的延迟性腹泻有关[17],但应用止泻对症治疗,不良反应能得到有效控制,未影响化疗进程。
综上所述,伊立替康或奥沙利铂联合卡培他滨都是治疗晚期结直肠癌伴肝转移的有效方案,具有较高的总缓解率,能够改善无进展生存期及总生存期,疗效肯定,安全性好,不良反应较小,给药方便,具有良好的应用前景,可以根据患者的个体需求,灵活选用。
1 Mirpuri-Mirpuri PG,Alvarez-Cordoves MM,Perez-Monje A.Screening program for the early diagnosis of colorectal cancer in the Canary Islands:Presentation of a case[J].Semergen,2013,39(8):e71-e74.
2 Chang YS,Chang SJ,Yeh KT,et al.RAS,BRAF,and TP53 Gene Mutations in Taiwanese Colorectal Cancer Patients[J].Onkologie,2013,36(12):719-724.
3 Goos JA,Coupe VM,Diosdado B,et al.Aurora kinase A(AUR⁃KA)expression in colorectal cancer liver metastasis is associated with poor prognosis[J].Br J Cancer,2013,109(9):2445-2452.
4 Liu Ch,Wan w,Zeng F,et al.Clinical efficacy of radiofrequency ab⁃lation combined with chemotherapy pump implanted liver metasta⁃sis colorectal cancer metachronous[J].Chinese Journal of Gerontolo⁃gy,2012,8(32):3553-3554.[刘驰,万春,曾峰,等.射频消融合并化疗泵植入治疗大肠癌异时性肝转移的疗效[J].中国老年学杂志,2012,8(32):3553-3554.]
5 Jiang W,Chen ZD.Clinical study about the safety of combination of irinotecan,fluorouracil with leucovor for elderly colorectal cancer[J].Acta Universitatis Medicinalis Anhui,2010,45(2):237-240.[江伟,陈振东.FOLFIRI方案治疗老年结直肠癌安全性临床观察[J].安徽医科大学学报,2010,45(2):237-240.]
6 Iguchi T,Idani H,Asami S,et al.Hepatic arterial infusion chemo⁃therapy prior to standard systemic chemotherapy in patients with highly advanced unresectable liver metastases from colorectal cancer:a report of three patients[J].Acta Med Okayama,2011,65(1):49-53.
7 Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors.European Orga⁃nization for Research and Treatment of Cancer,National Cancer Institute of the United States,National Cancer Institute of Canada[J].J Natl Cancer Inst,2000,92(3):205-216.
8 Strickler JH,Hurwitz HI.Palliative Treatment of Metastatic Colorectal Cancer:What is the Optimal Approach[J]?Curr Oncol Rep,2014,16(1):363.
9 Vog TJ,Dommermuth A,Heinle B,et al.Colorectal cancer liver metastases:long-term survival and progression-free survival after thermal ablation using magnetic resonance-guided laser-induced interstitial thermotherapy in 594 patients:analysis of prognostic fac⁃tors[J].Invest Radiol,2014,49(1):48-56.
10 Kennecke H,Chen L,Blanke CD,et al.Panitumumab monothera⁃py compared with cetuximab and irinotecan combination therapy in patients with previously treated KRAS wild-type metastatic colorectal cancer[J].Curr Oncol,2013,20(6):326-332.
11 Zhang JW.Comparative analysis of interventional therapy and palli⁃ative chemotherapy on the colorectal cancer with liver metastasis[J].China Health Care&Nutrition,2012,8(2):2527.[张家文.肠癌并肝转移介入治疗与姑息化疗临床对比分析[J].中国保健营养,2012,8(2):2527.]
12 Chen J,Ju LT,Duan SB,et al.Comparative analysis of clinical curative effect on Surgical therapy and neoadjuvant chemotherapy for colorectal liver metastases[J].Chinese Journal of Clinical Oncology,2009,36(16):920-921.[陈骏,居来提,段绍斌,等.肠癌肝转移外科治疗与新辅助化疗临床对比分析[J].中国肿瘤临床,2009,36(16):920-921.]
13 Lv J,Liu N,Liu KW,et al.A Randomised Controlled Phase Ⅱ Tri⁃al of the Combination of XELOX with Thalidomide for the First-line Treatment of Metastatic Colorectal Cancer[J].Cancer Bi⁃ol Med,2012,9(2):111-114.
14 Luo QY,Luo MN,Tang L,et al.Study of Irinotecan plus Capecitabine combination in the treatment of patients with metastat⁃ic colorectalcancer[J].Chinese Journal of Clinicians(Electronic Edi⁃tion),2013,7(11):4708-4712.[罗秦英,罗敏娜,唐露,等.伊立替康联合卡培他滨治疗转移性结直肠癌的临床研究[J].中华临床医师杂志,2013,7(11):4708-4712.]
15 Cvetanovic A,Vrbic S,Filipovic S,et al.Safety and efficacy of addi⁃tion of bevacizumab to oxaliplatin-based preoperative chemothera⁃py in colorectal cancer with liver metastasis-a single institution ex⁃perience[J].J BUON,2013,18(3):641-646.
16 Chuang SC,Su YC,Lu CY,et al.Risk factors for the development of metachronous liver metastasis in colorectal cancer patients after curative resection[J].World J Surg,2011,35(2):424-429.
17 Zhang HG,Lin J,Qin SK,et al.A randomized trial of irinotecan plus fuororuacil and leucovorin with thalidomide versus without thalido⁃mide in the treatment for advanced colorectal cancer[J].Chinese Journal of Oncology,2007,29(3):228-231.[张弘纲,李进,秦叔逵,等.国产伊立替康加5-氟尿嘧啶加亚叶酸钙联合沙利度胺治疗晚期大肠癌的随机对照研究[J].中华肿瘤杂志,2007,29(3):228-231.]

