双基因溶瘤腺病毒联合5-FU抑制肺癌细胞增殖的研究
王世兵,孟树林,武 虎,马步云
(浙江理工大学,a.生命科学学院科研实验中心;b.新元医学与生物技术研究所,杭州310018)
双基因溶瘤腺病毒联合5-FU抑制肺癌细胞增殖的研究
王世兵a,孟树林b,武 虎b,马步云b
(浙江理工大学,a.生命科学学院科研实验中心;b.新元医学与生物技术研究所,杭州310018)
研究携带TRAIL和Smac的双基因溶瘤腺病毒(ZD55-TRAIL-IFTD-Smac)联合化疗药物5-氟尿嘧啶(5-FU)对肺癌细胞的体外杀伤作用。通过MTT法检测细胞抑制率,流式细胞术检测细胞凋亡率,Western Blot检测杀伤性基因表达与凋亡相关蛋白表达。结果显示ZD55-TRAIL-IFTD-Smac与5-FU联合应用能有效地抑制肺癌细胞的增殖,并通过激活Caspase通路诱导肺癌细胞产生凋亡,表明,5-FU能够显著增强携带TRAIL和Smac的双基因溶瘤腺病毒对肺癌细胞的杀伤作用,为肺癌的临床应用提供了参考。
ZD55-TRAIL-IFTD-Smac;5-FU;肺癌;凋亡
0 引 言
肺癌是最为常见的恶性肿瘤之一,尤其在城市,其高发病率与死亡率都居于恶性肿瘤之首,严重威胁着人类的健康。目前,肺癌治疗仍然以传统的手术放疗、化疗为主,然而其治疗后5年生存率仅为15%,随着人类对癌症发病机制的深入研究,人们把关注的目光投向了生物治疗[1-2]。中国科学院刘新垣院士在提出癌症靶向基因-病毒治疗的策略[3](cancer targeting gene-virotherapy,CTGVT)后又提出了癌症的靶向双基因治疗策略[4-5](Cancer targeting dual gene-virotherapy),其基本理念是利用肿瘤细胞与正常细胞在基因表达谱上的差异,人为改造病毒,使病毒能特异性地在肿瘤细胞中复制与增殖,最终裂解细胞,而在正常细胞中几乎不复制,对正常细胞安全。同时以这种肿瘤特异性的病毒为载体,将外源抑癌基因克隆到病毒基因组中,随着病毒不断扩增,使得抗癌基因得到高表达,病毒与抑癌基因两者协同作用达到抗肿瘤的作用。
以ZD55-gene系统构建的溶瘤腺病毒具有仅特异地在肿瘤细胞内复制增殖,从而杀死癌细胞,而不影响正常细胞的特性。双基因溶瘤腺病毒ZD55-TRAIL-IFTD-Smac治疗肝癌移植瘤的研究显示,ZD55-TRAIL-IFTD-Smac能在体外、体内抑制肝癌细胞的增殖[6],但治疗肺癌的研究未见报道。5-FU是一种抗肿瘤的化疗药物,抑制脱氧胸苷酸合成酶,阻止脱氧尿苷酸(d UMP)甲基化转变为脱氧胸苷酸(d TMP),从而影响DNA的合成。尽管5-FU单独治疗并不能显著改善患者的生存率,然而通过与溶瘤腺病毒联合治疗,5-FU通常有不错的协同治疗效果,研究表明ZD55-MnSOD联合5-FU具有协同作用,可以显著提高对结肠癌的疗效[7],5-FU与Addel-F1B55联合治疗可以减少单独治疗时的用药量,治疗效果却要高于单独用药的疗效[8]。Adsh TS与5-FU联合治疗有效地抑制了DLD-1/ 5FU,KM12C/5FU和N M GC-3/5FU三种耐药癌细胞的增殖[9]。5-FU与h TRAIL联合治疗能显著提高h TRAIL诱导多种癌细胞的凋亡[10-12],而且这种协同作用在一些多药耐药细胞系以及TRAIL耐药癌细胞系都有所发现[13-14]。因此,基因治疗和化疗联合治疗可以作为癌症治疗的新思路。
TRAIL基因属于TNF超家族,由于其具有特异性地诱导多种肿瘤细胞凋亡且不影响正常细胞的特性而备受青睐。TRAIL基因主要通过结合于肿瘤细胞表面的死亡受体,促使依赖于线粒体信号途径的细胞凋亡[15-16]。尽管TRAIL可通过与死亡受体DR4或DR5特异地结合并诱导癌细胞凋亡[17-18],然而许多癌细胞对TRAIL诱导的凋亡高度钝化[19-21]。Smac基因可以通过Cytochrome c/ Apaf-1/Caspase-9信号通路,激活Caspase级联反应,主要通过抑制IAPs,促进细胞凋亡[22]。Smac过表达可以有效增加细胞对凋亡刺激的敏感性[23-24];因此,笔者联合双基因溶瘤腺病毒ZD55-TRAIL-IFTD-Smac与5-FU体外作用于肺癌细胞,其效果远远强于基因治疗或化疗分别单独作用肺癌细胞时的效果。本研究主要探讨了ZD55-TRAILIFTD-Smac联合5-FU对于肺癌细胞增殖的抑制以及其诱导细胞凋亡的机制。
1 材料与方法
1.1 材料
人肺癌细胞株H1299、NCI-H460和A549由本实验室保存,细胞均培养于体积分数为5%CO2、37℃的培养箱中,细胞培养液为含10%FBS的DMFM(Dulbeccos modified Fagle medium),DMFM购自杭州吉诺生物技术有限公司,FBS购自GIBCO公司;MTT染料购自Sigma公司;Caspase-3,Caspase-8抗体购自Cell Signaling Technology公司;TRAIL、Smac、F1A、poly(ADP-ribose)polymerase(PARP)和GAPDH抗体均购自Santa Cruz公司;BCA法蛋白定量试剂盒购自Thermo Fisher公司;IRDye®680Donkey Anti-Goat IgG,IRDye® 680 Donkey Anti-Mouse IgG,IRDye®800 Donkey Anti-Rabbit IgG均购自LI-COR公司。
1.2 方法
1.2.1 MTT染色检测细胞增殖
取生长状态良好的对数生长期细胞,收集细胞,用含5%FBS的DMFM重悬细胞,计数,将细胞稀释至需要的密度,以每孔100μL接种于96孔板中,使细胞密度为1×104个/孔。5%CO2、37℃培养12 h分别在相应孔中加病毒ZD55-TRAIL-IFTDSmac,5-FU,病毒ZD55-TRAIL-IFTD-Smac+5-FU,实验组与对照组分别设5个复孔。孵育72 h后,每孔加入20μL MTT溶液(5 g/L,即0.5% MTT),继续培养4 h后终止培养,小心吸去孔内配养液,每孔加入150μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,酶联免疫检测仪测量各孔的OD490 nm吸光值,同时设置调零孔。细胞生存率=(处理组吸光值-调零孔吸光值)/(对照孔吸光值-调零孔吸光值)×100%。
1.2.2 流式细胞术检测细胞凋亡率
在6孔板中以每孔5×105个细胞接种细胞,37℃、5%CO2贴壁培养12 h后,在处理组细胞中分别加入0.8μg/mL 5-FU,4MOI病毒ZD55-TRAIL-IFTD-Smac,0.8μg/mL 5-FU+4MOI病毒ZD55-TRAIL-IFTD-Smac,对照组中加入相同体积的PBS,37℃、5%CO2继续培养48 h后,吸去培养基,按细胞传代方法收集细胞,参照AnnexinⅤ/PI双染细胞凋亡检测试剂盒操作说明,用预冷的PBS洗涤收集的细胞2遍,然后用100μL的1×结合缓冲液重悬细胞,每孔中分别加入5μL的1×Annexin-Ⅴ和5μL的1×PI,室温下避光摇床上低速孵育15 min后,加入400μL 1×结合缓冲液,流式细胞仪分析。
1.2.3 Western blot检测目的基因及细胞凋亡信号通路中关键蛋白的表达
将5×105个细胞接种到6孔板中,37℃、5% CO2贴壁培养12 h后,在处理组细胞中分别加入0.8μg/mL 5-FU,4MOI病毒ZD55-TRAIL-IFTDSmac,0.8μg/mL 5-FU+4MOI病毒ZD55-TRAILIFTD-Smac,设立加入等量PBS为对照组,37℃、5% CO2,继续培养48 h后按Western blot操作裂解细胞收集上清总蛋白。按Thermo Fisher公司BCA蛋白定量试剂盒操作说明定量收集的蛋白浓度。将定量蛋白以每孔加入10μg总蛋白样加入SDSPAGF电泳,电泳结束后按半干转膜法转膜(NC膜),5%的脱脂奶粉中封闭2 h,一抗孵育,按抗体说明书上的最佳稀释浓度稀释加一抗(1∶1 000稀释),室温下于摇床孵育2 h,TBST洗膜3次,每次10 min,加入稀释好的荧光二抗(1∶15 000稀释),室温下摇床孵育45~60 min,TBST洗膜3次,每次10 min,用LI-COR扫膜仪扫膜,红外激光成像系统对待测蛋白进行分析。
1.2.4 统计学分析
所有实验数据均采用SPSS统计软件进行方差分析,全部结果用(均值±标准差)表示。
2 结 果
2.1 MTT分析检测5-FU与病毒联用对肺癌细胞的抑制作用
本实验分别利用目的病毒ZD55-TRAILIFTD-Smac,5-FU,ZD55-TRAIL-IFTD-Smac与5-FU联用处理H1299、NCI-H460和A549肺癌细胞。细胞处理分别设ZD55-TRAIL-IFTD-Smac 1、2、4、8 MOI的4个梯度,设5-FU 0.2、0.4、0.8、1.6 μg/mL的4个梯度。如图1所示,ZD55-TRAILIFTD-Smac单独处理H1299,NCI-H460和A549肺癌细胞时,其抑制率分别为1.4%~37.1%,5.4%~47.9%,6.9%~47.9%。5-FU单独处理H1299,NCI-H460和A549肺癌细胞时,其抑制率分别为6.6%~46.8%,5.1%~44.5%,3.6%~44.9%。ZD55-TRAIL-IFTD-Smac与5-FU联用其抑制率分别达到17.9%~74.8%,19.7%~71.3%,17.1%~75.5%。从图2上可以看出,二者的联用有效地抑制了肺癌细胞的增殖,联用的作用效果不是简单地二者单独作用效果的叠加,二者具有一定的协同作用。

图1 MTT法检测细胞存活率
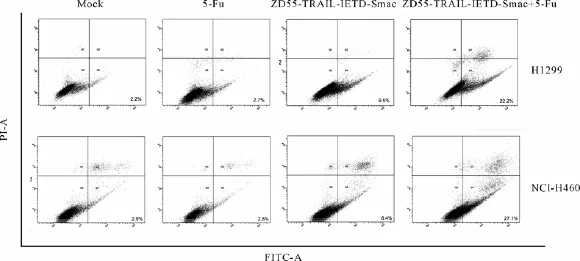
图2 流式细胞术检测细胞凋亡
2.2 流式细胞术检测细胞凋亡率
ZD55-TRAIL-IFTD-Smac,5-FU,ZD55-TRAILIFTD-Smac与5-FU联用分别处理H1299,NCIH460肺癌细胞,处理剂量分别为4MOI,0.8μg/ mL,4MOI+0.8μg/mL,设立加等量PBS的对照组,37℃、5%CO2继续培养48 h后收集细胞,AnnexinⅤ/PI双染后流式细胞仪检测细胞凋亡。如图2在Q4区AnnexinⅤ高阳性,PI低阳性的区域为早期凋亡细胞。实验结果表明对照组,ZD55-TRAIL-IFTD-Smac,5-FU,ZD55-TRAIL-IFTDSmac与5-FU联用分别处理H1299,NCI-H460细胞,H1299细胞早期凋亡率依次为2.2%、2.7%、9.5%、22.2%;NCI-H460细胞早期凋亡率依次为2.9%、2.8%、6.4%、27.1%。说明ZD55-TRAILIFTD-Smac与5-FU联用起到了很好地诱导肺癌细胞凋亡的作用。
2.3 Western blot检测抑癌基因及凋亡相关蛋白的表达变化
ZD55-TRAIL-IFTD-Smac,5-FU,ZD55-TRAILIFTD-Smac与5-FU联用处理NCI-H460细胞,剂量为4MOI+0.8μg/m L,设立加等量PBS的对照组,37℃、5%CO2培养48 h,Western blot检测目的基因TRAIL、Smac的表达及凋亡相关蛋白的变化。结果如图3,在ZD55-TRAIL-IFTD-Smac,ZD55-TRAIL-IFTD-Smac与5-FU联用处理A549细胞中,TRAIL和Smac都有很高的表达。在未处理组,ZD55-TRAIL-IFTD-Smac,5-FU,ZD55-TRAIL-IFTD-Smac与5-FU联用处理组中凋亡相关蛋白caspase-8的前体及激活的Caspase-8表达量都有显著升高。同时我们检测到相应组细胞中Caspase-3及其活化形式呈现显著变化,ZD55-TRAIL-IFTD-Smac,ZD55-TRAIL-IFTD-Smac与5-FU联用处理组细胞Caspase-3活化的增强,继而剪切凋亡底物PARP相应增加,图4进一步有力地说明了ZD55-TRAIL-IFTD-Smac与5-FU联用可以有效地诱导肺癌细胞凋亡。
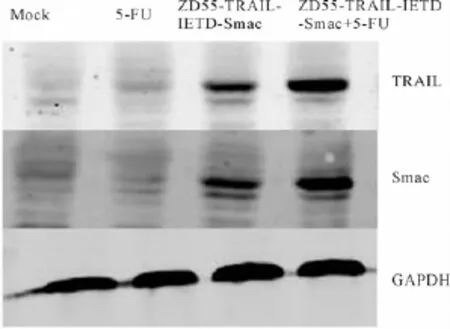
图3 Western blot检测目的基因的表达

图4 Western blot检测凋亡相关蛋白的表达
3 讨 论
笔者成功地进行了溶瘤腺病毒ZD55-TRAILIFTD-Smac联合5-FU抗癌药物抑制肺癌细胞增殖和诱导其凋亡的体外研究。MTT实验结果显示,ZD55-TRAIL-IFTD-Smac联合5-FU在处理剂量为8MOI+1.6μg/mL时效果最为明显,其对H1299、NCI-H460和A549细胞的抑制率分别达到了74.8%、71.3%、75.5%,表明二者联合对细胞的抑制效果明显强于ZD55-TRAIL-IFTD-Smac和5-FU分别单独对细胞的抑制作用。流式细胞术用来检测ZD55-TRAIL-IFTD-Smac联合5-FU诱导细胞凋亡的情况,实验结果表明二者联合处理细胞时强有力地诱导了肺癌细胞的凋亡,其在处理H1299和NCI-H460两种癌细胞系时都有很好地体现,二者在处理剂量为4MOI+0.8μg/m L,时间为48 h时,诱导H1299,NCI-H460细胞凋亡率分别达到了22.2%、27.1%。有研究表明ZD55-Smac与5-FU联用能起到强有力的协同效果[22],这一点我们的实验结果与前人的实验结果相符。Western blot实验结果表明,用连接子IFTD连接的TRAIL和Smac两段抑癌基因得到了很好地表达,而且其在细胞中能被正确的切割,同时起到了协同抑制肺癌细胞的作用。ZD55-TRAIL-IFTD-Smac联合5-FU有效地刺激了胞内凋亡相关蛋白Caspase-3、Caspase-8和PARP的表达与激活,最终使肺癌细胞凋亡[23]。
如何提高溶瘤腺病毒的靶向性及安全性是溶瘤腺病毒治疗癌症走向临床首要解决的问题。目前主要通过以下几点对溶瘤腺病毒进行改造[25-26]:a)在溶瘤腺病毒的纤维蛋白结节上插入外源多肽,使得溶瘤腺病毒能特异的靶向某一类高表达特异抗原决定簇的癌细胞;b)通过嵌合修饰使溶瘤腺病毒能特异靶向于癌细胞表面的多个靶点;c)通过融合表达融合蛋白在一些缺少腺病毒结合受体(CAR)的癌细胞与溶瘤腺病毒之间架起桥梁,使一些难于被溶瘤腺病毒侵染的癌症得到治疗;d)利用癌症组织特异性启动子控制溶瘤腺病毒复制所需早期基因,使得溶瘤腺病毒仅在表达特异蛋白的癌细胞里大量复制、增殖,而对正常细胞无影响。
伴随着分子生物学,细胞生物学,免疫学,生物信息学的发展,可以筛选更为有效地目的基因作为溶瘤腺病毒攻克癌症的利器。一些植物凝集素,海洋肽内毒素,以及中草药中有用的抗癌成分可装载在溶瘤腺病毒上进行表达,使溶瘤腺病毒成为恶性肿瘤基因治疗的有效载体。
[1]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Wagstaff A J,Keam SJ,McCormack P L.Bevacizumab plus platinum-based chemotherapy:in advanced nonsmall cell lung cancer[J].Bio Drugs.2009,23(3):187-196.
[3]Ranieri G,Gasparini G.Angiogenesis and angiogenesis inhibitors:a new potential anticancer therapeutic strategy[J].Current Drug Targets Immune,Fndocrine and Metabolic Disorders,2001,1(3):241-253.
[4]Zhang Z,Huang Y,Newman K,et al.Reexpression of human somatostatin receptor gene 2 gene mediated by oncolytic adenovirus increases antitumor activity of tumor necrosis factor-related apoptosis-inducing ligand against pancreatic cancer[J].Clinical Cancer Research:an official journal of the American Association for Cancer Research,2009,15(16):5154-5160.
[5]Zhang Y,Gu J,Zhao L,et al.Complete elimination of colorectal tumor xenograft by combined manganese superoxide dismutase with tumor necrosis factor-related apoptosis-inducing ligand gene virotherapy[J].Cancer Research,2006,66(8):4291-4298.
[6]Wang S B,Tan Y,Lei W,et al.Complete eradication of xenograft hepatoma by oncolytic adenovirus ZD55 harboring TRAIL-IFTD-Smac gene with broad antitumor effect[J].Human Gene Therapy,2012,23(9):992-1002.
[7]Zhang Y,Qin X,Zhang Y,et al.Combination of ZD55-MnSOD therapy with 5-FU enhances antitumor efficacy in colorectal cancer[J].Journal of Cancer Research and Clinical Oncology,2008,134(2):219-26.
[8]Ma G,Kawamura K,Li Q,et al.Combinatory cytotoxic effects produced by F1B-55kDa-deleted adenoviruses and chemotherapeutic agents are dependent on the agents in esophageal carcinoma[J].Cancer Gene Therapy,2010,17(11):803-813.
[9]Kadota K,Huang C L,Liu D,et al.Combined therapy with a thymidylate synthase-inhibiting vector and S-1 has effective antitumor activity against 5-FU-resistant tumors[J].International Journal of Oncology.2011,38(2):355-63.
[10]Keane M M,Fttenberg S A,Nau M M,et al.Chemotherapy augments TRAIL-induced apoptosis in breast cell lines[J].Cancer research,1999,59(3):734-741.
[11]Ashkenazi A,Pai R C,Fong S,et al.Safety and antitumor activity of recombinant soluble Apo2 ligand[J]. The Journal of Clinical Investigation,1999,104(2):155-162.
[12]Mizutani Y,Nakanishi H,Yoshida O,et al.Potentiation of the sensitivity of renal cell carcinoma cells to TRAIL-mediated apoptosis by subtoxic concentrations of 5-fluorouracil[J].Furopean Journal of Cancer,2002,38(1):167-176.
[13]Bonavida B,Ng C P,Jazirehi A,et al.Selectivity of TRAIL-mediated apoptosis of cancer cells and synergy with drugs:the trail to non-toxic cancer therapeutics(review)[J].International Journal of Oncology,1999,15(4):793-802.
[14]Nagane M,Huang H J,Cavenee W K.The potential of TRAIL for cancer chemotherapy[J].Apoptosis:an International Journal on Programmed Cell Death,2001,6(3):191-197.
[15]Walczak H,Miller R F,Ariail K,et al.Tumoricidal activity of tumor necrosis factor-related apoptosis-inducing ligand in vivo[J].Nature Medicine,1999,5(2):157-163.
[16]Muzio M,Chinnaiyan A M,Kischkel F C,et al. FLICF,a novel FADD-homologous ICF/CFD-3-like protease,is recruited to the CD95(Fas/APO-1)death-inducing signaling complex[J].Cell,1996,85(6):817-827.
[17]Pan G,O'Rourke K,Chinnaiyan A M,et al.The receptor for the cytotoxic ligand TRAIL[J].Science,1997,276(5309):111-113.
[18]Wu G S,Burns T F,McDonald 3rd F,et al.KILLFR/DR5 is a DNA damage-inducible p53-regulated death receptor gene[J].Nature Genetics,1997,17(2):141.
[19]Kim K,Fisher M J,Xu SQ,et al.Molecular determinants of response to TRAIL in killing of normal and cancer cells[J].Clinical Cancer Research,2000,6(2):335-346.
[20]Zhang X D,Franco A,Myers K,et al.Relation of TNF-related apoptosis-inducing ligand(TRAIL)receptor and FLICF-inhibitory protein expression to TRAIL-induced apoptosis of melanoma[J].Cancer Research,1999,59(11):2747-2753.
[21]Kim Y S,Schwabe R F,Qian T,et al.TRAIL-mediated apoptosis requires NF-kappaB inhibition and the mitochondrial permeability transition in human hepatoma cells[J].Hepatology(Baltimore,Md),2002,36(6):1498-1508.
[22]Qiu S,Ruan H,Pei Z,et al.Combination of Targe-ting Gene-Viro Therapy with 5-FU enhances antitumor efficacy in malignant colorectal carcinoma[J].Journal of Interferon&Cytokine Research:the Official Journal of the International Society for Interferon and Cytokine Research.2004,24(4):219-230.
[23]Shi Y.Mechanisms of caspase activation and inhibition during apoptosis[J].Molecular Cell,2002,9(3):459-470.
[24]Pan Q W,Zhong S Y,Liu BS,et al.Fnhanced sensitivity of hepatocellular carcinoma cells to chemotherapy with a Smac-armed oncolytic adenovirus[J].Acta Pharmacologica Sinica.2007,28(12):1996-2004.
[25]Vähä-Koskela M J,HeikkiläJ F,Hinkkanen A F. Oncolytic viruses in cancer therapy[J].Cancer Letters,2007,254(2):178-216.
[26]Russell SJ,Peng K W,Bell J C.Oncolytic virotherapy[J].Nature Biotechnology,2012,30(7):658-670.
WANG Shi-bing1,2,MENGShu-Lin1,WU Hu1,MA Bu-yun1
(a.Scientific Research Fxperiment Center,College of Life Science;b.Xinyuan Institute of Medicine and Biotechnology,Zhejiang Sci-Tech University,Hangzhou 310018,China)
Study on Inhibition of Lung Cancer CeII ProIiferation by Combination of DuaI-Gene OncoIytic Adenovirus with 5-FU
The study explores the in-vitro lethal effects of dual-gene oncolytic adenovirus(ZD55-TRAIL-IFTD-Smac)with TRAIL and Smac in combination of 5-FU on lung cancer cells.Cell inhibition ratio,apoptosis rate,destruction gene expression&apoptosis-related protein expression were detected by MTT,flow cytometry and Western Blot respectively.The results show that combined application of ZD55-TRAIL-IFTD-Smac and 5-FU can effectively inhibit the proliferation of lung cancer cells and induce apoptosis of lung cancer cells through activating Caspase passage.This indicates that 5-FU can significantly enhance lethal effects of dual-gene oncolytic adenovirus with TRAIL and Smac on lung cancer cells.This provides reference for clinical application of lung cancer.
ZD55-TRAIL-IFTD-Smac;5-FU;lung cancer;apoptosis
Q789
A
(责任编辑:许惠儿)
1673-3851(2014)04-0445-06
2013-10-21
国家自然科学基金(51272236,51002139);浙江省自然科学基金(LY13H080005);浙江省公益性技术应用研究计划项目(2014C37101)
王世兵(1986-),男,安徽宣城人,助理实验师,研究方向为恶性肿瘤的生物治疗。

