Chelex-100法提取DNA用于差异甲基化基因座检测的研究
成 振 严 鹏 白丽娟 贾琳娜 郭大玮
山西医科大学法医学院,太原 030001
越来越多的研究资料表明,来自双亲的同源染色体或者等位基因有功能上的差异:有些只有父源的基因有转录活性,而母源的等位基因则一直处于沉默状态,另一些基因的情况则相反。这是由于来源于某一亲本的等位基因或其所在的染色体发生了表观遗传修饰,导致不同亲本来源的两个等位基因在子代细胞中表达不同。这种亲缘依赖的差异表达现象被称为基因组印记,受印记机制调控而差异表达的基因称之为印记基因[1],许多与印记基因和印记控制中心邻近的序列存在DNA甲基化修饰及差异甲基化序列[2],目前对于甲基化的研究多采用甲基化敏感性酶限制性内切酶-PCR法[3]。它是利用甲基化敏感性限制性内切酶对甲基化区不切割而对未甲基化区切割的特性,将DNA消化为大小不同的片段后再进行分析的一种研究甲基化的方法[4-5]。目前用甲基化敏感性限制性内切酶酶切的DNA大多是用有机溶剂法(酚/氯仿)提取或纯化的DNA,而未见Chelex-100法提取DNA作为酶切底物应用于差异甲基化基因座检测的报道。本研究对Chelex-100法提取的DNA应用于差异甲基化的检测进行了分析。
1 材料与方法
1.1 样品及试剂
100份无关人血由山西医科大学法医鉴定中心提供;HhaⅠ购自NEB公司;试验中引物由英潍捷基(上海)贸易公司合成,OPC纯度。Taq酶和Ex Taq Hot Start Version购自宝生物工程有限公司。
1.2 基因组DNA的提取
Chelex-100法提取人血DNA:①向1.5 ml EP管中加入1 ml去离子水,取20μl的枸橼酸钠抗凝样本至1.5 ml EP管中,充分振荡混匀,室温静置20 min,以裂解红细胞,13 000 r/min离心5 min,弃去液体;②加入1 ml灭菌去离子水,振荡混匀按上述步骤反复用灭菌去离子水洗涤,直至上清液无色;③加入20 mg/ml蛋白酶 K 2 μl,56℃水浴 60~90 min,100℃沸水煮15 min,使蛋白充分变性,Chelex-100灭活;④13000r/min离心5 min,吸取上清液至另一EP管中备用。
酚/氯仿法提取人血DNA:①400μl抗凝血中加加入1 ml灭菌去离子水,振荡混匀,13 000 r/min离心5 min,弃去上清液,细胞沉淀中再用1 ml去离子水悬浮,混匀后离心,重复数次至上清液变为无色为止;②上述处理后的样品加TKM2500μl,20 mg/ml PK 3μl混匀后于56℃水浴3~5 h,至液体完全透明;③一次等体积苯酚,一次苯酚/氯仿,一次氯仿抽提,每次抽提需要小心水相和油相充分混匀,13 000 r/min离心5 min,尽量将水相转移至另一离心管中;④向上清液中加2.5倍体积的冰无水乙醇,同时加入1/10体积的3 mol/L醋酸钠,混匀后在-20℃沉淀1 h,14 000 r/min离心20 min,弃去上清液,加入 3倍体积75%空气干燥,采用适量的去离子水溶解,-20℃保存备用。
1.3 定量模板量
经典酚/氯仿法提取DNA的定量:紫外分光光度计测定OD260并定量;Chelex-100法提取DNA的定量:qPCR绝对定量。
1.4 筛选杂合子
对Chelex-100法提取的基因组DNA以CD作为引物进行 PCR 扩增,50 μl体系:10×PCR Buffer 5 μl,dNTP混合物4μl,10μmol/L引物1μl,Taq聚合酶1.25U,模板约40 ng,去离子水补至50μl。扩增条件:94℃预变性 3 min;94℃ 30 s,53℃ 30 s,72℃ 30 s,35 个循环;72℃延伸3 min。用2%琼脂糖凝胶电泳分离检测,纯合子为一条带,杂合子为两条带。
1.5 对杂合子样本基因组DNA用甲基化敏感酶HhaⅠ消化
酶切体系20μl:杂合子样本基因组DNA约20 ng,HhaⅠ 30 U,10×Buffer4 2 μl,BSA 0.2 μl,去离子水补齐至 20 μl,37℃ 15 h,65℃ 20 min 停止酶切离心后备用。
1.6 对甲基化敏感酶HhaⅠ处理过的杂合子基因组DNA用AB引物进行PCR扩增
50 μl体系:2GC×PCR Buffer 25 μl,dNTP 混合物4 μl,10 μmol/L AB 引物 1 μl,Ex Taq Hot Start Version 1.25 U,模板4μl,去离子水补至50μl。扩增条件:95℃预变性 3 min;94℃ 30 s,63℃ 30 s,72℃ 2 min,20个循环;72℃延伸5 min。
1.7 以AB引物的扩增产物为模板用CD引物进行PCR扩增
50μl体系:10×PCRBuffer 5 μl,dNTP 混合物 4 μl,10 μmol/L CD 引物 1 μl,Taq酶 1.25 U,模板 4 μl,去离子水补至50μl。扩增条件:95℃预变性3 min;94℃30 s,53℃ 30 s,72℃ 30 s,20 个循环;72℃延伸 3 min,将CD引物扩增后产物用2%琼脂糖凝胶电泳检测分离,254 nm紫外灯下观察结果。
2 结果
6泳道只扩增出父源一方的等位基因,表明此位点确为差异甲基化位点。1、3泳道也只扩增出父源一方等位基因,表明HhaⅠ在Chelex-100法提取的DNA中也能够工作,Chelex-100法提取的DNA能够作为酶切底物用于差异甲基化基因座的检测(图1)。
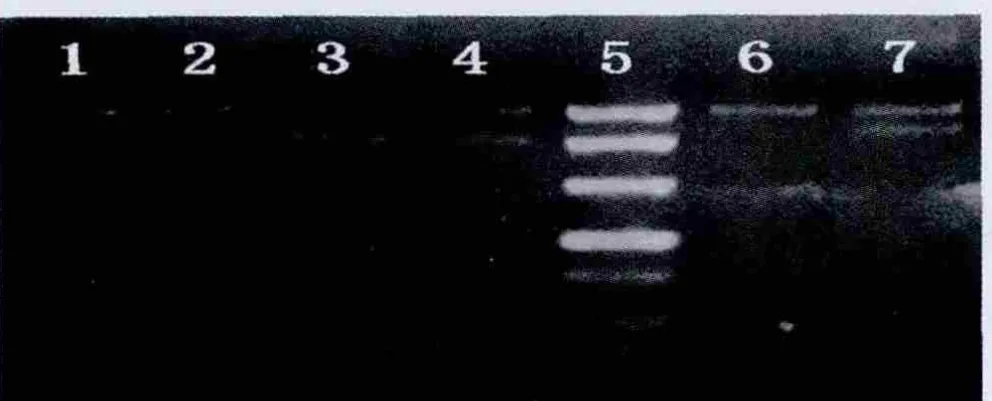
图1 以AB引物的扩增产物为模板用CD引物进行PCR扩增结果图图上方为阴极,下方为阳极,1、3泳道为不同样本Chelex-100法提取的DNA加酶实验组;2、4泳道为1、3泳道未加酶 (由等量去离子水代替)的阴性对照组;6泳道为酚/氯仿法提取DNA加酶阳性对照组;7泳道为6泳道未加酶(由等量去离子水代替)的阴性对照组;泳道5为 Maker,大小 500 bp
3 讨论
Chelex-100法提取的DNA能够作为酶切底物应用于差异甲基化基因座的检测,笔者认为有以下两方面的原因:①法医实际工作中用Chelex-100提取法提取的DNA一般用于进行PCR,PCR反应体系中DNA聚合酶一般除具有耐高温的特性外,其他性质与一般的生物酶相类似。②影响限制性内切酶酶切反应效率的因素包括DNA纯度、反应缓冲液、温度、pH值等。其中提取的DNA中包含有蛋白质、酚、氯仿、乙醇、SDS、EDTA、金属离子等杂质,会影响限制性内切酶的活性,从而影响酶切反应的效率,而Chelex-100提取法提取的DNA中一般不会存在酚、氯仿、乙醇、SDS 等物质,且 Chelex-100 会螯合 Al、Ca、Zn、Mg、Cu、Fe、Ag、Be等常见的影响酶活性的金属离子,在56℃水浴过程中加入PK,能够使蛋白充分消化,减少蛋白对酶切反应的影响。100℃煮沸使蛋白变性,Chelex-100灭活,通过离心去除Chelex-100颗粒,使这些和Chelex-100结合的物质与DNA分离,以免影响下一步的酶切反应。
随着法医实践中应用甲基化敏感性酶限制性内切酶-PCR法对差异甲基化联合STR位点[6],差异甲基化联合SNP位点的研究越来越多[7]。酚/氯仿法提取的DNA虽然具有较高的纯度,但是操作复杂、步骤繁多、耗费的时间较长,而且提取的DNA可能含有酚、氯仿、乙醇等有机溶剂,这些物质都会对限制性内切酶的活性具有一定的影响[8]。相比而言,Chelex-100提取法具有操作简单、检材耗费少、省时省力的特点[9],并且该方法中用到的试剂基本无毒。在法医工作实践中酚/氯仿法提取的DNA检材需求量大,而Chelex-100法用于微量检材DNA的提取在实践中已得到广泛的应用[10],本研究也为差异甲基化能够应用于法医实践提供了依据。
[1]Crawford MH,Beaty KG.DNA fingerprinting in anthropological genetics:past,present,future[J].Investig Genet,2013,4(1):23.
[2]Anupam Paliwal,Thomas Vaissière,Zdenko Herceg.Quantitative detection of DNA methylation states in minute amounts of DNA from body fluids[J].Methods,2010,52(3):242-247.
[3]Zhao G,Huang D,Yang R,et al.Study on the application of parent-of-origin specific DNA methylation markers to forensic genetics[J].Forensic Sci Int,2003,154(2-3):122-127.
[4]赵书民,李成涛.DNA甲基化在法医学中的应用前景及其检测方法新进展[J].法医学杂志,2009,25(4):290-295.
[5]Naito E,Dewa K,Fukuda M,et al.Novel paternity testing by distinguishing parental alleles at a VNTR locus in the differentially methylated region upstream of the human H19 Gene[J].JForensic Sci,2003,48(6):1275-1279.
[6]焦祖义.D15S128位点的STR多态性与差异甲基化联合进行亲子鉴定的研究[D].太原:山西医科大学,2007.
[7]赵贵森,艾红伟,陈晖.SNP rs220028和 STR HUMARA位点甲基化标记的时空稳定性研究[J].医学分子生物学杂志,2006,3(6):419-422.
[8]Singer-Sam J,Tangua RL,Riggs AD.Use of chelex to improve the PCR signal from a small number of cells[J].Amplification,1989,3(1):11-16.
[9]周月琴,朱伟,刘志萍,等.用Chelex-100快速提取微量血痕中的 DNA[J].复旦学报·医学版,2003,30(4):379-380.
[10]郑秀芬.法医DNA分析[M].北京:中国人民公安大学出版社,2002:38-39.

