金黄地鼠高脂血症模型胆固醇代谢紊乱的生物标志物的研究
康卓颖,初欣欣,杨润梅,冀 敏,于 莹,高南南
(1.中国医学科学院北京协和医学院药用植物研究所药理毒理研究中心,北京 100193;2.哈尔滨商业大学生命科学与环境科学研究中心,黑龙江哈尔滨 150076)
高脂血症为一种全身性疾病,是脂质代谢或运转异常,使血浆一种或多种脂质高于正常的病症。心血管病变的基础是动脉粥样硬化,而胆固醇和低密度脂蛋白水平升高则是动脉粥样硬化发生的直接因素[1]。2011年发布的健康白皮书《北京市2011年度卫生与人群健康状况报告》中指出,北京市18~30岁男性的血脂异常患病率竟然高达58.5%,30~40岁男性接近70%。因此,研发降胆固醇和低密度脂蛋白的新型药物依然具有十分重要的意义。研究和筛选有效降脂药物的关键是选择合适的高脂血症动物模型,即选择的模型动物应尽可能地模拟人类脂质代谢途径,并反映人类脂质代谢异常的生理病理过程。金黄地鼠脂蛋白结构与人类相似,其肝脏内源性胆固醇合成比例约为85%,与人类更为接近[2],是目前较为公认的模型动物,但金黄地鼠经高脂饲料诱导形成胆固醇代谢紊乱的机制未见有研究报道。因此,有必要深入探讨该模型胆固醇代谢紊乱的分子机制,为降胆固醇新药的研究及其作用靶标的筛选提供参考依据。
1 材料
1.1 动物 金黄地鼠,♂,6~8周龄,体质量90~110 g,购自北京维通利华实验动物技术有限公司,生产许可证:SCXK(京)2012-0001。
1.2 高脂饲料 金黄地鼠高脂饲料(15%猪油,0.2%胆固醇,84.8%基础饲料)购自北京华阜康生物科技股份有限公司,生产许可证:SCXK(京)2009-0008。
1.3 试剂 血清总胆固醇(total cholesterol,TC)批号:110821、低密度脂蛋白-胆固醇(low density lipoprotein-cholesterol,LDL-C)批号:120531、甘油三酯(triglyceride,TG)批号:110541检测试剂盒,北京中生北控生物科技股份有限公司产品。总RNA提取、反转录和实时荧光定量PCR试剂盒,北京天根生化科技有限公司产品。
1.4 仪器 日本日立7060型全自动生化分析仪;美国BIORAD荧光定量PCR仪;美国General ElectricNano紫外可见蛋白核酸分析仪。
2 方法
将金黄地鼠按随机分组原则分为正常对照组和模型组,正常组饲常规饲料,模型组饲高脂饲料,12只/组。动物饲养在SPF级环境[设施许可证:SYXK(京)2008-0019]。分别于第1、2、3、4周称量体重,眼眶静脉丛取血,离心分离血清,检测血清TC、LDL-C和TG。实验结束时剖取肝脏,用生理盐水制备肝脏匀浆液,离心取上清液测定肝脏TC、TG含量。制备肝微粒体,检测胆固醇7α-羟化酶(cholesterol 7 alpha hydroxylase,CYP7A1)活性。Real-time PCR检测肝脏CYP7A1、肝 X受体 α(liver X receptor alpha,LXRα)、法尼酯受体(farnesoid X receptor,FXR)、肝脏胆固醇 27α-羟化酶(cholesterol 27 alpha hydroxylase,CYP27A1)、低密度脂蛋白受体(low density lipoprotein-receptor,LDL-R)、固醇调节元件结合蛋白-2(sterol regulation element binding protein-2,SREBP-2)mRNA的相对表达变化。
2.1 酶法测定肝脏CYP7A1的活性 制备肝脏CYP7A1微粒体,考马斯亮蓝法测定肝脏CYP7A1微粒体总蛋白含量,按文献[3]酶法测定肝CYP7A1活性,以每克含CYP7A1酶的微粒体蛋白每分钟催化胆固醇生成吸光值为1.00的产物(7α羟-4胆固烯-3酮)的相对量为1个单位(U)。
2.2 实时荧光定量PCR检测 目前GeneBank数据库没有金黄地鼠相关的基因信息,所以利用人类、大鼠、小鼠的保守序列,使用Primer 5软件设计基因引物,并利用Oligo7软件评价引物。PCR引物序列见Tab 1。使用总RNA提取试剂盒按照说明书的步骤提取肝脏组织总RNA,并使用反转录试剂盒将总RNA反转录为cDNA,配置PCR反应体系。Real-time PCR的反应条件:95℃预变性2 min;95℃变性10 s,退火温度根据各引物情况而定,40个循环。扩增结束后,将PCR产物以0.5℃/s程序性升温至95℃,实时荧光定量PCR仪自动绘制融解曲线。β-actin作为内参基因。

Tab 1 PCR primers
2.3 统计学分析 实验数据采用SPSS 15.0软件进行统计,两组间比较采用独立样本t检验,以¯x±s表示。使用RESTⓒ2009软件对基因表达相对定量进行数据分析。
3 结果
3.1 体重观察 正常组和模型组金黄地鼠体重随实验时间延长呈增长现象,于造模第1~4周,模型组体重增长明显高于正常组(P<0.01),见 Tab 2。
3.2 血脂变化 模型组金黄地鼠经高脂饲料诱导1周,与正常组比较,血清TC、LDL-C和TG即明显升高,于造模第2~4周一直维持在高水平状态,与正常对照组比较,血清TC分别升高1.67、1.89、1.45、1.44倍(P<0.01),LDL-C分别升高1.99(P<0.05)、2.12(P<0.01)、1.71(P<0.01)、1.54(P<0.05)倍,TG分别升高 1.78(P<0.01)、2.17(P<0.01)、3.13(P<0.01)、3.74(P<0.01)倍,表明形成了具有明显的高胆固醇、高低密度脂蛋白和高甘油三酯血症特征的高脂血症模型,Tab 3。
3.3 肝脂的变化 模型组经高脂饲料诱导4周后,肝脏TC和TG浓度明显升高,TC和TG与正常组比较,分别升高4.20和1.79倍(P<0.01),形成了肝脏脂肪沉积,Tab 4。
3.4 肝脏CYP7A1活性的变化 金黄地鼠模型组肝脏CYP7A1活性与正常对照组比较明显降低(P<0.05),见Tab 5。
3.5 肝 脏 LDL-R、SREBP-2、CYP7A1、LXRα、FXR、CYP27A1 mRNA基因相对表达变化 β-actin作为内参基因,对各基因的扩增效率进行修正,分析肝脏 LDL-R、SREBP-2、CYP7A1、LXRα、FXR、CYP27A1 mRNA基因相对表达的变化。正常对照组的基因表达量为1.000,模型组肝脏LDL-RmRNA、SREBP-2 mRNA、CYP7A1 mRNA和LXRαmRNA的相对表达量明显下调,分别为0.404±0.248(P<0.01)、0.508±0.249(P<0.05)、0.529±0.358(P<0.01)、0.469±0.252(P<0.01)。模型组肝脏 FXR mRNA的相对表达量明显上调,为1.947±0.956(P<0.05)。CYP27A1 mRNA相对表达无明显变化,Fig 1。
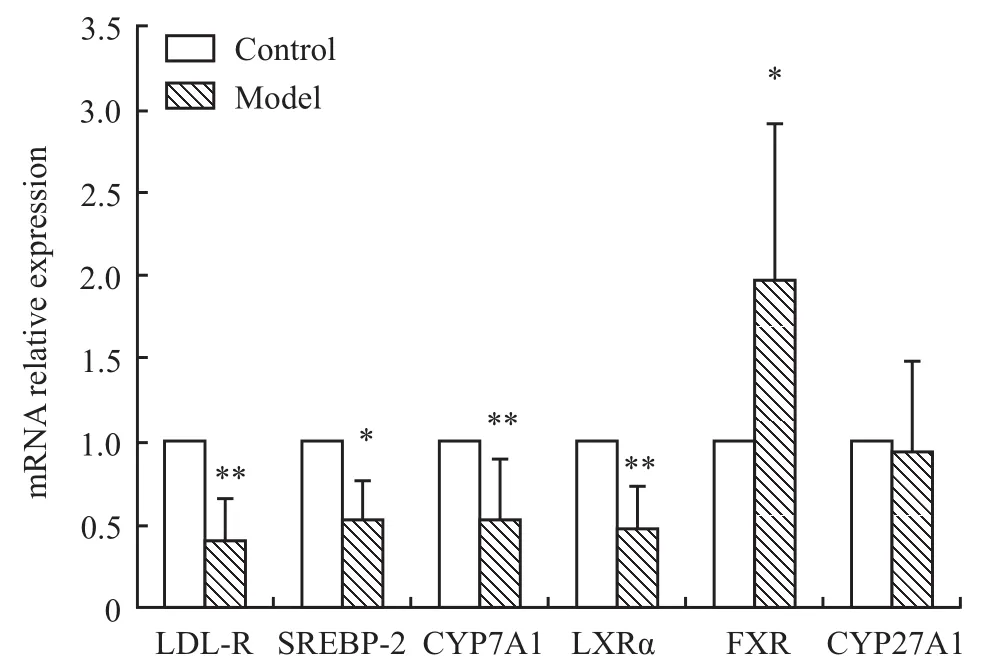
Fig 1 Changes of hepatic LDL-R,SREBP-2,CYP7A1,LXRα,FXR,CYP27A1 mRNA relative expression in hamsters(¯x±s,n=12)*P<0.05,**P<0.01 vs control group
Tab 2 Changes of body weight in hamsters(g±s,n=12)

Tab 2 Changes of body weight in hamsters(g±s,n=12)
*P<0.05,**P<0.01 vs control group
Group Before experiment 1 wk 2 wk 3 wk 4 wk Control 100.4±5.4 109.0±6.1 108.4±6.7 108.3±6.4 111.9±7.8 Model 101.4±5.3 115.7±5.3** 115.7±5.5** 117.6±6.1** 119.2±7.2*
4 讨论
金黄地鼠经高脂饲料诱导后形成了以TC、LDL-C、TG升高为特征的高脂血症模型,同时肝脂也明显升高。本文主要针对胆固醇代谢紊乱问题进行深入探讨。根据前期研究结果,金黄地鼠胆固醇代谢紊乱环节主要集中在胆固醇清除过程中,因此本实验通过对胆固醇清除环节中关键的酶、受体、细胞因子、蛋白变化的研究,阐明金黄地鼠胆固醇代谢紊乱的分子机制。
肝是降解LDL-C主要器官,由肝脏清除的75%的LDLC,其中90%以上是通过低密度脂蛋白受体(LDL-R)途径清除[4],因此血浆中LDL-C水平与LDL-R活性密切相关。而肝细胞表面LDL-R活性由肝细胞内胆固醇通过固醇调节元件结合蛋白-2(SREBP-2)进行调节[5]。当细胞内胆固醇增加时,胆固醇与SREBP裂解激活蛋白(sterol-regulatory element binding proteins,SCAP)的固醇敏感结构域(sterol-sensing domain,SSD)结合,引起 SCAP构象发生变化,从而使SREBP无法与SCAP结合形成SREBP-SCAP复合物进入高尔基复合体进行裂解[6],导致SREBP通路被抑制,使LDL-R基因表达降低。本实验结果表明,模型组经高脂饲料诱导后,肝脏SREBP-2和LDL-R mRNA表达下调,说明肝细胞为维持细胞内胆固醇稳态,抑制SREBP-2转移至高尔基体,使LDL-R表达降低,从而阻抑LDL-C通过LDL-R途径代谢,最终导致血液中LDL-C水平增加。
胆固醇转化为胆汁酸主要通过两条途径:经典途径和替代途径。经典途径是胆汁酸合成的主要途径,胆固醇7α-羟化酶(CYP7A1)是决定此过程的限速酶,替代途径占胆汁酸合成的18%,限速酶为胆固醇27α-羟化酶(CYP27A1),所以CYP7A1的基因表达量和活性对胆固醇转化为胆汁酸的速度起决定作用[7-9]。肝脏法尼酯受体(FXR)与肝 X受体(LXR)分别为CYP7A1的上游转录抑制因子和转录激活因子[10]:FXR通过诱导小异二聚体伴侣(short heterodimer partner,SHP)表达,从而抑制肝受体同系物1(liver receptor homolog-1,LRH-1),阻止LXR激活CYP7A1的表达,最终减少胆固醇转化为胆汁酸[11];LXR存在2种异构体,其中LXRα在肝脏中表达,当肝脏胆固醇过多时,胆固醇的中间代谢产物氧化甾醇也随之增多,作为LXRα的体内配体,氧化甾醇激活LXRα,进而上调CYP7A1,最终促进胆固醇向胆汁酸转化[12-13]。本实验中金黄地鼠模型组肝脏FXR mRNA表达明显上调,LXRαmRNA表达明显下调,CYP7A1活性和基因表达与对照组相比明显降低,CYP27A1 mRNA的相对表达没有明显变化,说明金黄地鼠经高脂饲料诱导后,肝脏FXR被激活,LXRα受到抑制,从而使CYP7A1表达下调及活性降低,使固醇转化为胆汁酸的经典合成途径受到抑制,导致胆固醇代谢紊乱。
以上实验结果表明,金黄地鼠经高脂饲料诱导短期内即可形成高脂血症模型,该模型具有造模周期短,高脂血症明显的特点。其胆固醇代谢紊乱的机制主要为:(1)肝脏SREBP-2表达下调,进而抑制LDL-R的表达,使LDL-C通过LDL-R进行降解的通路受到阻抑,最终引起血液LDL-C水平增加。(2)肝脏 FXR表达上调,LXRα下调,从而使CYP7A1活性和基因表达下调,继而抑制胆固醇转化为胆汁酸的经典合成途径,导致胆固醇分解速率减慢,血液TC浓度明显升高。LDL-R、SREBP-2、CYP7A1、FXR和 LXRα的改变是金黄地鼠高脂血症模型胆固醇代谢紊乱形成的分子机制,它们也是抗高胆固醇血症药物的作用靶标判断的生物标志物。
Tab 3 Changes of serum TC,LDL-C,TG concentration in hamsters(±s,n=12)
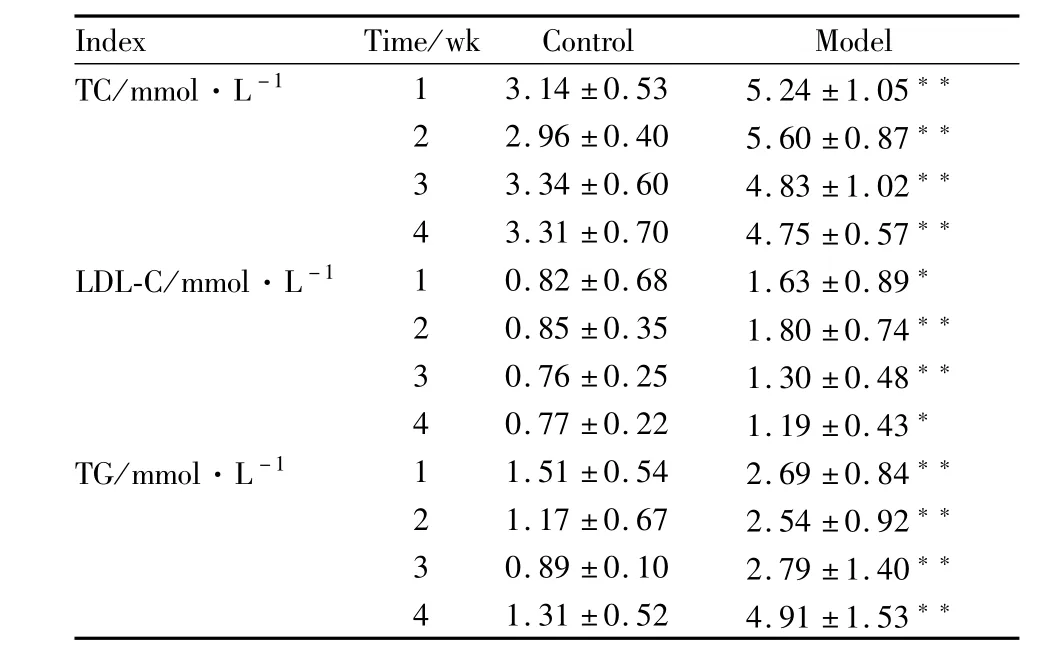
Tab 3 Changes of serum TC,LDL-C,TG concentration in hamsters(±s,n=12)
*P<0.05,**P<0.01 vs control group
Index Time/wk Control Model TC/mmol·L-1 1 3.14±0.53 5.24±1.05**2 2.96±0.40 5.60±0.87**3 3.34±0.60 4.83±1.02**4 3.31±0.70 4.75±0.57**LDL-C/mmol·L-1 1 0.82±0.68 1.63±0.89*2 0.85±0.35 1.80±0.74**3 0.76±0.25 1.30±0.48**4 0.77±0.22 1.19±0.43*TG/mmol·L-1 1 1.51±0.54 2.69±0.84**2 1.17±0.67 2.54±0.92**3 0.89±0.10 2.79±1.40**4 1.31±0.52 4.91±1.53**
Tab 4 Changes of liver TC and TG concentration in hamsters(±s,n=12)

Tab 4 Changes of liver TC and TG concentration in hamsters(±s,n=12)
**P<0.01 vs control group
Group TC/mg·g-1 TG/mg·g-1 Control 0.15±0.09 0.56±0.15 Model 0.63±0.30** 1.00±0.33**
Tab 5 Changes of hepatic CYP7A1 in hamsters±s,n=12)

Tab 5 Changes of hepatic CYP7A1 in hamsters±s,n=12)
*P<0.05 vs control group
Group CYP7A1/U·g-1 Control 21.75±4.93 Model 16.18±2.08*
参考文献:
[1] Fontbonne A,Eschwège E,Cambien F,et al.Hypertriglyceridaemia as a risk factor of coronary heart disease mortality in subjects with impaird glucose tolerance or diabetes[J].Diabetologia,1989,32(5):300-4.
[2] Dietschy J M,Turley SD,Spady D K.Role of liver in the maintenance of cholesterol and low density lipoprotein homeostasis in different animal species including humans[J].J Lipid Res,1993,34(10):1637-59.
[3] Fernandez M L,Sun D M,Tosca M,et al.Guar gum effects on plasma low-density lipoprotein and hepatic cholesterol metabolism in guinea pigs fed low-and high-cholesterol diets:a dose-response study[J].Am J Nut,1995,61(1):127-34.
[4] Jeon H,Blacklow S C.Structure and physiologic function of the low-density lipoprotein receptor[J].Annu Rev Biochem,2005,74:535-62.
[5] Wong J,Quinn C M,Brown A J.SREBP-2 positively regulates transcription of the cholesterol efflux gene,ABCA1,by generating oxysterol ligands for LXR[J].Biochem J,2006,400(3):485-91.
[6] 杜 娆,谢梅林.SREBPs的调节及在非酒精性脂肪肝形成机制中的研究进展[J].中国药理学通报,2009,25(11):1412-5.
[6] Du R,Xie M L.Regulation of SREBPs and its research progress in the development of nonalcoholic fatty liver[J].Chin Pharmacol Bull,2009,25(11):1412-5.
[7] Schwarz M,Russell D W,Dietschy JM,et al.Alternate pathways of bile acid synthesis in the cholesterol 7 alpha-hydroxylase knockout mouse are not upregulated by either cholesterol or cholestyramine feeding[J].J Lipid Res,2001,42(10):1594-603.
[8] Twisk J,de Wit E C,Princen H M.Suppression of sterol 27-hydroxylase mRNA and transcriptional activity by bile acids in cultured rat hepatocytes[J].Biochem J,1995,305(Pt2):505-11.
[9] Nilsson LM,Abrahamsson A,Sahlin S,et al.Bile acids and lipoprotein metabolism:effects of cholestyramine and chenodeoxycholic acid on human hepatic mRNA expression[J].Biochem Biophys Res Commun,2007,357(3):707-11.
[10]Rader D J.Liver X receptor and farnesoid X receptor as therapeutic targets[J].Am J Cardiol,2007,100(11A):n15-9.
[11]Lambert G,Amar M J,Guo G,et al.The farnesoid X-receptor is an essential regulator of cholesterol homeostasis[J].J Biol Chem,2003,278(4):2563-70.
[12]John G,Menke L,Macnaul S,et al.A novel liver X receptor agonist establishes species differences in the regulation of cholesterol 7α-hydroxylase[J].Endocrinology,2002,143(7):2548-58.
[13]宋 鑫,高南南,杨润梅,等.豚鼠高脂血症模型LDL-C代谢紊乱的机制研究[J].中国药理学通报,2012,28(3):342-6.
[13]Song X,Gao NN,Yang R M,et al.Mechanism of hyperlipidemic LDL-C metabolic disorder in the guinea pig[J].Chin Pharmacol Bull,2012,28(3):342-6.

