NF-κB抑制剂PDTC保护全脑缺血/再灌注大鼠海马损伤机制涉及COX2-PGI2/TXA2通路的初探
王 佳,杨俊卿,余丽娟,杨 彬,赵 磊,蒋青松
(重庆医科大学药理学教研室,重庆医科大学生物化学与分子药理学重点实验室,重庆 400016)
缺血性脑血管疾病的死亡率高达30%,是全球导致成年人永久性残疾和死亡的主要原因之一[1]。缺血性脑血管疾病包括全脑缺血和局灶性脑缺血。局灶性脑缺血多为脑栓塞引起,而全脑缺血常见于呼吸心跳骤停、药物中毒、窒息、休克以及外科手术中存在的低压低氧状况。血液灌流恢复后脑缺血损伤进一步加重,即存在“脑缺血/再灌注损伤”。近10年累积的大量研究资料显示,脑缺血/再灌注损伤中炎症的发展是引发迟发性神经元死亡的重要因素[2-3]。炎症过程产生的自由基一方面可以导致自由基损伤,另一方面可与炎性细胞因子一起激活炎症反应,形成炎症反应的恶性循环。因此通过高位阻断炎症通路的级联放大可能对减轻神经元损伤有利。核转录因子 κB(nuclear factor-κB,NF-κB)可通过启动多种炎性基因的转录参与缺血性脑损伤。已有研究证实NF-κB的抑制剂吡咯烷二硫代氨甲基甲酸盐 (pyrrolidine dithiocarbamic,PDTC)可以清除活性氧;另一方面,NF-κB为环氧酶2(cyclooxygenase-2,COX2)的上游调节靶点,COX2基因启动子序列中有2个 NF-κB位点,PDTC可通过抑制 NF-κB而降低 COX2、TNF-α、IL-1β 等的水平,从而产生局灶性脑缺血损伤保护作用[4]。COX2为花生四烯酸代谢生成前列环素(prostacyclin,PGI2)和血栓素A2(thromboxane A2,TXA2)过程中的关键酶。脑缺血/再灌注后NF-κB和COX2蛋白的高表达可能与海马神经元的迟发损伤有关[5]。PGI2/TXA2比例的失调可促进血小板凝集、微循环障碍,从而加重缺血/再灌注脑损伤[6],非甾体抗炎药对局灶脑缺血/再灌注损伤的保护作用与降低PGI2/TXA2比值有关 。但是,目前尚未见从COX2-PGI2/TXA2通路来探讨PDTC对局灶脑缺血/再灌注损伤保护作用机制的报道;另一方面,由于全脑缺血与局灶脑缺血代表的临床疾病是不同的,其损伤机制也可能不完全相同,更未见PDTC对全脑缺血/再灌注脑损伤的作用及其机制报道。因此本研究拟通过建立全脑缺血/再灌注大鼠脑损伤模型,观察PDTC对大鼠全脑缺血/再灌注损伤的影响,并从COX2-PGI2/TXA2通路的改变初步探讨其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 ♂ SD大鼠,SPF级,200 g~250 g,购自重庆医科大学实验动物中心[动物证书号:SCXK(渝)2010-0001]。SPF环境饲养3 d。术前12 h禁食,自由饮水。实验动物随机分为4组,即假手术组、全脑缺血/再灌注组(GCIR组)、PDTC 100 mg·kg-1组(P100组)、PDTC 200 mg·kg-1组(P200组)。每组12 只大鼠。
1.1.2 试剂 PDTC(碧云天生物技术研究所,S1808)、兔抗 COX-2 多克隆抗体(Santa cruz,SC-1745)、6-keto-PGF1α检测ELISA试剂盒(Cayman 公司,515211)、TXB2检测ELISA试剂盒(Cayman公司,519031)。
1.1.3 主要仪器 激光多普勒血流仪(Moor公司;VMS-LDF1型),Morris水迷宫(中国医学科学院药物研究所)。
1.2 方法
1.2.1 脑血流的测定 大鼠以水合氯醛(400 mg·kg-1,ip)麻醉,剪开头部皮肤,暴露前囟和顶骨,在前囟向右旁开3 mm,向后下移3 mm处将激光多普勒血流仪的探头固定于顶骨上,进行全脑缺血/再灌注手术。激光多普勒血流仪记录大鼠手术过程中的脑血流变化,缺血操作时脑血流值下降到其正常血流值40%以下为选入标准。
1.2.2 模型的建立 参照文献[6,8]的方法,将水合氯醛(400 mg·kg-1,ip)麻醉的大鼠仰卧固定,颈正中切口。分离双侧颈总动脉与一侧颈总静脉。由颈总静脉插管入心房,输入肝素化生理盐水。缓慢抽取每只大鼠总血容量体积分数0.3的血液(大鼠体重不同而血容量也不同),双侧颈总动脉夹闭20 min后松开动脉夹,然后缓慢回输血液,结扎颈总静脉,缝合伤口。假手术组除不进行抽血与夹闭双侧颈总动脉,其余手术操作同GCIR。手术过程中,大鼠体温保持在(36.5~37.2)℃。
1.2.3 大鼠空间学习记忆能力测试 水迷宫测试分为两个阶段,第1次训练时将大鼠置于平台上1 min。后将大鼠分别从A、B、C、D 4个象限背对平台入水,让其自由游泳找到隐蔽于水中的平台,观察记录其寻台潜伏期,180 s内未找到平台者将其寻台潜伏期记为180 s。训练4 d,每天4次。第2阶段为测试阶段,第5天时,撤去平台,从A,B,C,D 4个象限随机选定一个位置将大鼠放入水迷宫中,观察并记录大鼠寻台潜伏期作为大鼠记忆成绩。
1.2.4 组织病理学检查 大鼠以水合氯醛(400 mg·kg-1,ip)麻醉,仰卧位固定。剪开胸腔,剥离心包,头皮针经心尖刺入左心室,灌注肝素化生理盐水,以肝脏作为血液与灌注液出口。注入4%多聚甲醛的磷酸缓冲液进行在体脑组织固定。分离脑组织,4%多聚甲醛固定3 d,脑组织冠状面切片,切片厚约5 μm,HE染色观察海马神经元形态及数目变化。于10×40视野下随机选取相应区域10个不重叠视野进行神经元细胞计数。
1.2.5 Western blot测定大鼠海马COX2蛋白表达提取大鼠海马蛋白,加入上样缓冲液煮沸变性。SDS-PAGE电泳,转移至PVDF膜上,室温封闭1 h,TBST洗膜10 min×3次,加入 COX2抗体(1∶100)或β-actin(1∶1 000),4℃过夜,TBST洗膜10 min×3次,辣根酶标记的二抗 (1∶2 000)室温孵育1 h,TBST洗膜10 min×3次,ECL化学发光。以COX2与β-actin的光密度值比值作为COX2蛋白的相对量。
1.2.6 ELISA 测定大鼠海马 6-keto-PGF1α和 TXB2含量 PGI2和TXA2体内迅速被代谢为6-keto-PGF1α和 TXB2,因而测定 6-keto-PGF1α和 TXB2含量。用EIA Buffer将海马制成10 g·L-1的匀浆液,具体操作按Cayman说明书进行。酶标仪上于405 nm波长处测定吸光度值。
2 结果
2.1 模型大鼠手术中脑血流变化 夹闭双侧颈总动脉前,脑血流灌注量均值为(71.36±4.58)PU,缺血时降为 (19.18±4.47)PU,降幅达到73.12%。夹闭完成后,血流迅速恢复,均值为(78.18±8.06)PU,Fig 1为原始记录图。
2.2 PDTC对全脑缺血/再灌注大鼠空间学习记忆能力的影响 水迷宫检测发现,与假手术组相比,训练阶段与测试阶段中,GCIR组大鼠寻台潜伏期均明显延长(P<0.05)。P100组和P200组大鼠寻台潜伏期较GCIR组大鼠明显缩短(Tab 1)。
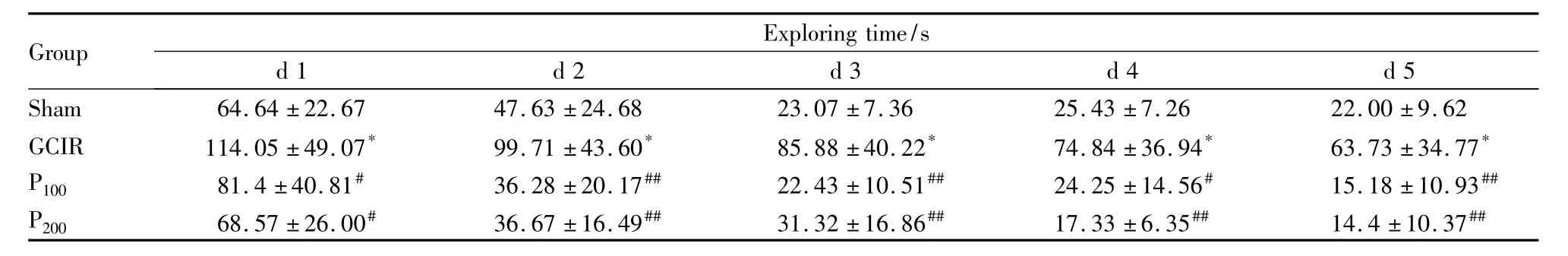
Tab 1 Effects of PDTC on changes of spatial learning and memory function in global cerebral ischemia reperfusion rats(x±s,n=12)
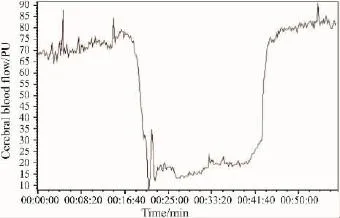
Fig 1 Dynamic changes of rat cerebral blood flow during GCIR
2.3 大鼠海马组织病理形态学变化 假手术组大鼠海马神经元结构清楚完整,细胞排列层次分明。而GCIR大鼠海马神经元出现明显的核固缩,细胞层次及数目明显减少,PDTC预处理组大鼠海马神经元核固缩细胞数目明显少于GCIR组(Fig 2)。P100组和P200组大鼠海马神经元死亡率较GCIR组明显减少,但与假手术组差异仍有显著性,P100组和P200组间变化无统计学意义(Fig 3)。
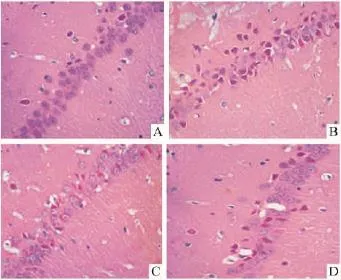
Fig 2 Pathological changes in hippocampus CA1 subfield of rats(×400)
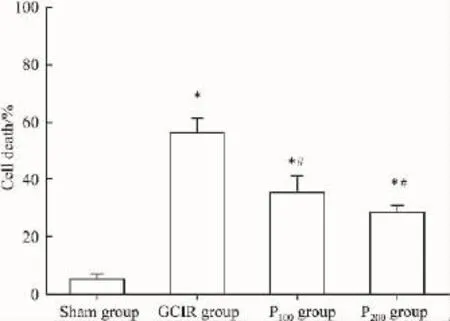
Fig 3Effect of PDTC on decrease of cell death(±s,n=4)
2.4 PDTC对全脑缺血/再灌注大鼠海马COX2蛋白表达的影响 与假手术组比较,GCIR组大鼠海马COX2蛋白表达明显增加;与GCIR组比较,P100组和P200组大鼠海马COX2蛋白表达明显降低,P100组和P200组间则无差异(Fig 4)。
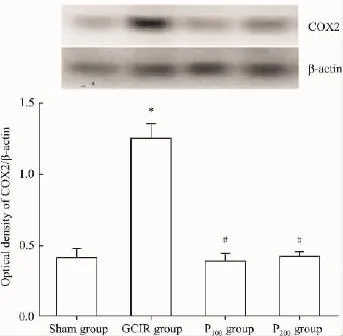
Fig 4Expression of COX2 protein in rat hippocampus(±s,n=4)
2.5 PDTC对全脑缺血/再灌注大鼠海马6-keto-PGF1α/TXB2的影响 与假手术组比较,GCIR组大鼠海马 6-keto-PGF1α、TXB2、6-keto-PGF1α/TXB2比值明显升高。与GCIR组相比,P100组和P200组6-keto-PGF1α、TXB2、6-keto-PGF1α/TXB2比值明显降低(Tab 2)。
Tab 2 Effects of PDTC on levels of 6-keto-PGF1α,TXB2 and 6-keto-PGF1α/TXB2in global cerebral ischemia reperfusion rats(±s,n=4)
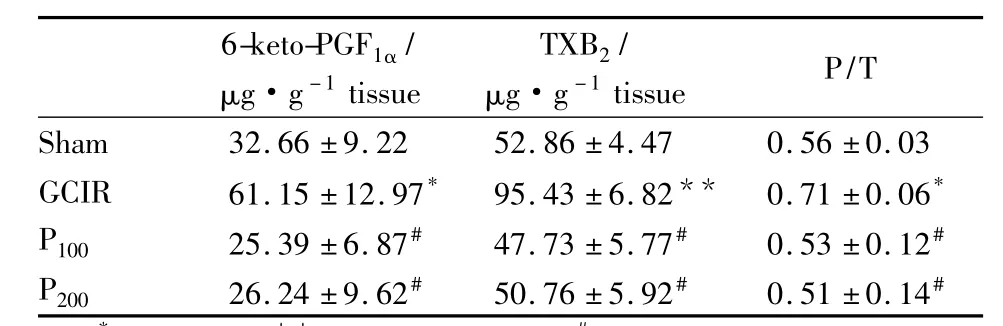
Tab 2 Effects of PDTC on levels of 6-keto-PGF1α,TXB2 and 6-keto-PGF1α/TXB2in global cerebral ischemia reperfusion rats(±s,n=4)
*P <0.05,**P <0.01 vs sham;#P <0.05 vs GCIR
6-keto-PGF1α/μg·g-1tissue TXB2/μg·g-1tissue P/T Sham 32.66 ±9.22 52.86 ±4.47 0.56 ±0.03 GCIR 61.15 ±12.97* 95.43 ±6.82** 0.71 ±0.06*P100 25.39 ±6.87# 47.73 ±5.77# 0.53 ±0.12#P200 26.24 ±9.62# 50.76 ±5.92# 0.51 ±0.14#
3 讨论
PDTC为NF-κB的特异性抑制剂,其通过抑制NF-κB p65亚单位或 I-κB 的降解来抑制 NF-κB 的激活。PDTC最早于1999年用于大鼠体内,且剂量高达 200 mg·kg-1时也未发现明显的毒性作用[8]。现在主要用来治疗金属中毒,且已经广泛用于心脏疾病、脑疾病、肺疾病等的研究中,因此PDTC具有广阔的临床应用前景。本研究采用100 mg·kg-1和200 mg·kg-1PDTC于全脑缺血/再灌注手术前1 h腹腔注射,观察PDTC对全脑缺血/再灌注大鼠海马损伤及COX2-PGI2/TXA2通路的影响。
本研究结果表明,PDTC预处理能明显减轻大鼠海马CA1区神经元的丢失,使核固缩细胞的数目减少,明显改善全脑缺血/再灌注损伤大鼠的空间学习记忆障碍。大量研究证实,COX2参与脑缺血后海马迟发型神经元死亡[10-11]。本研究结果显示,全脑缺血/再灌注后海马COX2蛋白表达升高,PDTC预处理组大鼠的COX2蛋白表达水平较手术组大鼠明显降低,结果提示PDTC对全脑缺血/再灌注大鼠海马神经元的保护作用可能与抑制COX2的过度表达有关。
PGI2和TXA2为花生四烯酸的代谢产物。花生四烯酸经环氧酶生成的PGH2,在PGI2合成酶作用下生成PGI2,在TXA2合成酶作用下生成TXA2。研究显示,脑缺血/再灌注后血浆及大脑皮层中PGI2/TXA2的比值降低,即PGI2合成减少,TXA2合成增多,PGI2/TXA2的比值异常导致微循环障碍[6]。与此研究不同,我们的前期研究[12]及本研究结果均发现全脑缺血/再灌注大鼠海马PGI2和TXA2均明显增高,PGI2/TXA2比值明显上升。PGI2和TXA2明显增高的机制可能是脑缺血/再灌注后自由基的产生和细胞内的钙超载激活磷脂酶A2,使膜磷脂分解产生大量花生四烯酸,COX2活性增高。与我们研究结果相似,肝脏移植缺血/再灌注损伤患者血浆中PGI2及 TXA2明显升高,PGI2/TXA2比值明显增高[13];机械性脑损伤脑组织 PGI2及TXA2合成增加,并且 PGI2增加更显著[14]。也有研究表明[15],大鼠海马神经元中存在前列环素合成酶,脑缺血/再灌注时前列环素合成酶的表达明显增高。这些结果提示,全脑缺血/再灌注12 d时大鼠海马 PGI2/TXA2比值明显增高是机体对脑缺血/再灌注损伤的代偿机制,其对缺血/再灌注脑损伤存在保护作用。我们的实验研究还发现,PDTC预处理组大鼠海马PGI2、TXA2水平及 PGI2/TXA2比值比缺血/再灌注大鼠明显降低,其机制可能为PDTC抑制NF-κB,高位阻断了炎症反应的恶性循环,阻止了PGI2、TXA2合成中的关键酶COX2蛋白表达的异常升高,使PGI2、TXA2及PGI2/TXA2比值恢复正常。
总之,PDTC预处理可减轻全脑缺血/再灌注所致的海马损伤,其机制可能涉及抑制COX2的表达,进而抑制PGI2、TXA2及PGI2/TXA2比值的异常增高,使PGI2、TXA2及PGI2/TXA2比值恢复至正常水平。
[1]Culman J,Nguyen-Ngoc M,Glatz T,et al.Treatment of rats with pioglitazone in the reperfusion phase of focal cerebral ischemia:A preclinical stroke trial[J].Exp Neurol,2012,238(2):243 -53.
[2]张予阳,刘 岩,付守廷.脑缺血与炎症反应[J].中国药理学通报,2006,22(1):5-9.
[2]Zhang Y Y,Liu Y,Fu S T.Cerebral ischemic damage and inflammatory reaction[J].Chin Pharmacol Bull,2006,22(1):5-9.
[3]Zhang J,Barasch N,Li R C,et al.Inhibition of cytosolic phospholipase A2 alpha protects against focal ischemic brain damage in mice[J].Brain Res,2012,1471:129 -37.
[4]Nurmi A,Vartiainen N,Pihlaja R,et al.Pyrrolidine dithiocarbamate inhibits translocation of nuclear factor kappa-B in neurons and protects against brain ischaemia with a wide therapeutic time window[J].J Neurochem,2004,91(3):755-65.
[5]翟锴华,卢 宏,腾军放,王兴萍.血管性痴呆大鼠海马区核因子κB、环氧合酶-2的表达变化[J].中国实用神经疾病杂志,2007,10(3):88-9.
[5]Zhai K H,Lu H,Teng J F,Wang X P.Expression of nuclear factor-κB and cyclooxygenase-2 in the hippocampus of rats with vascular dementia[J].Chin J Practical Nervous Dis,2007,10(3):88-9.
[6]吴会生,郭培培,尚 游,等.氟比洛芬酯预处理对大鼠全脑缺血/再灌注时脑组织TXA2/PGI2的影响[J].中国药理学通报,2009,25(9):1176-80.
[6]Wu H S,Guo P P,Shang Y,et al.Effect of flurbiprofenaxetil pretreatment on TXA2/PGI2of brain tissue in rats subjected to global cerebral ischemia-reperfusion injury[J].Chin Pharmacol Bull,2009,25(9):1176 -80.
[7]余 涓,邱丽颖,周 宇,等.缺血/再灌注损伤后神经细胞凋亡及Bcl-2、Bax蛋白表达与罗非昔布的影响[J].中国药理学通报,2005,21(5):572-5.
[7]Yu J,Qiu L Y,Zhou Y,et al.Apoptosis of the neurocytes and the expression of Bcl-2 and Bax proteins after focal cerebral ischemia-reperfusion injury in rats and the effects of Rofecoxib[J].Chin Pharmacol Bull,2005,21(5):572 -5.
[8]Kuang G,He Q,Zhang Y,et al.Modulation of preactivation of PPAR-β on memory and learning dysfunction and inflammatory response in the hippocampus in rats exposed to global cerebral ischemia/reperfusion [J].PPAR Res,2012,2012:article209794,[2013 -09 -12].http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3465902/.
[9]Rangan G K,Wang Y,Tay Y C,et al.Inhibition of nuclear factor-kappaB activation reduces cortical tubulointerstitial injury in proteinuric rats[J].Kidney Int,1999,56(1):118 -34.
[10]Nakayama M,Uchimura K,Zhu R L,et al.Cyclooxygenase-2 inhibition prevents delayed death of CA1 hippocampal neurons following global ischemia[J].Proc Natl Acad Sci USA,1998,95(18):10954-9.
[11]Graham S H,Hickey R W.Cyclooxygenases in central nervous system diseases:a special role for cyclooxygenase 2 in neuronal cell death[J].Arch Neurol,2003,60(4):628 -30.
[12]杨 彬,余丽娟,王 佳,等.全脑缺血/再灌注大鼠皮层PGI2和TXA2时程变化特征[J].中国药理学通报,2013,29(12):1667- 71.
[12]Yang B,Yu L J,Wang J,et al.Time course changes of PGI2/TXA2in the rat cortex after global cerebral ischemia/reperfusion[J].Chin Pharmacol Bull,2013,29(12):1667 -71.
[13]Hei Z Q,Huang H Q,Luo C F,et al.Changes of nitric oxide and endothelin,thromboxane A2 and prostaglandin in cirrhotic patients undergoing liver transplantation [J].World J Gastroenterol,2006,12(25):4049-51.
[14]谭源福,李耀华.猫脑外伤后脑静脉6-keto-PGF(1α)和TXB2的变化及消炎痛对其的作用[J].广西医科大学学报,2003,20(1):46-8.
[14]Tan Y F,Li Y H.Influence of indomethacin on 6-keto-PGF1αand TXB2in cerebral veins of cats with head injury[J].J Guangxi Med Univ,2003,20(1):46 -8.
[15]Fang Y C,Wu J S,Chen J J,et al.Induction of prostacyclin/PGI2synthase expression after cerebral ischemia-reperfusion [J].J Cereb Blood Flow Met,2006,24(6):491 -501.

