β1-AR对心衰心室肌细胞快激活延迟整流钾电流的调控机制
汪和贵,王 森,陈艳红,邹建刚,柯永胜
(1.皖南医学院弋矶山医院心内科,安徽 芜湖 241001;2.南京医科大学第一临床医学院心脏科,江苏南京 210029)
慢性心衰患者易在运动和情绪激动等交感神经兴奋的情况下,诱发恶性室性心律失常甚至猝死。快激活延迟整流钾电流(IKr)是心肌细胞复极3期的主要钾电流,在心肌细胞动作电位复极过程中起关键作用[1]。最近的实验研究证明一些G蛋白偶联受体,如α-AR和 β-AR通过细胞内 cAMP、PKA和PKC调节hERG通道的功能[2-6]。这些研究表明肾上腺素的刺激影响hERG通道的活性。但是,目前β-AR对心衰心室肌细胞IKr/hERG通道的调控及其细胞内信号机制知之甚少,有待深入研究。因此,本研究分离豚鼠心室肌细胞,采用全细胞膜片钳技术,观察β1-AR瞬时激活对心衰心室肌细胞IKr的调控,并初步探讨其机制。
1 材料与方法
1.1 实验动物 实验动物:♂豚鼠,体质量200~250 g,由南京青龙山动物中心提供。所有实验动物的管理均遵循中华人民共和国卫生部动物实验管理条例。
1.2 主要试剂、溶液及仪器 扎莫特罗(Xamoterol,选择性 β1-AR激动剂)、CGP20712A(选择性β1-AR阻滞剂)、KN93(特异性CaMKⅡ抑制剂)购自美国Sigma公司;KT5720(特异性PKA抑制剂)购自Merck公司。
台氏液 (mmol· L-1):NaCl 137,KCl 5.4,NaH2PO40.33,HEPES 10,Glucose 10,CaCl21.8,pH 7.4 with NaOH;无钙液(mmol·L-1):NaCl 137,KCl 5.4,NaH2PO40.33,HEPES 10,Glucose 10,pH 7.4 with NaOH;KB液(mmol·L-1):KOH 85,L-Glu 70,Tuarine 20,KCl 20,KH2PO430,HEPES 10,Glucose 10,EGTA 0.5,pH 7.4 with KOH;电极内液(mmol·L-1):Potassium aspartate 120,KCl 20,MgCl22.0,HEPES10,EGTA 10,Na2ATP 10;pH 7.2 with KOH。细胞外液(mmol·L-1):Choline Chloride 137,KCl 5.4,MgCl21,CaCL21.8,PES 10,Glucose 10,CoCl22,pH 7.4 with KOH。记录IKr尾电流时细胞外液中加入 nifedipine(1μmol·L-1)及 chromanol293B(10 μmol·L-1)。
RM6240多道生理信号采集处理系统,中国成都仪器厂;心脏超声心动图,Sonos 5500,Hewlett Packard,美国;膜片钳放大器,EPC-9,HEKA,德国。
1.3 心衰模型制备与分组 豚鼠皮下注射阿托品(0.10 mg·kg-1),腹腔内注射戊巴比妥钠(30 mg·kg-1)麻醉,1%利多卡因局麻、消毒、气管插管、正压通气。在胸部左侧第3、4肋间隙纵行剪开皮肤,打开胸腔,分离出降主动脉,缩窄降主动脉,抽吸胸腔,荷包缝合,拔除气管插管,恢复自主呼吸。术后豚鼠侧卧,肌肉注射青霉素(4×105U·kg-1)预防感染,保暖,补充水、饲料和蔬菜。术后模型组及假手术对照组同室喂养12周,每天观察豚鼠呼吸、毛发色泽及活动情况。
心脏超声心动图检查由同一资深超声技术人员进行操作。应用Sonos 5500型超声心动图检查仪,心脏探头11-3L,频率为10MHz。用二维切面超声,选取豚鼠左室长轴、短轴和心尖四腔切面结合M型和多普勒超声进行检查,主要观察左室内径大小,测量左室舒张末内径(LVEDd)、左室收缩末内径(LVESd)、短轴缩短率(FS);心脏左室射血分数(EF值)由超声仪软件自动计算所得。所有数值均测量3个连续心动周期,然后取其平均值,以排除测量时的人为误差。
将分离出的对照组与心衰组豚鼠心室肌细胞,分为:空白对照组、PKA抑制剂组(细胞用2.5μmol·L-1特异性 PKA抑制剂 KT5720孵育1 h)及CaMKⅡ抑制剂组(细胞用10μmol·L-1特异性CaMKⅡ抑制剂KN93孵育30 min)。心肌细胞与玻璃微电极封接、破膜后,记录给药前的IKr尾电流,再给予10μmol·L-1扎莫特罗灌流,记录IKr尾电流。
1.4 IKr电流及动作电位记录方法 在电压钳模式下,从-40mV开始以阶跃电压20mV的方式逐步去极化至40mV,脉宽200 ms,刺激从相应电压降至-40mV,脉宽600 ms,诱发IKr外向尾电流。
在电流钳模式下,采用膜片钳技术记录豚鼠心室肌细胞膜动作电位(APD);给予脉宽5 ms,以1Hz频率电流刺激诱发动作电位。记录扎莫特罗对心衰心室肌细胞APD的作用时,在细胞外液中加入nifedipine(1μmol·L-1)及 chromanol(10μmol·L-1)。
1.5 统计学分析 膜片钳数据采用IGOR软件(IGOR Pro4.0+,HEKA,Germany)进行分析,实验结果均采用±s表示,用SPSS 16.0软件进行统计分析,配对资料采用配对t检验,多组比较采用方差分析。
2 结果
2.1 豚鼠慢性心衰模型的有效性 缩窄豚鼠降主动脉12周后,采用心脏超声心动图检测豚鼠左心室内径及心功能的变化(Tab 1,Fig 1),结果显示:心衰组豚鼠左室射血分数(EF)及左室短轴缩短率(FS)与对照组比较明显降低(P<0.01);心衰组豚鼠左室舒张末期内径(LVEDd)及左室收缩末期内径(LVSDd)与对照组比较明显增大(P<0.05,和 P<0.01)。采用心电图检测心衰豚鼠QTc的变化,结果显示:心衰组豚鼠QTc与对照组比较明显延长(Tab 1,P<0.01)。同时观察到心衰组豚鼠有不同程度的胸水与腹水。
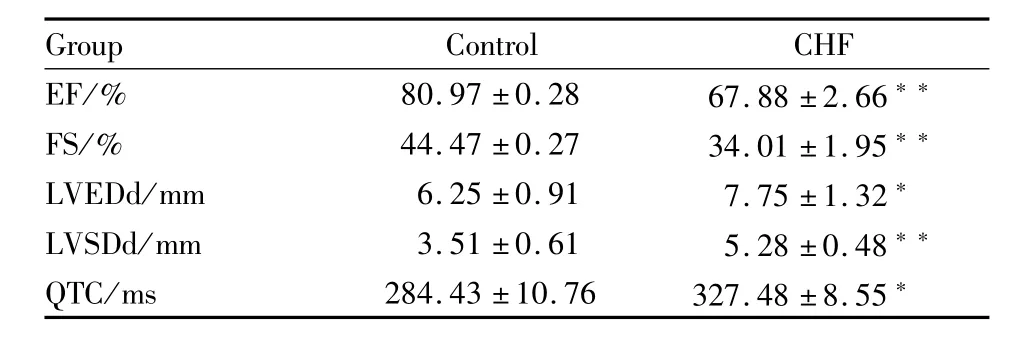
Tab 1 Changes of echocardiography and electrocardiogram in guinea pigs with CHF(n=10)

Fig 1 Changes of echocardiography in guinea pigs with CHF
2.2 β1-AR激动剂扎莫特罗对心衰心室肌细胞IKr的影响 IKr特异性阻断剂 dofetilide(1μmol·L-1)完全阻断IKr外向尾电流(Fig 2),证明该电流为IKr尾电流,不含有其它电流。
在灌流液中加入扎莫特罗(10μmol·L-1)2~3 min后,IKr外向尾电流开始减少,10 min左右IKr尾电流的抑制作用达到稳态。在预刺激电压为+40mV时,扎莫特罗作用10 min后,对照组心室肌细胞 IKr尾电流减少了(53±4)%(Fig 3A,n=6,P<0.01),心衰心室肌细胞IKr尾电流减少了(52±8)%(Fig 3B,n=6,P<0.01)。扎莫特罗对两组心肌细胞抑制程度差异无显著性。Fig 3C为扎莫特罗对两组心肌细胞IKr尾电流影响的时程关系。以上结果表明,β1-AR激活抑制心衰豚鼠心室肌细胞IKr尾电流。
2.3 扎莫特罗通过β1-AR抑制心衰心室肌细胞IKr为了进一步证实扎莫特罗是否通过β1-AR抑制心室肌细胞IKr,我们在正常豚鼠及心衰豚鼠心室肌细胞上,应用选择性β1-AR阻滞剂CGP20712A(10μmol·L-1)预处理后,扎莫特罗作用10 min后,IKr尾电流分别降低了(10±2)%和(8±1)%(P<0.01与扎莫特罗单独作用比较,Fig 4)。结果显示,CGP20712A完全抑制扎莫特罗对心室肌细胞IKr的减弱作用。
2.4 扎莫特罗通过PKA通路抑制IKr在细胞外液中加入特异性PKA抑制剂KT5720(2.5μmol·L-1)预处理1 h后,扎莫特罗(10μmol·L-1)作用10 min后仅使对照组与心衰心室肌细胞IKr尾电流分别减少了(30±2)%与(28±3)%(Fig 5A、B、C);扎莫特罗(10μmol·L-1)单独作用使对照组与心衰心室肌细胞IKr尾电流分别减少了(53±4)%、(52±8)%(n=5或6,P<0.05与扎莫特罗作用比较,Fig 5C)。结果提示,PKA通路部分介导了扎莫特罗对IKr的抑制作用。
2.5 扎莫特罗不通过钙调蛋白激酶Ⅱ途径调节IKr在细胞外液中加入特异性CaMKⅡ抑制剂KN93预处理30 min后,扎莫特罗仍对心室肌细胞IKr产生明显的抑制作用(Fig 6A、B),与扎莫特罗组比较差异无显著性(Fig 6C),结果提示,CaMKⅡ通路不参与扎莫特罗对IKr的抑制作用。
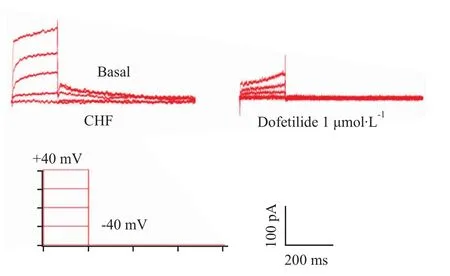
Fig 2 Effects of dofetilide on I Kr tail current in CHF ventricular myocytes
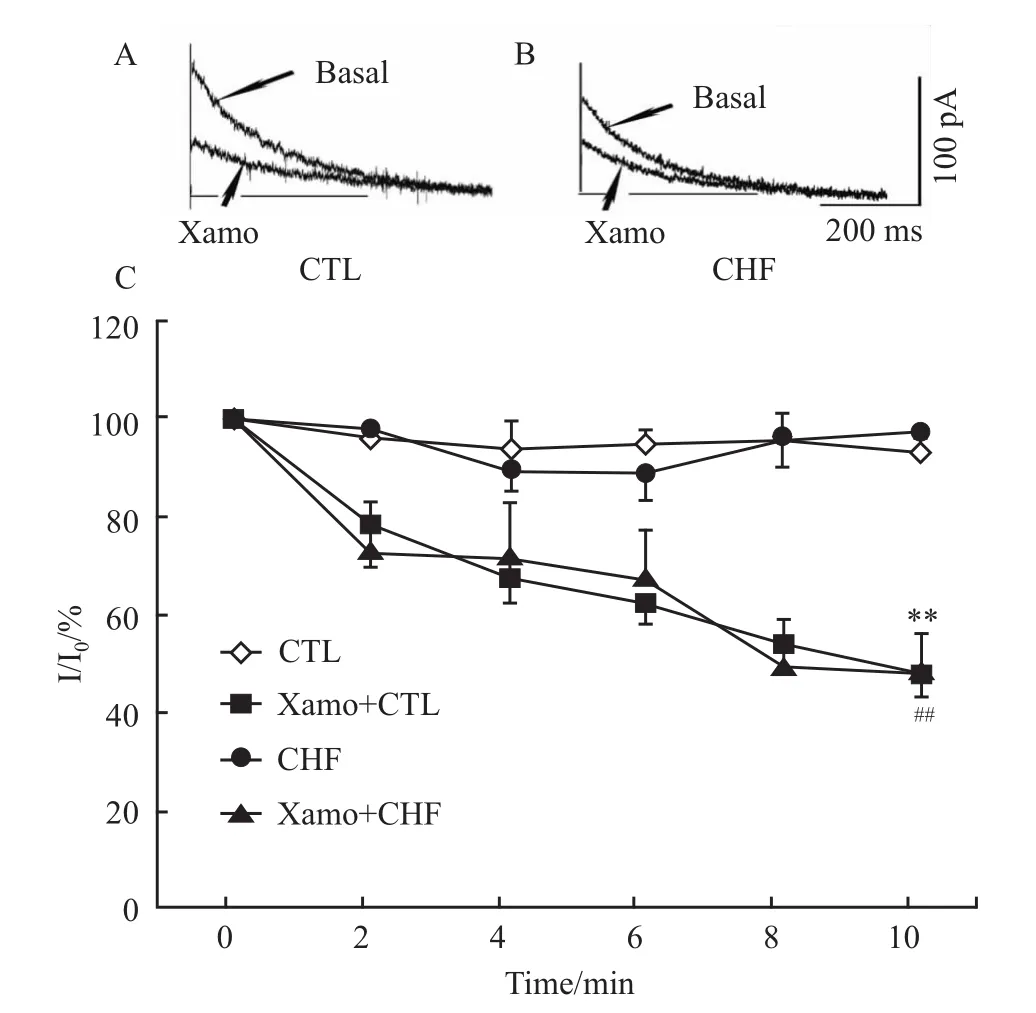
Fig 3 Effects of xamoterol on I Kr in CHF ventricular myocytesA and B:Effects of xamoterol on I Kr tail currents in control and CHF ventricular myocytes.C:Time-dependence of current reduction by xamoterol in control and CHF myocytes(n=6 cells,**P<0.01,Xamo+CTL vs CTL;##P<0.01,Xamo+CHF vs CHF).

Fig 4 Effects of CGP20712A(CGP)on the inhibition of I Kr by xamoterol in CHF ventricular myocytesA and B:Effects of xamoterol in the presence of CGP on the inhibition of I Kr in control and CHF ventricular myocytes.C:A summary of the data expressed as a percentage of decrease of I Kr by xamoterol in the presence of CGP.**P<0.01,Xamo+CGP vs Xamo.

Fig 5 Effects of KT5720 on the inhibition of I Kr by xamoterol in CHF ventricular myocytesA and B:Effects of xamoterol in the presence of KT5720 on the inhibition of I Kr in control and CHF ventricular myocytes.C:A summary of the data expressed as a percentage of decrease of I Kr by xamoterol in the presence of KT5720.*P<0.05,Xamo+KT5720 vs Xamo.

Fig 6 Effects of KN93 on the inhibition of I Kr by xamoterol in CHF ventricular myocytesA and B:Effects of xamoterol in the presence of KN93 on the inhibition of I Kr in control and CHF ventricular myocytes.C:A summary of the data expressed as a percentage of decrease of I Kr by xamoterol in the presence of KN93.
2.6 扎莫特罗对心衰心肌细胞动作电位时程的影响 为了记录扎莫特罗对心衰心室肌细胞ADP的影响,我们在细胞外液中加入nifedipine(1μmol·L-1)及 chromanol(10μmol·L-1),排除扎莫特罗对L型Ca2+通道及IKs通道的作用。结果显示,扎莫特罗(10μmol·L-1)明显延长心衰心室肌细胞ADP90[(16.9±1.06)%,n=4,P<0.05与心衰组比较,Fig 7]。
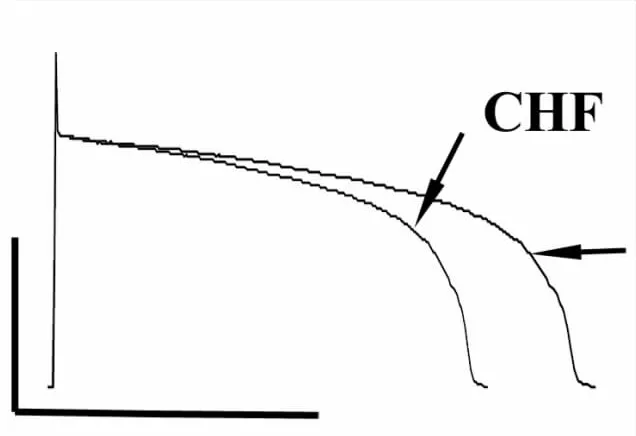
Fig 7 Effects of xamoterol(Xamo)on action potential duration in CHF ventricular myoctyes
3 讨论
本研究的主要发现:(1)β1-AR激活抑制心衰心室肌细胞IKr;(2)心衰时β1-AR激活通过PKA途径抑制心室肌细胞的IKr;(3)心衰时β1-AR激活不通过CaMKⅡ途径抑制心室肌细胞的IKr。
3.1 β1-AR激活抑制心衰心室肌细胞IKr交感神经兴奋,儿茶酚胺分泌增加,与细胞膜上G蛋白偶联的相应受体作用,产生广泛的生物学效应。最近的研究表明G-蛋白偶联受体如α-和β-AR通过细胞内cAMP,PKA和PKC调节 hERG钾通道的功能[2-5],提示自主神经刺激与心脏复极之间有一定的联系。
本实验结果表明,选择性β1-AR激动剂扎莫特罗(10μmol·L-1)[6]抑制心衰豚鼠心室肌细胞的IKr,延长APD;特异性β1-AR阻断剂 CGP20712A能够完全抑制扎莫特罗对IKr的减弱作用,表明扎莫特罗通过β1-AR抑制心衰心室肌细胞的IKr。既往研究[6]报道异丙肾上腺素(10μmol·L-1)抑制正常豚鼠心室肌细胞IKr,主要通过β1-AR起作用。在犬心室肌细胞,Harmati等[3]发现异丙肾上腺素(100 nmol·L-1)增加IKr,由 PKA通路介导。产生结果不一致的原因可能有:(1)实验技术、方法以及物种不同。Karle等[6]与我们的实验均采用全细胞膜片钳技术及相同的动物,实验结果是一致的。(2)药物浓度的差异,我们实验中使用的药物浓度是Harmati等使用的100倍。(3)β1-AR激活通过与Gs蛋白偶联,刺激腺苷酸环化酶(AC),导致细胞内cAMP水平增加,cAMP可通过直接与hERG通道中的cBND位点结合增加IKr;另一方面cAMP还能激活 PKA,抑制 IKr,产生双向调控 IKr的作用[7]。
3.2 β1-AR激活抑制心衰心室肌细胞IKr的机制
β1-AR主要信号导途径为 Gs-AC-cAMP-PKA,PKA催化底物蛋白磷酸化[8]。特异性PKA抑制剂KT5720可明显减弱扎莫特罗对心衰心室肌细胞IKr的抑制作用,提示β1-AR激活部分通过PKA通路抑制心衰心室肌细胞IKr。心衰时β1-AR细胞内信号途径可能发生转换,如β1-AR/Ca2+/钙调蛋白激酶Ⅱ(Ca2+/CaMKⅡ)信号途径可能起作用。关于CaMKⅡ对钾电流的调控多集中于IKs电流的研究,对IKr电流研究很少。特异性CaMKⅡ抑制剂KN93对扎莫特罗抑制心室肌细胞IKr的作用无明显影响,提示CaMKⅡ通路不参与β1-AR对心衰心室肌细胞IKr的抑制作用。
本实验发现,扎莫特罗对正常和心衰豚鼠心室肌细胞IKr的抑制作用无差异,其原因可能有:(1)心衰时β1-AR下调[4],扎莫特罗激活 β1-AR抑制 IKr电流作用减弱;(2)心衰时 PKA活性增加[9],β1-AR激活通过Gs-cAMP-PKA通路抑制IKr电流增强;(3)心衰时细胞内信号机制十分复杂,如Gs-cAMP表达发生变化;其他信号通路,如 A激酶锚定蛋白(AKAPs)[10]通路及 PKC通路等是否参与 β1-AR对IKr电流的调控有待进一步研究。
3.3 β1-AR调控心衰心室肌细胞IKr/hERG通道的临床意义 IKr通道对维持心脏正常的电生理活动起着重要的作用,在病理状态下,如心力衰竭,导致hERG/IKr通道功能障碍,心肌细胞复极延迟,动作电位弥散,参与心律失常的发生[11]。心衰患者在运动或情绪激动时,交感神经系统被激活,从而导致局部和循环中儿茶酚胺浓度增高。慢性心衰患者血浆去甲肾上腺素水平达3μmol·L-1,运动时达15μmol·L-1[12]。在心力衰竭及先天性 LQTS患者,运动和情绪的应激激活交感神经系统,兴奋心脏α-和β-AR,主要激活β-AR,导致 IKr/hERG电流减少,使复极时间延长,诱发致命性室性心律失常。β1-AR阻滞剂美托洛尔广泛应用于临床治疗心衰,能减少死亡率和心源性猝死。
本研究发现心衰时β1-AR激活主要通过PKA途径,抑制心室肌细胞IKr,提示β-AR阻滞剂的抗心律失常作用要部分归功于它抑制β-肾上腺素对hERG通道的调控。肾上腺素的hERG通道调控是致心律失常的潜在机制,为抗心律失常治疗开辟了一个新的途径。
参考文献:
[1] Vandenberg J I,Perry M D,Perrin M J,et al.hERG K(+)channels:structure,function,and clinical significance[J].Physiol Rev,2012,92(3):1393-478.
[2] Wang S,Xu D J,Cai JB,et al.Rapid component I(Kr)of cardiac delayed rectifier potassium currents in guinea-pig is inhibited by alpha(1)-adrenoreceptor activation via protein kinase A and protein kinase C-dependent pathways[J].Eur J Pharmacol,2009,608(1-3):1-6.
[3] Harmati G,Banyasz T,Barandi L,et al.Effects of beta-adrenoceptor stimulation on delayed rectifier K(+)currents in canine ventricular cardiomyocytes[J].Br J Pharmacol,2011,162(4):890-6.
[4] Wang H,Chen Y,Zhu H,et al.Increased response to beta(2)-adrenoreceptor stimulation augments inhibition of IKrin heart failure ventricular myocytes[J].PLoSOne,2012,7(9):e46186.
[5] Thomas D,Kiehn J,Katus H A,Karle C A.Adrenergic regulation of the rapid component of the cardiac delayed rectifier potassium current,I(Kr),and the underlying hERG ion channel[J].Basic Res Cardiol,2004,99(4):279-87.
[6] Karle C A,Zitron E,Zhang W,et al.Rapid component I(Kr)of the guinea-pig cardiac delayed rectifier K(+)current is inhibited by beta(1)-adrenoreceptor activation,via cAMP/protein kinase A-dependent pathways[J].Cardiovasc Res,2002,53(2):355-62.
[7] Cui J,Melman Y,Palma E,et al.Cyclic AMP regulates the HERGK(+)channel by dual pathways[J].Curr Biol,2000,10(11):671-4.
[8] Xiang Y,Kobilka B K.Myocyte adrenoceptor signaling pathways[J].Science,2003,300(5625):1530-2.
[9] Wang J,Liu X,Arneja A S,Dhalla N S.Alterations in protein kinase A and protein kinase Clevels in heart failure due to genetic cardiomyopathy[J].Can J Cardiol,1999,15(6):683-90.
[10]Perino A,Ghigo A,Scott J D,Hirsch E.Anchoring proteins as regulators of signaling pathways[J].Circ Res,2012,111(4):482-92.
[11]周宇宏,杨宝峰,李宝馨.病理状态HERG/IKr通道角色及中药干预的研究[J].中国药理学通报,2007,23(10):1264-7.
[11]Zhou Y H,Yang B F,Li B X.Modulation ofHERG/IKrin pathological condition and effect of traditional chinesemed icine on HERG/IKr[J].Chin Pharmacol Bull,2007,23(10):1264-7.
[12]Vittorio T J,Zolty R,Kasper M E,et al.Differential effects of carvedilol and metoprolol succinate on plasma norepinephrine release and peak exercise heart rate in subjects with chronic heart failure[J].J Cardiovasc Pharmacol Ther,2008,13(1):51-7.

