催产素受体配体及其中枢和外周功能研究进展
孟雅婧,杨 洋,刘 莹,安 输,徐天瑞
(昆明理工大学生命科学与技术学院细胞信号传导实验室,云南昆明 650500)
催产素(oxytocin,OT)是一个由9个氨基酸残基构成的环状多肽,通过其第1位和第6位半胱氨酸的二硫键连接形成了1个含有三肽尾巴的环状分子(Fig 1)。催产素通过与其受体结合而发挥生理作用[1]。催产素受体(oxytocin receptor,OTR)属于A型G蛋白偶联受体(Gprotein coupled receptor,GPCR)家族,含有7个跨膜的α螺旋,由389个氨基酸残基组成。
催产素受体能与 Gq、Gi1、Gi2、Gi3、GoA和 GoB等亚基偶联,引起细胞质钙离子浓度的增加[2](与Gq亚基偶联)或抑制腺苷酸环化酶活性的提高(与Gi亚基偶联)。催产素受体编码基因位于人染色体3p25,全长约19 kb,含有3个内含子和4个外显子。因为催产素与另外一个神经肽(血管加压素,vasopressin,AVP,也称精氨酸加压素)具有很高的序列同源性(Fig 1),所以研究催产素系统新型激动剂和拮抗剂时,通常将血管加压素受体(vasopressin receptor,即V1a受体和V2受体)作为对照,考查新型配体与催产素受体的亲和力是否明显强于其与血管加压素受体的亲和力[3]。介导催产素受体和血管加压素受体与相应配体结合的主要区域位于受体的第3跨膜区,而催产素受体第5、6跨膜区是其与催产素特异识别的主要部位,同时,血管加压素受体第4、7跨膜区参与了其与血管加压素的特异识别[1]。

Fig 1 Amino acid sequence of oxytocin,vasopressin and carbetocin
1 催产素与催产素受体的研究简史
1906年,英国生理学家Henry H Dale发现牛脑垂体后叶提取物能促进动物子宫收缩。1909年,英国妇产科医生William Blair Bell将Dale的发现应用于临床。Bell认为这些提取物不仅能促进子宫收缩,也能防治产后出血,并有促进泌乳的作用。20世纪30年代后期的研究发现,室旁核(nuclei paraventricularis,PVN)和 视 上 核 (supraoptic nucleus,SON)的神经元分泌的神经肽(即催产素)具有缩宫和泌乳作用,并沿轴突投射到不同脑区。20世纪50年代早期,美国生化学家Vincent du Vigneaud因鉴定出催产素的氨基酸组成,并人工合成了这种多肽而获得1955年诺贝尔化学奖。多年来,催产素被广泛应用于临床产科,用于促进分娩和防止产后大出血[4]。
近年来,催产素在其它生理过程中的作用也受到广泛关注,包括调节体液平衡、血液渗透压、心脏功能、骨密度、食欲及脂肪代谢、社会行为(例如交配、抚育后代)和认知(学习和记忆)等。另外,催产素水平与啮齿类动物酒精、可卡因、鸦片等物质的成瘾性呈正相关,同时,它在人的心理和精神(例如自闭症、焦虑症、精神紊乱等)方面的调节作用也展现出广泛的临床应用前景[4]。
2 催产素系统在体内的分布及其生理功能
2.1 外周组织的催产素和催产素受体 外周组织的催产素和催产素受体主要分布于生殖器官,如女性的子宫、卵巢、黄体、胎盘和乳腺,男性的前列腺、阴茎、睾丸间质细胞、莱迪希氏间质细胞等。除了生殖器官,催产素系统也分布于外周的其它组织和器官,如人成骨细胞、血管内皮细胞、气管平滑肌细胞、视网膜、肾上腺髓质、胸腺、胰腺、心脏和脂肪细胞等。
分娩过程中的子宫收缩刺激下丘脑释放催产素,随后催产素通过垂体释放到外周血液中,与分布于子宫肌层细胞的催产素受体结合,激活钙通道并促进肌浆网中钙离子的释放,促使子宫收缩[5]。同时催产素也可刺激乳腺上皮细胞,使其发生泌乳反应。人工合成的催产素常用于临床催产、促进泌乳和防止产后大出血。
妊娠期间的催产素水平与母体心血管系统密切相关。外周注射催产素会降低大鼠的平均动脉压[6],而中枢注射催产素能减少灌注大鼠的心脏收缩率,同时催产素受体拮抗剂能逆转由催产素引起的心动过缓[7]。妊娠期间的催产素水平与骨细胞的生理活动也密切相关。由于催产素可迅速提高破骨细胞内的钙离子浓度,促进破骨细胞前体细胞的增殖[8],因此妊娠期间催产素的增加也维持了母体的骨密度。也有研究发现催产素与催产素受体高表达于骨肉瘤细胞[9],这为催产素系统应用于骨癌的治疗提供了理论依据。
催产素系统在胸腺和气管平滑肌的分布对人的免疫功能和肺功能也有不可或缺的作用。催产素作为神经垂体的自身抗原大量存在于胸腺上皮细胞中,参与T细胞的分化[2]。在人气管平滑肌细胞中,催产素及其受体都可以与炎症因子相互作用而参与肺部功能的调节。当哮喘症状发作时,炎症因子IL-13和TNF-α的释放能引起催产素受体mRNA水平的升高[20]。因此,催产素系统在免疫疾病和肺部疾病的治疗中也可能有重要作用。
2.2 中枢神经系统中的催产素和催产素受体 催产素和催产素受体在中枢神经系统(central nerve system,CNS)也有广泛分布。CNS中的催产素主要是由下丘脑神经元的室旁核和视上核的巨细胞合成,并投射到不同的脑区(包括神经垂体的血管周围、正中隆起、室周器官、穹窿下器官和松果体等),作用于中枢催产素受体网络,也可通过垂体后叶(即神经垂体系统)释放到外周循环。
CNS的催产素水平与个体精神状况和社会行为密切相关。目前认为,催产素是一种内源性的抗精神病物质。精神分裂症患者脑脊液中催产素水平通常较低,过低的催产素会改变下丘脑-垂体-肾上腺(HPA)轴对压力的调控[10],进而导致精神分裂症患者在认知和社会行为方面的功能损伤。中枢给予催产素后,精神分裂症患者的社会认知能力(心理基础、社会记忆)明显提高[11]。经鼻吸入催产素 (24 IU)能引起皮质醇的增加,从而减少社会压力(如在公众演讲中的压力)[12]。催产素受体缺陷可能与自闭症有关,当自闭症患者经鼻吸入催产素后,在模拟球类游戏中更善于和队友合作,社交行为也更趋于合理化[13]。经鼻吸入催产素还可以提高社会个体之间的信任,包括配偶和个体之间的交流和联系等[2]。
催产素在CNS中的分布还包括视叶前区、腹侧背盖区、嗅球等,这些区域都参与调控动物筑巢和照顾幼代等母性行为。催产素受体敲除的♀鼠在性行为、生育能力上与正常鼠没有区别,但其后代会因缺乏照顾而死亡[14]。人类婴儿出生前,母亲脑脊液中催产素水平增高,提升了母亲对胎儿各种行为的敏感性,使之积极应对[15]。
中枢催产素还参与了成瘾性的调节。催产素给药会削弱对吗啡的耐受性、阻断纳洛酮诱导的吗啡戒断、抑制内源性阿片类药物的耐受性等[16]。同时,中枢和外周给药都可以阻断酒精诱导的体温下降、肌肉松弛和运动无力,并降低酒精的戒断程度。一项鼻吸入催产素的临床实验表明,酒精成瘾的病人主要通过催产素阻断了它的阶段治疗。因此,普遍认为中枢催产素水平的提高会导致成瘾性加强,并抑制戒断的进行[4]。
2.3 外周与中枢系统中催产素系统的联系 催产素和催产素受体在中枢和外周系统的联系可以用分娩过程来解释。孕期催产素受体在大脑和子宫中都有高水平的表达。分娩过程中,子宫颈的收缩会激活下丘脑的催产素受体,从而刺激中枢合成催产素,高水平的催产素通过垂体释放到外周,作用于子宫,促进宫缩,宫缩进一步刺激中枢合成催产素,形成正反馈,在分娩过程中发挥关键作用[4]。
中枢和外周的催产素具有相对独立的调控方式,由于血脑屏障的作用,血液中的催产素不能直接影响中枢。给药途径的不同使药物所起作用也有很大的不同,外周给药能减少和实验相关的焦虑状态,而中枢系统给药则不能[17]。所以催产素系统在中枢和外周所起的作用既相互独立又有联系。
3 催产素受体激动剂和拮抗剂的研究和应用
尽管催产素及其类似物广泛应用于临床产科,但其给药途径仍有很大的局限性。口服给药会发生首过效应,外周静脉给药由于血脑屏障的限制,只能微量进入大脑。目前认为,通过鼻腔给药时,大分子药物可以绕过血脑屏障,通过嗅觉上皮细胞内路口进入CNS,但其有效性仍具争议[4]。
中枢给药一般是通过视觉定位直接注射到大脑区域,但剂量和药效的关系仍然不很明确。脑中高剂量注射催产素可经毛细血管内皮细胞间隙大量渗到外周器官,而在外周进行高剂量的静脉注射也经毛细血管内皮细胞间隙少量渗入到大脑。大剂量催产素给药不仅能引起一系列的心血管副作用,如引起低血压、心动过速、心肌梗死等,也会给中枢神经系统带来非正常的刺激[18],所以催产素给药的剂量还有待进一步探讨。
其它催产素系统激动剂和拮抗剂,及其单抗、多抗、RNA片段等具有相当的开发价值,但距离应用仍有很长的路要走。另外,催产素受体也可特异性结合细胞毒物质,如紫杉醇和部分放射性化合物[3]。这为将催产素受体激动剂和拮抗剂用于表达催产素受体的肿瘤细胞的化疗或细胞成像提供了理论基础。由于催产素具有多种生理功能,因此,以其受体为靶标,开发性能更优越的新型催产素受体激动剂和拮抗剂具有相当的应用前景。
3.1 催产素受体激动剂和拮抗剂的鉴定 目前评估催产素受体激动剂和拮抗剂的方法包括体外实验和体内实验。体外评估方法主要是经典的配体与催产素受体亲和力检测,基于GPCR基本功能的钙流测定以及利用荧光素酶报告系统测量催产素受体下游靶基因表达。体外实验中常用的细胞有CHO细胞系(Chinese hamster ovary cell,中国仓鼠卵巢细胞)和 HEK293细胞系(human embryonic kidney cell,人胚肾细胞)。
配体与催产素受体的亲和力检测主要用催产素受体(并以V1a受体、V2受体为对照)转染细胞,这些细胞的膜提取物即含有大量的催产素受体(或V1a受体 、V2受体)。将这些膜提取物与用放射性(如[3H]和[125I])标记的配体分子(一般是催产素)共孵育,使受体和已标记的配体充分结合[19]。加入待测分子后,其与标记的配体竞争结合受体(催产素受体或V1a受体 、V2受体对照),最后检测放射性标记的配体量,对比未加入竞争性结合小分子的样品中放射性标记的配体量,即得到待测分子与催产素受体的相对亲和力,通常用IC50值(平衡抑制浓度,即待测化合物竞争结合一半标记配体时的浓度)和Ki值(抑制常数,即标记配体与竞争性结合待测分子的结合达到平衡时所需的浓度)来量化表示[3]。
作为GPCR家族的典型成员,催产素受体信号通路的激活可明显提高细胞内Ca2+浓度并促进肌醇三磷酸(inositol tri-phosphate,IP3)的合成。因此通常用待测小分子处理细胞后,测定胞内Ca2+浓度和IP3合成的变化来评价待测分子是否具有催产素受体配体的功能。催产素受体的激活将引发下游基因表达的变化,因此也可利用催产素受体激活的转录报告基因如NFAT(nuclear factor of activated T cells)的表达来评价待测分子的激动剂或拮抗剂效果。另外,也有通过检测来源于人、大鼠、狗的微粒体的固有清除率反映待测化合物的代谢率。
Huang等[20]利用健康人和哮喘患者的气管平滑肌细胞进行体外实验,证实了多肽、单抗、RNA片段等分子可以作为催产素系统拮抗剂而对相关免疫疾病和肺部疾病进行预防和治疗,如哮喘、肺气肿和慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)。
体内评估催产素受体激动剂和拮抗剂的方法主要指经典的动物模型,如小鼠子宫收缩模型、大鼠催产实验、小鼠痛经模型[21]、小鼠 FPT模型(four-plate test,即四平皿测试)、PPI模型(prepulse inhibition of the acoustic startle reflex,即声惊吓反射的前脉冲抑制)、大鼠勃起实验等。这些实验中待测分子可以通过静脉注射、视觉定位脑室注射、经十二指肠插管等方式给药。在小鼠子宫收缩模型中,Schwarz等通过监测子宫收缩的压力和次数,定量待测小分子催产素受体拮抗剂对子宫收缩的影响。而小鼠FPT模型和PPI模型常用于临床前研究,如Rahman等[22]分别用FPT和PPI小鼠模型来评估检测待测化合物对动物的抗焦虑水平和与精神分裂类似症状的影响。
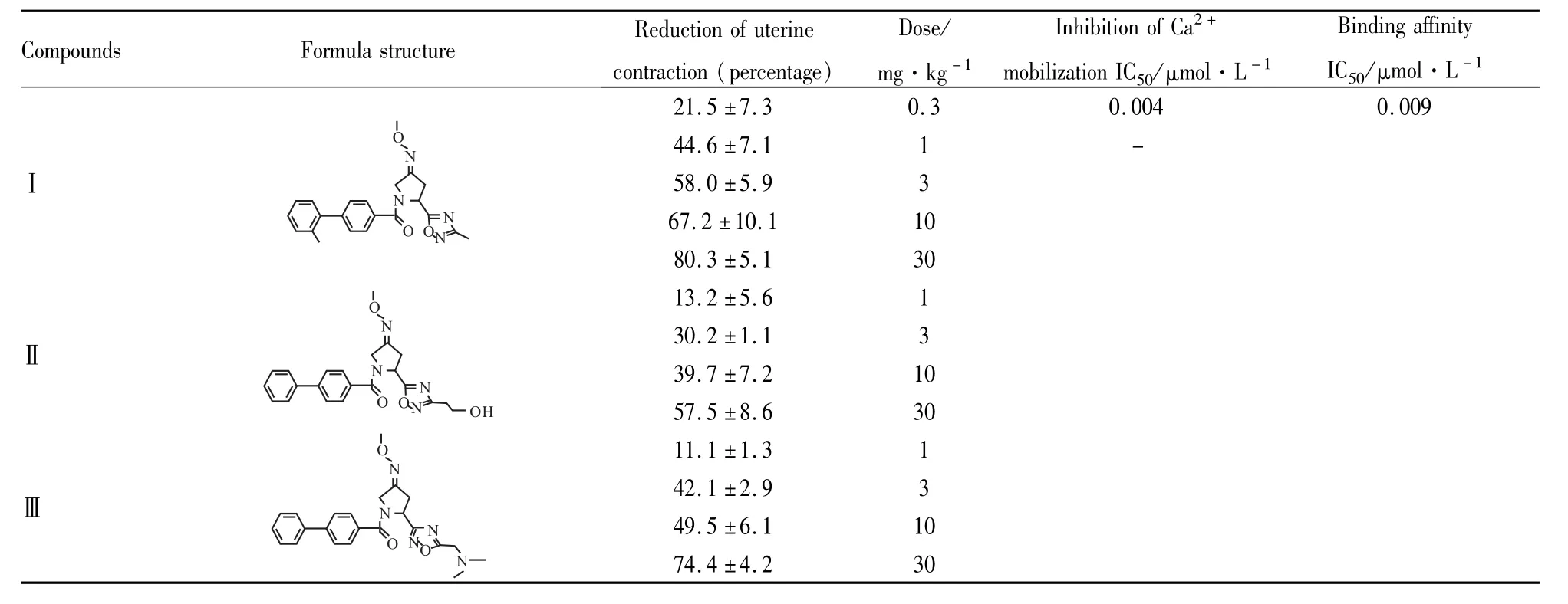
Tab 1 Structures and properties of oxytocin receptor antagonists developed by ARS(applied research systems)Holding N.V.
3.2 肽类催产素受体配体 利用氨基酸替换法改造催产素已经成为寻找新型催产素受体配体的捷径。早在1977年,研究人员就发现用其它氨基酸替换催产素肽分子的第4、7位残基可增强配体和催产素受体的识别能力[23]。20世纪90年代的研究又发现,在催产素/血管加压素多肽的3、4、7、8位进行氨基酸替换或修饰获得的催产素类似物可以改变其与催产素受体的亲和力。
目前,临床常用的人工合成催产素类似物有卡贝缩宫素(carbetocin,静脉给药)和马来酸盐马来酸麦角新碱(ergometrine maleate)。其中,卡贝缩宫素是Ferring(辉凌制药)在1992年通过氨基酸替代法研制出的第一个分娩诱导剂Carba-1-[4-FBzlGly7]doxytocin(Fig 1),是目前临床中预防产后大出血最主要的药物之一。催产素类似物在临床上的应用除产科外,还有报道于心血管疾病的治疗,它可以通过减少脂肪形成、调节脂肪代谢、刺激心肌干细胞形成新的心肌细胞。Oxytocin-Gly-Lys-Arg(CAS号:90685-16-8;Chemical Abstracts Service,CAS)[24]目前已进入临床前试验,可能成为治疗肥胖症和心血管疾病的新药。
3.3 非肽类催产素受体配体 非肽类小分子催产素受体配体以其分子性质稳定、合成简便等优势,成为研究人员关注的重要领域。多家制药公司的研发部门和其它研究机构都在小分子催产素受体激动剂和拮抗剂的合成、药理作用方面获得有价值的数据。
2002年,ARSHolding N.V.报道了一系列有催产素受体拮抗剂活性的吡咯烷化合物(如Tab 1和2)[25-26]。这些化合物的保守结构主要由联苯、二唑和噻二唑组成,联苯基团是决定其化学性质的主要因素。Tab 1中Ⅰ、Ⅱ、Ⅲ是Schwarz等通过低剂量给药有效减少未孕大鼠宫缩而研制出的催产素受体拮抗剂。Tab 2中的催产素受体拮抗剂也能剂量依赖性地逆转催产素诱导的宫缩。体外实验(Tab 1和2)证明,这些催产素受体拮抗剂具有良好的亲和力(IC50几乎都小于0.40μmol·L-1)。
2007年,惠氏公司发明的非肽类催产素受体激动剂Cpd A、Cpd B及其盐酸盐 [WO02083680][21]能逆转 MK-801(dizocilpine,卓西平)和 d-Amphetamin(D-安非他命类)引起的PPI缺陷。这表明催产素受体激动剂能够作为临床抗精神病药。
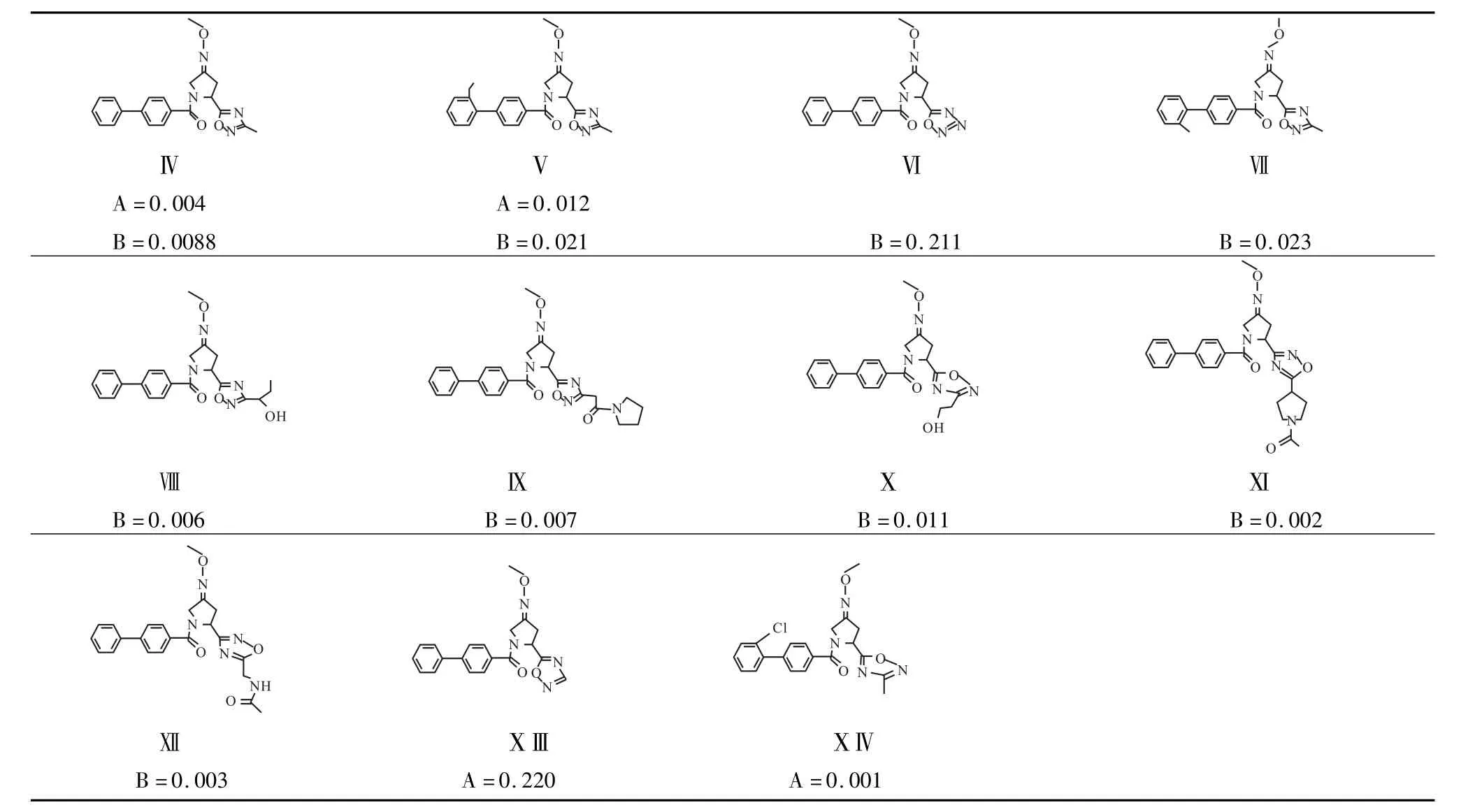
Tab 2 Biological and chemical activities of the oxytocin receptor antagonists developed by ARS(applied research systems)Holding N.V.
4 总结与展望
催产素和催产素受体广泛参与了体内的生理过程,如通过调节钙离子促进宫缩,通过线粒体-ATP-依赖钾通道保护心脏,通过抗利尿效应调节水平衡,通过刺激破骨细胞的形成来维持骨密度,通过亲社会作用促进社会行为等。值得一提的是,催产素和催产素受体在CNS、心理和精神中的功能受到了广泛关注,它不仅与精神分裂症、自闭症、药物成瘾、母子亲近、社会焦虑紊乱有关,也在调控痛觉、学习和记忆方面发挥重要的作用。催产素及其类似物作为围产期药物已广泛应用到临床中(如卡贝缩宫素),而具有改善和治疗中枢系统疾病的药物还处于临床前期的试用阶段。这为催产素受体激动剂和拮抗剂在临床上治疗神经紊乱等疾病带来了希望。
当然,催产素与催产素受体在中枢和外周的广泛分布及其功能的多样性本身也是一把双刃剑,这为研制特异性的针对某种催产素相关症状的药物带来了极大的挑战。如何平衡催产素受体功能的多样性和特异性将是我们面临的新课题。
参考文献:
[1] Barberis C,Mouillac B,Durroux T.Structural bases of vasopressin/oxytocin receptor function[J].J Endocrinol,1998,156(2):223-9.
[2] Gimpl G,Fahrenholz F.The oxytocin receptor system:structure,function,and regulation[J].Physiol Rev,2001,81(2):629-83.
[3] Yang Y,Li H,Ward R,et al.Novel oxytocin receptor agonists and antagonists:a patent review(2002-2013)[J].Expert Opin Ther Pat,2014,24(1):29-46.
[4] Carson D S,Guastella A J,Taylor E R,et al.A brief history of oxytocin and its role in modulating psychostimulant effects[J].J Psychopharmacol,2013,27(3):231-47.
[5] Kimura T,Takemura M,Nomura S,et al.Expression of oxytocin receptor in human pregnant myometrium[J].Endocrinology,1996,137(2):780-5.
[6] Petty M A,Lang R E,Unger T,Ganten D.The cardiovascular effects of oxytocin in conscious male rats[J].Eur J Pharmacol,1985,112(2):203-10.
[7] Favaretto A L,Ballejo G O,Albuquerque-Araujo W I,et al.Oxytocin releases atrial natriuretic peptide from rat atria in vitro that exerts negative inotropic and chronotropic action[J].Peptides,1997,18(9):1377-81.
[8] Tamma R,Colaianni G,Zhu L L,et al.Oxytocin is an anabolic bone hormone[J].Proc Natl Acad Sci USA,2009,106(17):7149-54.
[9] Copland J A,Ives K L,Simmons D J,et al.Functional oxytocin receptors discovered in human osteoblasts[J].Endocrinology,1999,140(9):4371-4.
[10]Goldman M,Marlow-O′Connor M,Torres I,Carter C S.Diminished plasma oxytocin in schizophrenic patients with neuroendocrine dysfunction and emotional deficits[J].Schizophr Res,2008,98(1-3):247-55.
[11]Pedersen CA,Gibson C M,Rau SW,et al.Intranasal oxytocin reduces psychotic symptoms and improves Theory of Mind and social perception in schizophrenia[J].Schizophr Res,2011,132(1):50-3.
[12]Quirin M,Kuhl J,Dusing R.Oxytocin buffers cortisol responses to stress in individuals with impaired emotion regulation abilities[J].Psychoneuroendocrinology,2011,36(6):898-904.
[13]Andari E,Duhamel JR,Zalla T,et al.Promoting social behavior with oxytocin in high-functioning autism spectrum disorders[J].Proc Natl Acad Sci USA,2010,107(9):4389-94.
[14]Macbeth A H,Stepp JE,Lee H J,et al.Normal maternal behavior,but increased pup mortality,in conditional oxytocin receptor knockout females[J].Behav Neurosci,2010,124(5):677-85.
[15]Mezzacappa E S,Katlin E S.Breast-feeding is associated with reduced perceived stress and negative mood in mothers[J].Health Psychol,2002,21(2):187-93.
[16]Kovacs G L,Sarnyai Z,Szabo G.Oxytocin and addiction:a review[J].Psychoneuroendocrinology,1998,23(8):945-62.
[17]Ayers L W,Missig G,Schulkin J,et al.Oxytocin reduces background anxiety in a fear-potentiated startle paradigm:peripheral vs central administration[J].Neuropsychopharmacology,2011,36(12):2488-97.
[18]Dyer R A,Butwick A J,Carvalho B.Oxytocin for labour and caesarean delivery:implications for the anaesthesiologist[J].Curr Opin Anaesthesiol,2011,24(3):255-61.
[19]Schwarz M,Quattropani A,Page P,et al.Pyrrolidine oxadiazoleand thiadlazle oxime derivatives being oxytocin receptor antagonist.Pat US2006229343A1:Applied Research Systems ARS Holding N.V,2006-10-12.
[20]Huang C,Syed F,Li L,et al.Oxytocin receptor agonists and their use for the treatment of pulmonary related diseases[P].Pat US,2010/0260675 A1,2010-10-14.
[21]孙海燕,曹永孝,刘 静,等.小鼠痛经模型的建立[J].中国药理学通报,2002,18(2):233-6.
[21]Sun H Y,Cao Y X,Liu J,et al.The establishment of the dysmenorrhea model in mice[J].Chin Pharmacol Bull,2002,18(2):233-6.
[22]Rahman Z,Resnick L,Rosenzweig-Lipson S,Ring R.Methods of treatment using oxytocin receptor agonists[P].Pat,US20070117794A1,2007-5-24.
[23]Lowbridge J,Manning M,Haldar J,Sawyer W.[1-(L-2-hydroxy-3-mercaptopropanoic acid)] analogues of arginine-vasopressin,[8-D-arginine]vasopressin,and[4-valine,8-D-arginine]vasopressin[J].J Med Chem,1977,20(9):1173-6.
[24]Danalache B A,Gutkowska J,Slusarz M J,et al.Oxytocin-Gly-Lys-Arg:a novel cardiomyogenic peptide[J].PLoSOne,2010,5(10):e13643.
[25]Schwarz M Q,Quattropani A,Page P,et al.Pyrrolidine oxadiazole-and thiadlazole derivatixes[P].Pat.US20040220238A1:Applied Research Systems ARSHolding,2004-11-4.
[26]Schwarz M,Page P,Pomel V,et al.Pyrrolidine oxadiazole-and thiadlazole oxime derivatixes being oxytocin receptor antagonists[P].Pat WO2002102799A2:Applied Research Systems ARS Holding,2002-10-27.

