碘化N-正丁基氟哌啶醇抑制大鼠过氧化氢作用心肌细胞L型钙通道电流的增大
黄勇攀,高分飞,石刚刚
(1.贵阳医学院药理学教研室,贵州贵阳 550004;2.汕头大学医学院药理学教研室,广东汕头 515041)
钙超载是缺血/再灌注损伤(I/R)重要机制之一。心肌I/R引起钙通道开放,大量的钙离子通过钙通道进入心肌细胞,导致细胞内钙超载。碘化N-正丁基氟哌啶醇(F2)是我们课题组合成的具有拮抗心肌I/R损伤作用,结构全新的氟哌啶醇季铵盐衍生物,研究发现F2能阻断正常心肌细胞钙通道及抑制缺氧条件下钠钙交换体电流防止钙超载,减轻大鼠和家兔心肌 I/R损伤[1-3]。但是 F2对过氧化氢作用ICa,L的作用还不清楚。本研究通过建立过氧化氢作用模型来模拟心脏I/R氧自由基损伤ICa,L变化并探讨F2对I/R ICa,L作用及其作用机制。
1 材料与方法
1.1 动物 成年♂ SD大鼠,体质量180~250 g,汕头大学医学院动物实验中心提供,动物合格证号:2004A062。
1.2 药物和仪器 F2,由本研究室合成(分子质量559.61,纯度98.6%),结构由中国科学院上海有机化学所鉴定,保存在 DMSO,浓度为0.1 mol·L-1;nifedipine、CsCl、HEPES和 BAPTA均购自 Sigma Chemical Co,St.Louis,MO;膜片钳系统购自美国Axon公司;倒置显微镜购自日本OLYMPUS公司。
1.3 单个大鼠心室肌细胞的分离制备 SD大鼠断头,颈动脉放血,迅速取下心脏,在4℃无钙液(mmol·L-1:NaCl 135,KCl 5.4,MgCl21.0,NaH2PO40.33,glucose 10,HEPES1.0,pH 7.4)中去除脂肪及心包膜,经主动脉进行Langendorff灌流。用无钙液经主动脉逆行灌流约6 min,再用酶溶液0.4 g·L-1collagenase和0.06 g·L-1protease灌流 25 min直至心脏变得柔软,松弛。整个灌流过程中保持37℃恒温,持续通95%O2和5%CO2混合气。剪下心肌,在 KB液(85 KOH,50 L-glutamic acid,30 KCl, 30 KH2PO4, 20 taurine, 1.0 MgCl2, 10 HEPES,1 EGTA,10 glucose)中轻柔吹打,直至大量细胞分离下来,得到细胞混悬液,贮存于4℃KB液中[4]。
1.4 钙电流记录 采用全细胞膜片钳技术记录心肌细胞钙电流,室温下进行。所用微电极用两步拉制仪拉制而成,微电极充电极内液(mmol·L-1:150 CsCl,15 EGTA,1 MgCl2,5 MgATP,5 HEPES,CsOH调至pH7.2)后电阻在2~3 MΩ之间。心室肌细胞悬液置于浴槽中,静置2 min贴壁,台式液灌流5 min,流速2 ml·min-1。选取胞膜完整、横纹清晰、杆状,边界清楚,无收缩的心室肌细胞进行实验。调节微操纵器,将玻璃微电极置于细胞表面,给予负压吸引形成1~10 GΩ的高阻封接,之后加大负压使电极尖端部分的膜片破裂,形成全细胞式记录方式。本实验通道电流的记录均在全细胞记录方式形成稳定5 min后进行,以确保所记录离子通道电流的稳定性。
1.5 过氧化氢作用模型的建立 通过转换正常细胞外液到含过氧化氢(100μmol·L-1)的正常细胞外液5~10 min,持续5 min,灌流速度均维持在6 ml·min-1。
1.6 资料分析及数据处理 记录电流在pCLAMP 8.2软件中Clampfit 8.2程序里进行电流大小的测量和分析。实验数据以¯x±s表示。结果统计分析利用 SPSS 14.0软件(SPSS Inc.,Chicago,Illinois 60606,USA),多个药物浓度给药前后结果比较采用单因素方差分析(one-way ANOVA)。
2 结果
2.1 心肌细胞的形态结构 倒置显微镜下可见分离的单个心室肌细胞,存活率约70%~80%,结构清晰,横纹明显,表面干净,呈长杆状(Fig 1)。
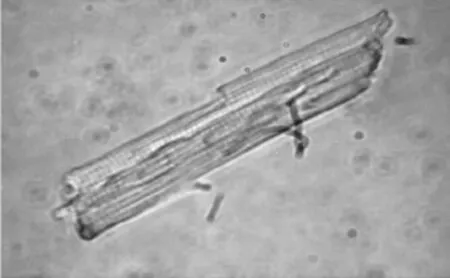
Fig 1 Cell morphology of isolated rat ventricular myocytes
2.2 过氧化氢作用后20 min内 ICa,L的“rundown”现象 电流(I)的强度衰减变化率用峰电流Imax与去极化200 ms时稳态电流的差值和峰电流Imax的比值来表示。心肌细胞(n=6)破膜后过氧化氢分别作用5、10、15、20 min钙电流抑制率变化(%),见Tab 1。

Tab 1 Attenuating changes of Ca2+-currents(I peak)within 20 min(%)
2.3 F2对过氧化氢作用大鼠心室肌细胞ICa,L的影响 为排除所引 ICa,L中 K+、Na+电流的干扰,记录ICa,L的细胞外液中以TEA-Cl和CsCl分别取代NaCl和KCl,电极内液亦用 Cs+取代 K+。钳制电压(holding potential)设置为 -40 mV,以失活 T-型钙通道和钠通道。以0.2 Hz的刺激频率,300 ms的方波以10 mV递增去极化到-30 mV~+70 mV,引出内向电流后加入37.5μl 0.2 mmol·L-1维拉帕米,电流被抑制,表明所检测电流为 ICa,L。从 ICa,L的 I-V关系曲线可知,ICa,L在去极化至+10 mV左右达最大,反转电位在+60 mV~+70 mV之间(Fig 2)。结果表明过氧化氢作用后心室肌细胞ICa,L峰值明显增大。F2(0.1、1、10μmol·L-1)浓度依赖地抑制过氧化氢所致 ICa,L增大,其抑制率分别为(37.50±2.81)%,(54.83±2.93)%,(70.21±2.03)%(P<0.05)。在-40 mV钳制电压条件下,以10 mV为阶跃,自-30~70 mV给予测试电压,记录各测试电压下ICa,L,以电流峰值对测试电压作图,得到钙电流I-V曲线(Fig 2)。过氧化氢作用后钙电流I-V曲线下降,形状无变化,提示过氧化氢作用后心室肌细胞 ICa,L内流增大,F2作用后 ICa,LI-V曲线上移。

Fig 2 Effect of F2 on I Ca,L during H 2 O2 exposure
3 讨论
目前对离子通道的研究通常采用膜片钳全细胞记录技术直接观察研究通道电流的变化。我们课题组先前膜片钳实验观察了F2对正常生理状态下L型钙通道及钾通道的作用,发现F2能浓度依赖地抑制钙通道和钾通道[5-6]。本实验通过建立过氧化氢模型来模拟心肌缺血/再灌注,观察此过程中ICa,L的变化。为了准确记录实验过程中F2对L-型钙通道的阻断作用,首先观察了钙电流记录过程中常见的钙电流衰减现象(“rundown”现象)[7-9]。在实验过程中我们发现过氧化氢作用心肌细胞后对L型钙通道电流的衰减情况影响较大,因此本实验记录过氧化氢作用后钙电流20 min内的衰减变化情况,发现其衰减情况并不严重影响到药物对通道电流的作用。但是40 min后ICa,L衰减明显。因此我们选定过氧化氢作用15 min开始记录钙电流。此外,为了保证在记录电流期间出现的实验效应比较稳定,我们在电极内液中加入了高浓度的EGTA(10 mmol·L-1)和 ATP(5 mmol·L-1),这样可保证电流在记录时间内衰减不明显。
在心肌缺血/再灌注过程中,大量产生的过氧化氢,参与I/R病理过程,并在其中发挥着重要作用。氧自由基可导致细胞膜的损伤,过氧化氢作为其中一种相对稳定的氧自由基,能快速扩散进入细胞并引起一系列细胞功能的改变,其标志是动作电位时程的延长,L-型钙通道的明显开放[10-11]。大量的Ca2+通过开放的钙通道进入细胞,引起细胞内的Ca2+浓度增加,进而导致细胞钙超载。本研究显示过氧化氢引起L-型钙通道电流的明显增大,增大率为(33.65±1.90)%,且钙电流I-V曲线下降。F2阻断过氧化氢所致的心肌细胞膜明显开放的L-型钙通道,ICa,LI-V曲线上移。前期研究发现F2具有阻断正常状态下心肌细胞L-型钙通道及具有拮抗I/R心肌氧化应激的作用[12-14],综合本研究结果,我们有理由推测F2对过氧化氢作用状态下心肌细胞L-型钙通道可能具有直接及间接的调整作用。
综上所述,F2抑制过氧化氢作用引起的心肌细胞ICa,L的增大,减少病理状态下钙离子内流,降低胞内钙离子浓度,从而发挥对缺血心肌组织的保护作用。这提示F2对调节氧自由基紊乱和改善心肌钙稳态有重要作用并有着较好的开发前景。
参考文献:
[1]Zhou Y,Shi G,Zheng J,et al.The protective effects of Egr-1 antisense oligodeoxyribonucleotide on cardiac microvascular endothelial injury induced by hypoxia-reoxygenation[J].Biochem Cell Biol,2010,88(4):687-95.
[2]Huang Z,Li H,Guo F,et al.Egr-1,the potential target of calcium channel blockers in cardioprotection with ischemia/reperfusion injury in rats[J].Cell Physiol Biochem,2009,24(1-2):17-24.
[3]Zhou Y,Zhang Y,Gao F,et al.N-n-butyl haloperidol iodide protects cardiac microvascular endothelial cells from hypoxia/reoxygenation injury by down-regulating Egr-1 expression[J].Cell Physiol Biochem,2010,26(6):839-48.
[4]刘妍妍,白云龙,王 涛,等.白藜芦醇对豚鼠心室肌细胞L型钙通道的影响 [J].中国药理学通报,2007,23(2):181-4.
[4]Liu Y Y,Bai Y L,Wang T,et,al.Effects of resvertrol on L-type calcium channles of guinea pig ventricular myocytes[J].Chin Pharmacol Bull,2007,23(2):181-4.
[5]高分飞,石刚刚,郑锦鸿,等.碘化N-正丁基氟哌啶醇对大鼠心室肌细胞膜钾通道的影响[J].中国药理学通报,2007,23(7):891-5.
[5]Gao F F,Shi G G,Zheng J H,et al.Effects of N-n-butyl haloperidol iodide on on rat myocardial potassium channels[J].Chin Pharmacol Bull,2007,23(7):891-5.
[6]黄展勤,石刚刚,郑锦鸿,等.碘化N-正丁基氟哌啶醇对大鼠心室肌细胞L型钙通道的阻断作用[J].中国药理学通报,2006,22(6):702-5.
[6]Huang Z Q,Shi GG,Zheng JH,et al.Effects of N-n-butyl haloperidol iodide on on rat myocardial L-type calcium channels[J].Chin Pharmacol Bull,2006,22(6):702-5.
[7]Bers D M,Perez-Reyes E.Ca channels in cardiac myocytes:structure and function in Ca influx and intracellular Ca release[J].Cardiovasc Res,1999,42(2):339-60.
[8]Zhen X G,Xie C,Yamada Y,et al.A singleamino acid mutation attenuates rundown of voltage-gated calcium channels[J].FEBS Lett,2006,580(24):5733-8.
[9]Xu JJ,Hao L Y,Kameyama A,et al.Calmodulin reverses rundown of L-type Ca(2+)channels in guinea pig ventricular myocytes[J].Am J Physiol Cell Physiol,2004,287(6):C1717-24.
[10]Ward CA,Giles WR.Ionic mechanism of the effects of hydrogen peroxide in rat ventricular myocytes[J].JPhysiol,1997,500(Pt 3):631-42.
[11]Thomas G P,Sims SM,Cook M A,et al.Hydrogen peroxide-induced stimulation of L-type calcium current in guinea pig ventricular myocytes and its inhibition by adenosine A1 receptor activation[J].J Pharmacol Exp Ther,1998,286(3):1208-14.
[12]Huang Z,Shi G,Gao F,et al.Effects of N-n-butyl haloperidol iodide on L-type calcium channels and intracellular free calcium in rat ventricular myocytes[J].Biochem Cell Biol,2007,85(2):182-8.
[13]Gao F F,Hao SY,Huang Z Q,et al.Cardiac electrophysiological and antiarrhythmic effects of N-n-butyl haloperidol iodide[J].Cell Physiol Biochem,2010,25(4-5):433-42.
[14]Huang Z Q,Shi GG,Zheng JH,et al.Effects of N-n-butyl haloperidol iodide on rat myocardial ischemia and reperfusion injury and L-type calcium current[J].Acta Pharmacol Sin,2003,24(8):757-63.